紫癜性肾炎(Henoch-Schönlein purpura nephritis, HSPN)是儿童最常见的继发性肾小球疾病,其主要病理改变为多聚IgA1免疫复合物在肾小球系膜区沉积,导致系膜细胞增生及基质增生。IgA肾病(IgAN)是临床上另一种常见的肾小球疾病,病理特点也是以多聚IgA1免疫复合物在肾小球系膜区沉积[1-3]。研究发现IgAN和HSPN有共同的遗传特征,具有典型HSPN临床表现的个体以后会展现出IgAN的临床表型,如:在不出现血管炎性皮疹、腹痛或关节症状的情况下,出现一次或多次肉眼血尿发作。因此,目前研究认为HSPN和IgAN有共同的发病机制。
IgA1分子重链CH1和CH2之间的铰链区有一个富含脯氨酸、丝氨酸和苏氨酸的独特区域,此区域含有5个O-链聚糖,O-链聚糖含有N-乙酰氨基半乳糖(GalNAc),GalNAc与半乳糖相连,可直接唾液酸化或通过半乳糖被唾液酸化,可为单唾液酸或双唾液酸形式[4]。正常循环中IgA1铰链区的O-链聚糖以GalNAc和半乳糖双糖形式存在[5]。但如果GalNAc先于半乳糖被唾液酸化,那么这种不成熟的唾液酸形式将妨碍后来的半乳糖残基与GalNAc的连接,导致该位点自身抗原暴露,由此激活自身免疫反应,最终形成免疫复合物,从而导致自身组织脏器的免疫损害[4-5]。目前较多研究已经表明含有半乳糖缺陷IgA1(galactose-deficient IgA1, Gd-IgA1)的循环免疫复合物在IgAN的发病机制中起重要作用[6-7]。研究也表明Gd-IgA1不仅参与IgAN的早期发病机制,而且还能诊断、监测IgAN的发展及预后[4, 6-9]。HSPN与IgAN的肾脏病理改变相似,Gd-IgA1与HSPN的发病是否相关呢?是否能预警HSPN的发生呢?是否与HSPN的预后有关呢?本研究检测HSPN患儿血、尿Gd-IgA1水平,探讨Gd-IgA1早期诊断HSPN的价值。
1 资料与方法 1.1 研究对象选取2018年1月1日至4月30日在湖南省儿童医院肾脏风湿科诊断为过敏性紫癜(HSP)的住院患儿58例为HSP组,其中男35例,女23例,平均年龄7.9±2.9岁,体重指数(BMI)15.9±2.0 kg/m2;HSPN的住院患儿67例为HSPN组,其中男38例,女29例,平均年龄8.9±2.9岁,BMI 16.4±2.0 kg/m2;以同期在医院保健科门诊行健康体检者20例为健康对照组,其中男10例,女10例,平均年龄7.6±3.6岁,BMI 16.0±2.4 kg/m2。各组性别、年龄、BMI等基线资料比较差异无统计学意义(P > 0.05),具有可比性。本研究经医院伦理委员会审批通过(HCHLL-2018-16),并获得患儿家长知情同意。
1.2 诊断标准及排除标准HSP诊断标准参考文献[10]:有典型的紫癜性皮疹,可伴有1项或多项次要指征:(1)弥漫性腹痛;(2)皮肤等组织活检显示有IgA沉积物;(3)任何关节出现急性关节炎或关节痛症状;(4)肾脏受损。HSPN诊断标准参考文献[11]:在HSP病程中(大部分在6个月内),出现血尿和(或)蛋白尿。
排除标准:(1)除HSP以外的血管炎性疾病;(2)健康儿童既往有急慢性肾脏病史者;(3)HSP及HSPN患儿近1个月有使用免疫抑制剂情况及合并其他肾脏病者。
1.3 方法采集各组患儿的实验室资料,包括:血常规、尿常规、24 h尿蛋白排出量,以及血肌酐、尿肌酐、血清免疫球蛋白及补体、血清及尿液Gd-IgA1水平。血清及尿液Gd-IgA1采用人Gd-IgA1酶联免疫吸附检测试剂盒(上海汲泓生物科技有限公司)检测。
1.4 统计学分析采用SPSS 18.0统计软件对数据进行统计学分析。计量资料以均数±标准差(x±s)表示。两组间比较采用两独立样本t检验;多组间比较采用单因素方差分析,组间的两两比较采用SNK-q法。ROC曲线评价诊断指标的敏感度和特异度。P < 0.05为差异有统计学意义。
2 结果 2.1 各组血清免疫球蛋白及补体水平变化HSP组、HSPN组患儿血清IgA水平均高于健康对照组(P < 0.01);血清IgG、IgM、C3、C4水平在各组间比较,差异均无统计学意义(P > 0.05)。见表 1。
| 表 1 各组儿童血清免疫球蛋白及补体水平比较(x±s,g/L) |
|
|
HSP组、HSPN组患儿血清Gd-IgA1水平及尿液Gd-IgA1/尿肌酐比值均高于健康对照组(P < 0.01),HSPN患儿的血清Gd-IgA1水平及尿液Gd-IgA1/尿肌酐比值均高于HSP患儿(P < 0.01),见表 2。
| 表 2 各组儿童血清Gd-IgA1水平及尿液Gd-IgA1/尿肌酐比值比较(x±s) |
|
|
采用ROC法评价血清Gd-IgA1、尿液Gd-IgA1/尿肌酐比值对HSPN患儿的诊断价值。血清Gd-IgA1诊断HSPN的曲线下面积(AUC)为0.784(95%CI:0.706~0.862,P < 0.01),尿液Gd-IgA1/尿肌酐比值诊断HSPN的AUC为0.776(95%CI:0.695~0.857,P < 0.01),提示血清Gd-IgA1、尿液Gd-IgA1/尿肌酐比值对诊断HSPN有较好的意义(图 1)。综合灵敏度和特异度,选择二者之和最大的截断点作为界值。当血清Gd-IgA1≥1 485.57 U/mL时,诊断HSPN的灵敏度为62.7%、特异度为86.2%;当尿液Gd-IgA1/尿肌酐比值≥105.74时,诊断HSPN的灵敏度为76.1%、特异度为70.7%。
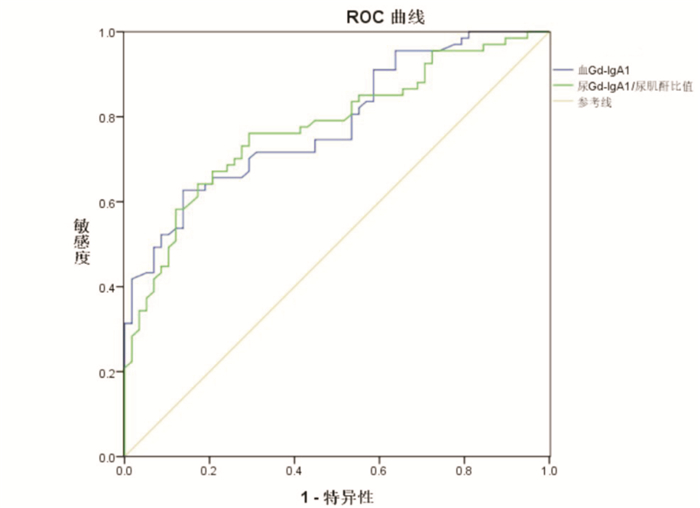
|
图 1 血清Gd-IgA1及尿液Gd-IgA1/尿肌酐比值诊断HSPN的ROC分析图 |
对58例HSP患儿随访6个月,其中9例患儿失访,49例HSP患儿中,23例在随访中出现肾损伤,HSPN发病率为47%。
血清Gd-IgA1诊断HSPN的截断值为1 485.57 U/mL。49例完成随访的HSP患儿中,7例患儿血清Gd-IgA1≥1 485.57 U/mL,随访中均出现了肾损伤,HSPN的发病率为100%;42例患儿血清Gd-IgA1 < 1 485.57 U/mL,随访中有16例出现肾损伤,HSPN的发病率为38%。两组HSPN的发病率比较差异有统计学意义(χ2=6.914,P=0.009)。提示血清Gd-IgA1水平可能可以预测HSP患儿肾脏损害的发生。
尿液Gd-IgA1/尿肌酐比值诊断HSPN的截断值为105.74。49例完成随访的HSP患儿中,15例患儿尿液Gd-IgA1/尿肌酐比值≥105.74,随访中有11例出现肾损伤,HSPN的发病率为73%;34例患儿尿液Gd-IgA1/尿肌酐比值< 105.74,随访中有12例出现肾损伤,HSPN的发病率为35%。两组HSPN的发病率比较差异有统计学意义(χ2=6.047,P=0.014)。提示尿液Gd-IgA1/尿肌酐比值可能可以预测HSP患儿肾脏损害的发生。
3 讨论HSP常累及皮肤、关节、胃肠道及肾脏等多个器官及系统,肾脏损害是影响HSP预后的关键因素,文献报道HSP肾损害的发生率为20%~40%。目前的研究表明HSP、HSPN、IgAN患者血清中可以检测到显著增高的IgA1、IgA1-循环免疫复合物[12-13]。本研究分析了健康儿童、HSP及HSPN患者血清IgA、IgG、IgM、补体C3及C4水平,三组间血清IgG、IgM、补体C3及C4水平均无差异,而HSP及HSPN患儿血清IgA水平显著高于健康儿童,HSP与HSPN患儿血清IgA水平比较差异无统计学意义,显然IgA在HSP及HSPN的发病机制中有一定的作用,但血清IgA对于诊断或预测HSP肾损害的发生没有意义。de Almeida等[14]的研究也表明虽然超过40%的HSP患儿有血清IgA水平升高,但HSP与HSPN患儿之间的血清IgA水平无显著差异。此外,也发现尽管多发性骨髓瘤患者血清IgA水平增高,但是很少有报道显示这些患者中同时合并有HSPN或IgAN者[15]。
目前对于IgAN的研究认为Gd-IgA1在疾病的发生及发展中起着重要的作用,HSPN和IgAN的肾脏病理特征相似,可能有着共同的发病机制。本研究探讨了Gd-IgA1与HSPN的关系,发现健康儿童、HSP、HSPN之间血清Gd-IgA1及尿液Gd-IgA1/尿肌酐比值有显著差异,HSPN患儿血清Gd-IgA1水平及尿液Gd-IgA1/尿肌酐比值最高,显著高于其他两组,提示Gd-IgA1与HSPN的发生相关。Allen等[16]的研究结果与本研究结果相似,发现在HSPN患者中,血清Gd-IgA1水平高于健康对照组及无肾脏损伤的HSP组。
本研究进一步分析Gd-IgA1在HSPN诊断中的价值,发现血清Gd-IgA1诊断HSPN的AUC为0.784,尿液Gd-IgA1/尿肌酐比值诊断HSPN的AUC为0.776,提示血清Gd-IgA1、尿液Gd-IgA1/尿肌酐比值对诊断HSPN有较好的意义。对HSP患儿随访研究发现早期血清Gd-IgA1水平≥1 485.57 U/mL者、尿液Gd-IgA1/尿肌酐比值≥105.74者,HSPN的发生率分别为100%及73%;而血清Gd-IgA1水平、尿液Gd-IgA1/尿肌酐比值无升高者,HSPN的发生率分别为38%及35%;提示Gd-IgA1对于早期诊断HSPN有较好的价值。
| [1] |
Chen JY, Mao JH. Henoch-Schönlein purpura nephritis in children:incidence, pathogenesis and management[J]. World J Pediatr, 2015, 11(1): 29-34. (  0) 0) |
| [2] |
Kawasaki Y, Ono A, Ohara S, et al. Henoch-Schönlein purpura nephritis in childhood:pathogenesis, prognostic factors and treatment[J]. Fukushima J Med Sci, 2013, 59(1): 15-26. DOI:10.5387/fms.59.15 (  0) 0) |
| [3] |
Kang Y, Park JS, Ha YJ, et al. Differences in clinical manifestations and outcomes between adult and child patients with Henoch-Schönlein purpura[J]. J Korean Med Sci, 2014, 29(2): 198-203. DOI:10.3346/jkms.2014.29.2.198 (  0) 0) |
| [4] |
Hastings MC, Moldoveanu Z, Suzuki H, et al. Biomarkers in IgA nephropathy:relationship to pathogenetic hits[J]. Expert Opin Med Diagn, 2013, 7(6): 615-627. DOI:10.1517/17530059.2013.856878 (  0) 0) |
| [5] |
Renfrow MB, Mackay CL, Chamlmers MJ, et al. Analysis of O-glycan heterogeneity in IgA1 myeloma proteins by Fourier transform ion cyclotron resonance mass spectrometry:implications for IgA nephropathy[J]. Anal Bioanal Chem, 2007, 389(5): 1397-1407. DOI:10.1007/s00216-007-1500-z (  0) 0) |
| [6] |
Sanders JT, Hastings MC, Moldoveanu Z, et al. Serial galactosedeficient IgA1 levels in children with IgA nephropathy and healthy controls[J]. Int J Nephrol, 2017, 2017: 8210641. (  0) 0) |
| [7] |
Placzek WJ, Yanagawa H, Makita Y, et al. Serum galactosedeficient-IgA1 and IgG autoantibodies correlate in patients with IgA nephropathy[J]. PLoS One, 2018, 13(1): e0190967. DOI:10.1371/journal.pone.0190967 (  0) 0) |
| [8] |
Yanagawa H, Suzuki H, Suzuki Y, et al. A panel of serum biomarkers differentiates IgA nephropathy from other renal diseases[J]. PLoS One, 2014, 9(5): e98081. DOI:10.1371/journal.pone.0098081 (  0) 0) |
| [9] |
Suzuki H, Allegri L, Suzuki Y, et al. Galact-deficient IgA1 as a candidate urinary polypeptide marker of IgA nephropathy[J]. Dis Markers, 2016, 2016: 7806438. (  0) 0) |
| [10] |
中华医学会儿科学分会免疫学组, 《中华儿科杂志》编辑委员会. 儿童过敏性紫癜循证诊治建议[J]. 中华儿科杂志, 2013, 51(7): 502-507. DOI:10.3760/cma.j.issn.0578-1310.2013.07.006 (  0) 0) |
| [11] |
中华医学会儿科学分会肾病学组. 儿童常见肾脏疾病诊治循证指南(二):紫癜性肾炎的诊治循证指南(试行)[J]. 中华儿科杂志, 2009, 47(12): 911-913. DOI:10.3760/cma.j.issn.0578-1310.2009.12.007 (  0) 0) |
| [12] |
Suzuki Y, Matsuzaki K, Suzuki H, et al. Serum levels of galactose-deficient immunoglobulin (Ig)A1 and related immune complex are associated with disease activity of IgA nephropathy[J]. Clin Exp Nephrol, 2014, 18(5): 770-777. DOI:10.1007/s10157-013-0921-6 (  0) 0) |
| [13] |
Heineke MH, Ballering AV, Jamin A, et al. New insights in the pathogenesis of immunoglobulin A vasculitis (Henoch-Schönlein purpura)[J]. Autoimmun Rev, 2017, 16(12): 1246-1253. DOI:10.1016/j.autrev.2017.10.009 (  0) 0) |
| [14] |
de Almeida JL, Campos LM, Paim LB, et al. Renal involvement in Henoch-Schönlein purpura:a multivariate analysis of initial prognostic factors[J]. J Pediatr (Rio J), 2007, 83(3): 259-266. (  0) 0) |
| [15] |
Zickerman AM, Allen AC, Talwar V, et al. IgA myeloma presenting as Henoch-Schönlein purpura with nephritis[J]. Am J Kidney Dis, 2000, 36(3): E19. (  0) 0) |
| [16] |
Allen AC, Willis FR, Beattie TJ, et al. Abnormal IgA glycosylation in Henoch-Schönlein purpura restricted to patients with clinical nephritis[J]. Nephrol Dial Transplant, 1998, 13(4): 930-934. DOI:10.1093/ndt/13.4.930 (  0) 0) |
 2019, Vol. 21
2019, Vol. 21


