2. 福建医科大学附属福建省妇幼保健院儿科, 福建 福州 350001;
3. 华中科技大学同济医学院附属同济医院儿科, 湖北 武汉 430030
Wolcott-Rallison综合征(Wolcott-Rallison syndrome, WRS, MIM #226980)是一种罕见的常染色体隐性遗传疾病,患者于新生儿期或出生后6个月内发生糖尿病,随后可表现出多发性骨骺发育不良、生长发育迟缓、肝功能异常、甲状腺功能减退及其他非典型临床特征[1-2]。Delépine等[3]于2000年证实真核翻译始动因子2-α激酶3(eukaryotic translation initiation factor 2-alpha kinase 3, EIF2AK3)基因是WRS的致病基因。因WRS发病率低,临床症状发生时间各异,患者常不能在病程早期通过EIF2AK3基因检测而确诊。本研究报道福建省妇幼保健院通过基因检测确诊的1例WRS婴儿患者,发现2个新的EIF2AK3基因突变,并结合文献复习中国人群WRS的临床特征和基因突变情况,旨在提高临床医师对该病的认识。
1 资料与方法 1.1 研究对象患儿,女,1个月29 d。因抽搐6 d、血糖增高5 d入院,起病初有发热。患儿于当地医院住院期间血糖最高达35.0 mmol/L,予头孢噻肟抗感染、胰岛素降血糖以及甘露醇脱水、丙戊酸钠控制惊厥等对症治疗,患儿热退,仍反复抽搐、血糖高。患儿为第2胎第2产,足月顺产,出生体重2.3 kg,混合喂养。父母体健,非近亲结婚。患儿有一6岁哥哥,体健。入院体查:T 36.4℃,P 135次/min,R 35次/min,体重3.8 kg,BP 66/34 mm Hg,神志清楚,精神倦怠,营养中等,发育正常,面色红润,无特殊面容,无呻吟,呼吸稍促,余无特殊。实验室检查:肝功能:丙氨酸氨基转移酶71.8 U/L(参考值:7.0~40.0 U/L)、门冬氨酸氨基转移酶54.5 U/L(参考值:13.0~35.0 U/L)、谷氨酰转肽酶146.7 U/L(参考值:7.0~45.0 U/L)、总蛋白52.6 g/L(参考值:65.0~85.0 g/L)、白蛋白35.7 g/L(参考值:40.0~55.0 g/L)、球蛋白16.9 g/L(参考值:20.0~40.0 g/L)、总胆红素3.7 μmol/L(参考值:5.1~20.0 μmol/L)。碱性磷酸酶500.6 U/L(参考值:5.0~100.0 U/L)。甘油三酯2.16 mmol/L(参考值:0.56~1.69 mmol/L)。肾功能正常。空腹C肽0.19 ng/mL(参考值:1.1~4.4 ng/mL),胰岛素正常,血糖波动于正常或者增高甚至 > 33.3 mmol/L(参考值:3.6~6.1 mmol/L),糖化血红蛋白因过高而无法检测,尿糖+ ~ ++++。头颅MRI示双侧额叶脑白质区对称性异常信号,双侧颞部脑回稍粗大,双侧颞、额、顶部脑外间隙稍增宽。
本研究获得患儿家长知情同意,以及医院医学伦理委员会批准。
1.2 致病基因检测采用安捷伦SureSelect Human All Exon V6试剂盒进行患儿的遗传内分泌疾病基因Panel(检测基因412个,包含已知的糖尿病相关基因49个)高通量测序(武汉康圣达医学检验所有限公司检测)。人类基因突变数据库(HGMD)查找突变位点的收录情况,并采用SIFT、PolyPhen-2及Mutation Taster软件预测错义突变的致病性。参考美国医学遗传学与基因组学学会(American College of Medical Genetics and Genomics, ACMG)基因突变解读指南[4]对突变位点进行致病性综合评估。
抽取患儿、父母及哥哥外周血各2 mL,提取基因组DNA。根据高通量测序检测到的EIF2AK3突变位点,使用Primer-BLAST在线软件(https://www.ncbi.nlm.nih.gov/tools/primer-blast/)设计目标区域扩增引物。第13外显子突变位点扩增引物序列为chr2:88870397-F:TTGTTCAGGGGGTGAGTGC和chr2:88870397-R:CTCCATGCACACCCACTGT;第14外显子突变位点扩增引物序列为chr2:88874268-F:TATTCTTGCAGGCCCC和chr2:88874268-R:TTCAAGCCCACCAGTAGCA。以基因组DNA为模板,使用Taq DNA聚合酶扩增,PCR产物经1%琼脂糖凝胶电泳检测,切胶纯化后利用全自动测序仪ABI377(Applied Biosystems,美国)进行双向测序,测序结果用Chromas(version 2.23)软件进行分析,并与正常序列(NM_004836.5)比对。
2 结果 2.1 基因检测结果及致病性分析高通量测序发现患儿的EIF2AK3基因存在第13外显子区的c.2731_2732delAG杂合突变和第14外显子区的c.2980G > A杂合突变,2个突变在HGMD数据库均无报道。c.2731_2732delAG缺失突变导致第911位密码子发生AAG > GAG改变,编码的氨基酸由赖氨酸变为谷氨酸,造成突变位点下游序列产生移码,异常转录本形成929个氨基酸残基组成的截短肽链。c.2980G > A错义突变导致编码的第944位氨基酸由谷氨酸变为赖氨酸,SIFT预测提示有害、PolyPhen-2预测可能有害、Mutation Taster预测可能有害。经ACMG分级综合评估:c.2731_2732delAG突变具有致病性,c.2980G > A突变可能致病。
Sanger测序(图 1)证实患儿及父亲存在EIF2AK3第13外显子区的c.2731_2732delAG杂合突变,母亲和哥哥该位点为野生型;患儿及母亲、哥哥存在EIF2AK3第14外显子区的c.2980G > A杂合突变,父亲该位点为野生型。患儿的2个突变分别遗传自其父母,符合常染色体隐性遗传疾病的遗传规律。结合患儿抽搐、新生儿糖尿病、肝功能异常等临床特点,确诊为EIF2AK3突变导致的WRS。
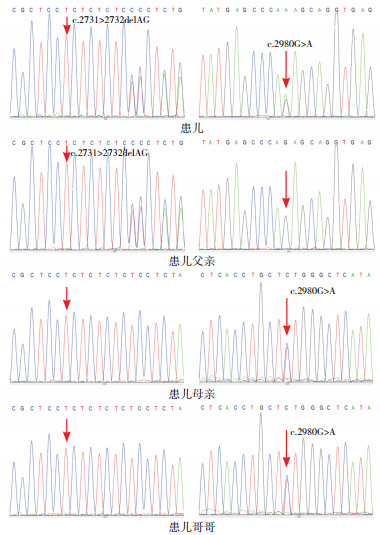
|
图 1 患儿及其亲属EIF2AK3基因突变的Sanger测序 患儿存在c.2731_2732delAG和c.2980G > A复合杂合突变;患儿父亲存在c.2731_2732delAG杂合突变;患儿母亲和哥哥存在c.2980G > A杂合突变。突变位点如箭头所指。 |
入院后予以胰岛素静脉或者皮下注射,并加用格列苯脲口服(每日0.1 mg/kg,逐渐加量至每日1 mg/kg),血糖波动于正常或者增高(最高 > 33.30 mmol/L),出院时肝功能恢复正常,无抽搐。出院后至今仍以诺和灵30R皮下注射(2IU-2IU-1IU,早、中、晚三餐前半小时各一次),血糖控制在7~16 mmol/L,无抽搐发生。随访至1岁5个月时身长80 cm,体重8.5 kg,骨骼发育正常,会说简短句,能独走。
3 讨论WRS是一种罕见的常染色体隐性遗传病,新生儿糖尿病、多发性骨骺发育不良和肝脏受累是三大主要临床特征,还可合并肾功能受损、胰腺功能障碍、中枢性甲状腺功能减退及神经系统异常等,其中新生儿糖尿病是诊断WRS的必备条件,也有罕见的于14个月和30个月发病的[1-2, 5]。多发性骨骺发育不良通常影响长骨、骨盆和椎骨发育,导致患儿在1岁后生长速率减慢,身高小于正常同龄儿童5个标准差,10岁后可能出现永久性生长停滞[1]。WRS肝脏受累表现为反复发作的细胞溶解伴胆汁淤积,肝酶升高和/或胆红素升高,常并发低血糖,重症患者可发生昏迷,超声可见肝脏增大。目前我国仅报道3例WRS,均为男性,均在3月龄时诊断新生儿糖尿病,随后表现出生长迟缓,有的具有多发性骨骺发育不良、肝功能异常、甲状腺功能减退等表现,其中2例于学龄期经基因检测发现EIF2AK3基因突变确诊,见表 1 [6-8]。本研究患儿为女性,出生后1个月发现血糖增高,抽搐,一过性肝功能异常,基因检测发现EIF2AK3基因突变。本例患儿年龄尚小,注意动态监测是否合并骨骺发育不良、生长迟缓、甲状腺功能减退等。
| 表 1 已报道的中国人Wolcott-Rallison综合征患者临床特点和基因突变情况 |
|
|
WRS患儿常以发热伴频繁抽搐入院,头颅MRI可显示脑回肥厚或大脑萎缩等[9-10]。推测与糖尿病相关脑损伤有关。本例患儿抽搐、血糖增高入院,病初也有发热,头部MRI显示双侧额叶脑白质对称性异常信号影、双侧颞部脑回稍粗大,结合病史,考虑糖尿病相关脑损伤。
EIF2AK3基因是WRS的致病基因,位于2p11.2,约70 kb,包含17个外显子,编码EIF2AK3,也被称作胰腺EIF2α激酶(PEK)或PKR样内质网激酶(PERK)[3]。EIF2AK3基因由1 116个氨基酸组成,包括信号肽、调控结构域和激酶结构域(即催化结构域),其致病性突变位点多位于激酶结构域,少数可见于信号肽区域和调控结构域[1-2]。迄今已报道EIF2AK3基因致病变异近80种,包括无义突变、移码突变、错义突变及剪接突变等[5, 9]。本例患儿EIF2AK3基因的c.2731_2732delAG与c.2980G > A突变未见报道,突变位点均位于激酶结构域,c.2731_2732delAG缺失突变导致移码,异常转录本提前终止,形成一个由929个氨基酸组成的截短肽链,部分蛋白功能缺失;c.2980G > A错义突变经多个程序预测为可能有害的。丰岱荣等[6]于2011年报道的WRS病例中,父母非近亲结婚,但一家3个孩子均在3月龄左右出现高血糖,曾针对糖尿病相关基因(INS、ABCCB、GCK)进行了基因检测,没有发现突变;直到先证者出现生长发育落后、骨骼异常等临床表现才考虑到WRS,发现EIF2AK3基因突变确诊。
WRS患儿多予以正规胰岛素治疗,其生存时间明显改善,但随着年龄增长,可逐步出现多系统受累表现[6]。本研究患儿采用胰岛素治疗,血糖逐渐控制,目前约1岁5个月,身长80 cm,体重8.5 kg,能说简短句,能独走。
综上所述,对于诊断为新生儿糖尿病者,无论是否有家族史,均应注意WRS可能,发现EIF2AK3基因突变有助于早期诊断。
| [1] |
Senée V, Vattem KM, Delépine M, et al. Wolcott-Rallison Syndrome:clinical, genetic, and functional study of EIF2AK3 mutations and suggestion of genetic heterogeneity[J]. Diabetes, 2004, 53(7): 1876-1883. DOI:10.2337/diabetes.53.7.1876 (  0) 0) |
| [2] |
Rubio-Cabezas O, Patch AM, Minton JA, et al. Wolcott-Rallison syndrome is the most common genetic cause of permanent neonatal diabetes in consanguineous families[J]. J Clin Endocrinol Metab, 2009, 94(11): 4162-4170. DOI:10.1210/jc.2009-1137 (  0) 0) |
| [3] |
Delépine M, Nicolino M, Barrett T, et al. EIF2AK3, encoding translation initiation factor 2-alpha kinase 3, is mutated in patients with Wolcott-Rallison syndrome[J]. Nat Genet, 2000, 25(4): 406-409. DOI:10.1038/78085 (  0) 0) |
| [4] |
Richards S, Aziz N, Bale S, et al. Standards and guidelines for the interpretation of sequence variants:A joint consensus recommendation of the American College of Medical Genetics and Genomics and the Association for Molecular Pathology[J]. Genet Med, 2015, 17(5): 405-424. DOI:10.1038/gim.2015.30 (  0) 0) |
| [5] |
Julier C, Nicolino M. Wolcott-Rallison syndrome[J]. Orphanet J Rare Dis, 2010, 5: 29. DOI:10.1186/1750-1172-5-29 (  0) 0) |
| [6] |
丰岱荣, 孟岩, 赵时敏, 等. Wolcott-Rallison综合征一例报告及其EIF2AK3基因突变检测[J]. 中华儿科杂志, 2011, 49(4): 301-305. DOI:10.3760/cma.j.issn.0578-1310.2011.04.014 (  0) 0) |
| [7] |
桑艳梅, 刘敏, 杨文利, 等. 真核翻译始动因子2-α激酶3基因突变致Wolcott-Rallison综合征1例[J]. 中华实用儿科临床杂志, 2012, 27(8): 585-587. DOI:10.3969/j.issn.1003-515X.2012.08.010 (  0) 0) |
| [8] |
曹冰燕, 巩纯秀, 吴迪, 等. 新生儿糖尿病13例临床特点分析[J]. 中华糖尿病杂志, 2013, 7(5): 403-407. (  0) 0) |
| [9] |
Abbasi F, Habibi M, Enayati S, et al. A genotype-first approach for clinical and genetic evaluation of Wolcott-Rallison syndrome in a large cohort of Iranian children with neonatal diabetes[J]. Can J Diabetes, 2018, 42(3): 272-275. (  0) 0) |
| [10] |
Triantafyllou P, Vargiami E, Vagianou I, et al. Early-onset diabetes mellitus and neurodevelopmental retardation:the first Greek case of Wolcott-Rallison syndrome[J]. J Pediatr Endocrinol Metab, 2014, 27(9-10): 967-970. (  0) 0) |
 2019, Vol. 21
2019, Vol. 21


