2. 石河子大学医学院, 新疆 石河子 832000
新生儿持续性肺动脉高压(persistent pulmonaryhypertension of the newborn, PPHN)影响约2/1 000的活产婴儿[1]。PPHN的典型特征是肺血管阻力逐渐增加、从右到左的肺外分流血液和出生后低氧血症[2]。一氧化氮(NO)由内皮细胞小凹结构中的内皮型一氧化氮合酶(eNOS)产生,并且NO在维持心血管稳态中起关键作用,包括血管张力、血管平滑肌细胞增殖和血管重塑的调节[3]。本课题前期研究结果表明在低氧诱导的新生C57BL/6小鼠持续性肺动脉高压(PPH)中,钙敏感受体(CaSR)的表达量及肺动脉平滑肌细胞内钙离子浓度增加,在CaSR激动剂组中增加明显,而在CaSR抑制剂组中减少[4-5]。本研究以PPH小鼠模型为基础,分别给予CaSR激动剂和抑制剂干预,通过探讨eNOS的表达及NO浓度的变化,以期为新生儿PPH的临床诊断及治疗提供理论基础。
1 材料与方法 1.1 主要试剂与仪器小鼠抗大鼠eNOS单克隆抗体(美国Abcam公司),小鼠抗大鼠β-actin单克隆抗体、辣根过氧化物酶标记的山羊抗小鼠IgG抗体(北京中杉金桥生物技术有限公司),CaSR激动剂氯化钆(GdCl3,美国Sigma公司),CaSR抑制剂NPS2390(德国R & D公司),eNOS反转录试剂盒、QuantiNova SYBR Green qPCR荧光定量试剂盒(美国Fermentas公司),TRIzol(美国Invitrogen公司),NO测定试剂盒(南京建成生物工程研究所),小鼠脑利钠肽(BNP)ELISA试剂盒(上海江莱生物科技有限公司)。
主要仪器包括低温台式离心机(美国Thermo-scientific公司),荧光定量PCR仪(美国Bio-Rad公司),微量加样器(上海高鹤公司),病理图像分析处理系统(美国Media Cybernetics公司)等。
1.2 实验动物分组及模型建立采用慢性缺氧的方法建立动物模型[4, 6]。SPF级健康C57BL/6小鼠,体重18~25 g,由新疆维吾尔自治区实验动物研究中心提供。怀孕小鼠分娩后,将新生小鼠随机分为对照组、PPH组、激动剂组和拮抗剂组,各20只。对照组新生小鼠暴露在室内空气中,其他3组新生小鼠从出生开始暴露于氧浓度为12%的缺氧室中。激动剂和拮抗剂组小鼠每日分别通过给予GdCl3 16 mg/kg和NPS2390 1 mg/kg腹腔注射1次。同时,PPH组和对照组每日给予同干预组等量的生理盐水腹膜内注射。定期添加水、饲料及更换垫料,连续处理14 d。在14 d造模期间内,每日测量新生幼仔的体重。计算体重增长率(RBWI)以表示幼崽体重的变化。RBWI =(终末体重-初始体重)/初始体重×%。
1.3 标本采集造模完成后,每组新生小鼠用水合氯醛麻醉,打开胸腔。用24-G静脉留置针进行气管插管,用10%福尔马林灌入肺部固定。取出小鼠肺及心脏组织行石蜡包埋,并通过苏木精-伊红(HE)染色观察肺组织形态。同时,取各组未行福尔马林固定的肺组织,在液氮中速冻后于-80℃储存待测。
1.4 肺泡及肺血管形态学检测每组随机选取6张HE染色的肺组织切片以评估肺泡发育。计算肺泡平均内衬间隔(MLI)来表示肺泡平均内径,即肺泡大小[7]。计算径向肺泡计数(RAC)来表示从终末细支气管到最近的结缔组织隔膜的肺泡隔板数量[8]。每组每张肺组织切片中随机选取6~10个视野用于MLI及RAC测量。实验独立重复3次。
每组随机选取6张HE染色的肺组织切片以评估肺血管形态。每张肺组织切片随机选取5个视野测量直径为20~99 μm及100~150 μm的肺小动脉。肺动脉壁厚度(WT)以血管壁厚度占外径百分比表示。WT(%)= 100×(2×血管内侧壁厚度)/血管外径。同时每组随机选取6张HE染色的心脏组织切片,测量右心室与左心室厚度比(RV/LV),作为反映肺动脉高压及右心室肥大的指标。实验独立重复3次。
1.5 Western blot法检测新生小鼠肺组织eNOS蛋白表达水平取50 mg肺组织研磨后置于冷却的蛋白裂解液和PMSF中,静止15 min,在4℃下12 000 r/min离心20 min后取上清,用BCA分析法测蛋白浓度。取50 μg蛋白样品行8%SDS-PAGE凝胶电泳,80 V 120 min将蛋白转移至PVDF膜,在室温下用5%脱脂牛奶封闭2 h;加入小鼠抗大鼠eNOS一抗(1 : 1 000),小鼠抗大鼠β-actin一抗(1 : 1 000)4℃过夜;TBST洗膜3次,每次10 min;加入辣根过氧化物酶标记的山羊抗小鼠IgG二抗(1 : 20 000),常温孵育2 h,显色液显色,定影后用Image J软件分析光密度值。结果以目的蛋白与内参蛋白的比值表示。实验独立重复3次。
1.6 实时荧光定量PCR法检测新生小鼠肺组织eNOS mRNA表达水平根据说明书,采用QuantiNova SYBR Green qPCR试剂盒检测eNOS mRNA相对表达量。引物由上海生工生物工程股份有限公司合成。用于实时荧光定量RT-PCR的引物序列如下:eNOS上游:5' -GTCTGCGGCGATGTCACTATGG-3' ,下游:5' -GTATGCGGCTTGTCACCTCCTG-3' 。MACT(内参)上游:5' -TTCCTTCTTGGGTATGGAAT-3' 。下游:5' -GAGCAATGATCTTGATCTTC-3' 。
使用TRIzol提取新生小鼠肺组织匀浆总RNA,取5 μL进行逆转录操作合成20 μL的cDNA。反应体系:cDNA 3 μL、SYBR Green I 10 μL、上下游引物各1 μL、无酶水5 μL。反应条件:95℃预变性2 min;95℃变性30 s,60℃退火20 s,共运行40个循环。以eNOS PCR产物与MACT内参的荧光密度比值作为eNOS mRNA的相对表达含量,表达的相对定量结果以2-△△CT表示。实验独立重复3次。
1.7 ELISA法检测新生小鼠肺组织匀浆BNP及NO浓度取50 mg肺组织加入适量生理盐水研磨后,置于4℃下3 000 r/min离心20 min,取上清,根据试剂盒说明书,使用小鼠BNP ELISA试剂盒和NO检测试剂盒检测上清液中BNP和NO的水平,通过450nm波长下测定吸光度(OD值)来计算新生小鼠肺组织匀浆中BNP和NO的浓度。实验独立重复3次。
1.8 免疫组化法检测新生小鼠肺组织eNOS表达肺组织用酒精脱水后包埋于石蜡中。将肺组织切片脱蜡处理后,经3%过氧化氢处理,并用枸橼酸抗原热修复,室温冷却后PBS冲洗3次,加入小鼠抗大鼠单克隆eNOS抗体(1 : 500),4℃孵育过夜后加入辣根过氧化物酶标记的山羊抗小鼠IgG二抗(1 : 1 000),加入DAB显色液,中性树胶封片后晾干,置于镜下观察。
1.9 统计学分析采用SPSS 20.0统计软件对数据进行统计学分析,计量资料以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验。P < 0.05为差异有统计学意义。
2 结果 2.1 新生小鼠一般状况四组新生小鼠的体重和RBWI如表 1所示。PPH组和激动剂组的新生小鼠生长缓慢、反应迟钝、精神相对较差,但死亡率并没有增加。与对照组相比较,PPH组和激动剂组的体重和RBWI显著降低(P < 0.05),而抑制剂组小鼠的体重和RBWI并无明显差别(P < 0.05)。
| 表 1 低氧14 d后各组小鼠体重及RBWI比较(x±s) |
|
|
HE染色肺组织切片结果显示:与对照组相比较,PPH组小鼠的肺泡变大,肺泡隔板减少;MLI值增加,RAC值减小(P < 0.05);提示缺氧对肺泡发育有抑制作用。同时,激动剂组的肺泡形态、MLI值、RAC值与PPH组相似,说明CaSR激动剂并没有加重缺氧诱导的肺泡抑制作用。抑制剂组较PPH组肺泡破坏程度有所缓解;MLI值小于PPH组但仍大于对照组,而RAC值大于PPH组但仍小于对照组(P < 0.05);说明在低氧条件下,CaSR抑制剂能改善的肺泡发育,增加肺泡隔板数量,但不能完全恢复。见图 1,表 2。
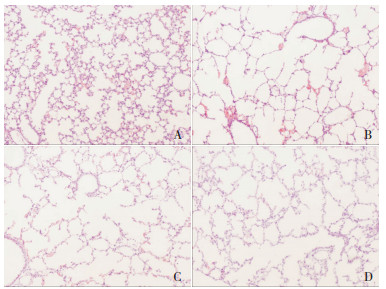
|
图 1 组新生小鼠肺泡形态 (苏木精-伊红染色,×100)A为对照组,B为PPH组,C为激动剂组,D为抑制剂组。与对照组相比,PPH组新生小鼠肺泡破坏显著,肺泡变大,肺泡隔板数量减少;激动剂组新生小鼠与PPH组小鼠相似;抑制剂组较PPH组肺泡破坏程度有所缓解,但仍高于对照组。 |
| 表 2 各组肺泡MLI及RAC比较(x±s) |
|
|
观察各组肺组织HE染色切片,与对照组比较,PPH组和激动剂组小鼠肺小动脉在低氧条件下管壁明显增厚,而抑制剂组小鼠肺小动脉管壁厚度减小,与对照组无明显差异(图 2)。同时,PPH组和激动剂组WT%值均较对照组显著增加(P < 0.05),但激动剂组与PPH组相比差异无统计学意义(P < 0.05);抑制剂组较PPH组WT%值明显降低(P < 0.05)。本实验通过检测BNP浓度反映肺动脉压[9]。PPH组和激动剂组中的BNP浓度较对照组显著增加(P < 0.05),说明PPH组和激动剂组小鼠存在明显的肺动脉高压和肺血管重塑;抑制剂组中BNP浓度较PPH组和激动剂组明显降低,但仍高于对照组(P < 0.05),说明抑制剂组小鼠肺动脉高压和肺血管重塑有所改善,但不能完全恢复。与对照组相比较,PPH组小鼠的RV/LV值显著增加(P < 0.05),说明存在右心室肥大;激动剂组和拮抗剂组RV/LV值较PPH组有所降低,但差异无统计学意义(P < 0.05)。见表 3。
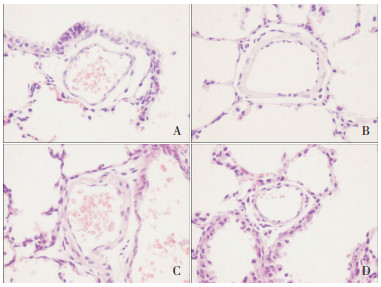
|
图 2 各组新生小鼠肺小动脉血管壁变化 (苏木精-伊红染色,×400)A为对照组,B为PPH组,C为激动剂组,D为抑制剂组。与对照组相比,PPH组和激动剂组血管壁显著增厚,抑制剂组血管壁厚度较PPH组减小,与对照组无明显差异。 |
| 表 3 各组WT%、RV/LV及BNP浓度的比较(x±s) |
|
|
通过Western blot及qRT-PCR检测eNOS的蛋白表达及其mRNA水平,结果显示PPH组eNOS蛋白及其mRNA表达量较对照组明显增加,激动剂组进一步增强eNOS的蛋白及其mRNA表达量(P < 0.05);而抑制剂组与激动剂组相比,eNOS蛋白及其mRNA表达量有所降低,但仍然高于对照组(P < 0.05)。与对照组相比,PPH组中NO浓度升高,激动剂组NO浓度进一步升高(P < 0.05);抑制剂组NO浓度较PPH组有所降低,但仍高于对照组(P < 0.05)。见图 3,表 4。
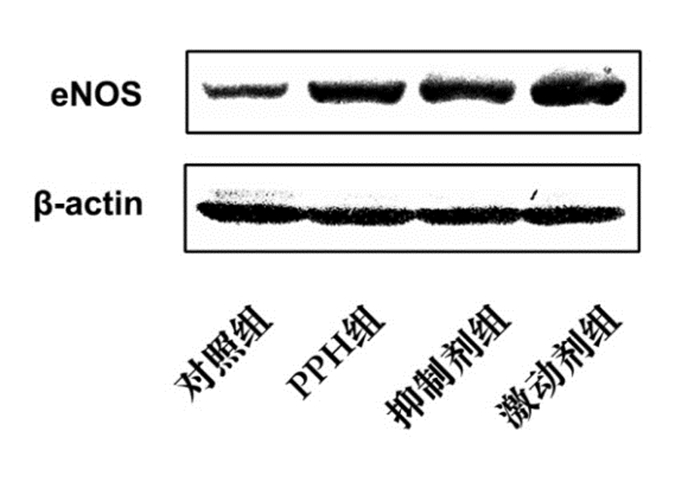
|
图 3 Western blot检测各组新生小鼠肺组织中eNOS蛋白电泳图 |
| 表 4 各组小鼠肺组织eNOS蛋白、mRNA相对表达量及肺组织匀浆中NO浓度比较(x±s) |
|
|
免疫组织化学分析结果表明,eNOS蛋白主要在肺小动脉内皮细胞和平滑肌细胞中表达。与对照组相比,PPH组的肺动脉中表达eNOS的内皮细胞和平滑肌细胞的数量增加(黄色),激动剂组增加更加明显(褐色),而eNOS在抑制剂组中表达有所下降。见图 4。
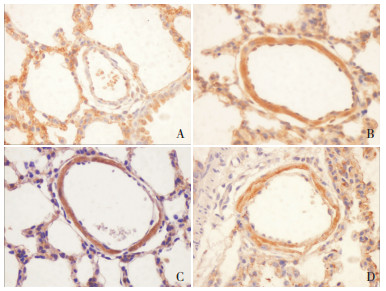
|
图 4 免疫组化法检测各组肺组织eNOS的表达 (DAB,×400)A为对照组,B为PPH组,C为激动剂组,D为抑制剂组。eNOS主要在肺小动脉内皮细胞和平滑肌细胞中表达。与对照组相比,PPH组肺动脉中表达eNOS的内皮细胞和平滑肌细胞数量增加(黄色),激动剂组增加更加明显(褐色),而eNOS在抑制剂组中表达有所下降。 |
本研究通过14 d低氧诱导C57BL/6新生小鼠以建立PPH动物模型,观察CaSR激动剂和抑制剂对模型小鼠eNOS及NO浓度的影响。研究结果显示:与对照组比较,PPH组小鼠肺小动脉管壁厚度、右心室游离壁厚度及肺组织匀浆中BNP浓度均明显增加,这说明PPH新生小鼠模型建立成功。有研究表明,多数患有PPHN的新生儿在出生不久后便会死亡,这与肺血管系统重塑相关[10]。慢性缺氧被认为会导致肺小动脉中膜层平滑肌细胞异常增殖;同时,慢性缺氧也是引起PPHN和加重病理生理状况的重要因素之一。
eNOS是一种多结构域酶,由含有血红素、L-精氨酸、辅因子四氢生物蝶呤和还原酶等结合位点的N末端加氧酶结构域组成。eNOS通过使NADPH衍生的电子传递到位于还原酶结构域的黄素中,然后转移到位于加氧酶结构域中的血红素中,使得血红素铁可以结合O2并通过催化L-精氨酸逐步合成NO[11]。血管内皮细胞释放多种活性物质,其中NO在心血管稳态及血管内皮功能的调节中发挥关键作用,包括局部血管平滑肌张力的调节、血管平滑肌细胞的增殖、动脉粥样硬化和血管重塑的调节[3, 12]。
有研究显示,在慢性阻塞性肺病、心肺转流和充血性心力衰竭引起的肺动脉高压中观察到NO释放减少,并且NO产生减少可能会导致肺动脉高压的发生[13]。本研究结果显示:通过免疫组化染色,eNOS主要在肺小动脉内皮细胞和平滑肌细胞中表达。同时结合Western blot和qRT-PCR结果说明:与对照组相比,PPH组新生C57BL/6小鼠肺动脉中eNOS的表达增加,新生小鼠肺组织匀浆中NO浓度升高。该结果与eNOS蛋白表达在肺动脉高压患者中有一定程度的上调[14]及缺氧诱导的肺动脉高压大鼠的肺组织匀浆中eNOS酶活性增加等研究报道相一致。同时,GdCl3(CaSR激动剂)能够进一步上调eNOS表达和升高NO浓度;而NPS2390(CaSR抑制剂)能下调其表达和降低NO浓度。其可能的原因是,eNOS上存在Ca2+/钙调蛋白(CaM)结合的生物活性结构,并且eNOS的活性由细胞内Ca2+浓度和CaM结合所决定[11]。本课题组前期研究表明,在低氧诱导的新生C57BL/6小鼠PPH中,肺动脉中CaSR的表达量及肺动脉平滑肌细胞内Ca2+浓度增加,在CaSR激动剂组中增加明显,而在CaSR抑制剂组中减少[4-5]。说明在缺氧环境中,肺动脉CaSR表达量增加,同时引起细胞内Ca2+浓度也随之增高,增多的Ca2+与eNOS活性结构上的CaM相结合从而上调eNOS的活性和其表达,进而导致NO浓度增加。进一步激动CaSR能增加eNOS在肺动脉上的表达和活性,并升高NO的浓度,而抑制CaSR能减少这种作用。NO是一种氧自由基性质的分子。生理情况下,由一氧化氮合酶合成的NO可以使得血管平滑肌舒张从而降低血压。但有报道显示,在低氧环境条件下,NO增加过多,并与氧自由基合成过氧亚硝酸盐,发挥细胞毒性作用,引起肺血管内皮损伤,进而导致肺动脉高压的发展[15-16]。本研究结果提示,CaSR可能通过调节Ca2+浓度而影响eNOS和NO的表达,并参与PPH的发病。其具体机制及信号通路有待于课题组进一步研究及探讨。
综上所述,新生小鼠肺动脉中有eNOS的表达,低氧可使eNOS表达和NO浓度增高,激动CaSR可进一步增加eNOS的表达及升高NO浓度,同时NO大量释放可致使肺血管内皮损伤,最终导致PPH的发生。CaSR抑制剂降低eNOS的表达及NO浓度,从而在一定程度上减轻PPH中肺血管损伤并逆转血管构型重建。
| [1] |
Nakwan N. The practical challenges of diagnosis and treatment options in persistent pulmonary hypertension of the newborn:a developing country's perspective[J]. Am J Perinatol, 2018, 35(14): 1366-1375. DOI:10.1055/s-0038-1660462 (  0) 0) |
| [2] |
Drummond WH. Neonatal pulmonary hypertension[J]. Equine Vet J, 1987, 19(3): 169-171. DOI:10.1111/evj.1987.19.issue-3 (  0) 0) |
| [3] |
Godo S, Sawada A, Saito H, et al. Disruption of physiological balance between nitric oxide and endothelium-dependent hyperpolarization impairs cardiovascular homeostasis in mice[J]. Arterioscler Thromb Vasc Biol, 2016, 36(1): 97-107. DOI:10.1161/ATVBAHA.115.306499 (  0) 0) |
| [4] |
王萌萌, 李贺, 张方方, 等. 钙敏感受体在新生小鼠持续性肺动脉高压中的作用[J]. 中国当代儿科杂志, 2017, 19(2): 208-214. (  0) 0) |
| [5] |
李贺, 谷强, 王萌萌, 等. 钙敏感受体对低氧诱导的持续性肺动脉高压小鼠肺动脉平滑肌细胞内钙离子浓度的影响[J]. 中国新生儿科杂志, 2018, 33(1): 59-64. DOI:10.3760/cma.j.issn.2096-2932.2018.01.015 (  0) 0) |
| [6] |
Ambalavanan N, Bulger A, Murphy-Ullrich J, et al. Endothelin-A receptor blockade prevents and partially reverses neonatal hypoxic pulmonary vascular remodeling[J]. Pediatr Res, 2005, 57(5 Pt 1): 631-636. (  0) 0) |
| [7] |
Knudsen L, Weibel ER, Gundersen HJ, et al. Assessment of air space size characteristics by intercept (chord) measurement:An accurate and efficient stereological approach[J]. J Appl Physiol (1985), 2010, 108(2): 412-421. DOI:10.1152/japplphysiol.01100.2009 (  0) 0) |
| [8] |
Cooney TP, Thurlbeck WM. The radial alveolar count method of emery and mithal:a reappraisal 1-postnatal lung growth[J]. Thorax, 1982, 37(8): 572-579. DOI:10.1136/thx.37.8.572 (  0) 0) |
| [9] |
Xu XF, Gu WZ, Wu XL, et al. Fetal pulmonary vascular remodeling in a rat model induced by hypoxia and indomethacin[J]. J Matern Fetal Neonatal Med, 2011, 24(1): 172-182. (  0) 0) |
| [10] |
Wedgwood S, Lakshminrusimha S, Schumacker PT, et al. Hypoxia inducible factor signaling and experimental persistent pulmonary hypertension of the newborn[J]. Front pharmacol, 2015, 6: 47. (  0) 0) |
| [11] |
Siragusa M, Fleming I. The eNOS signalosome and its link to endothelial dysfunction[J]. Pflugers Arch, 2016, 468(7): 1125-1137. DOI:10.1007/s00424-016-1839-0 (  0) 0) |
| [12] |
Rudic RD, Shesely EG, Maeda N, et al. Direct evidence for the importance of endothelium-derived nitric oxide in vascular remodeling[J]. J Clin Invest, 1998, 101(4): 731-736. DOI:10.1172/JCI1699 (  0) 0) |
| [13] |
Kruzliak P, Maruyama J, Maruyama K. Role of nitric oxide in pathophysiology and treatment of pulmonary hypertension[J]. Vitam Horm, 2014, 96: 407-424. DOI:10.1016/B978-0-12-800254-4.00016-7 (  0) 0) |
| [14] |
Komai H, Naito Y, Aimi Y, et al. Nitric oxide synthase expression in lungs of pulmonary hypertensive patients with heart disease[J]. Cardiovasc Pathol, 2001, 10(1): 29-32. (  0) 0) |
| [15] |
曹静, 朱艳萍, 李明霞. 缺氧诱导因子-1α及下游因子在缺氧性肺动脉高压新生大鼠肺内的表达研究[J]. 中国新生儿科杂志, 2014, 29(3): 194-199. DOI:10.3969/j.issn.1673-6710.2014.03.014 (  0) 0) |
| [16] |
桑葵, 周英, 李明霞. 缺氧诱导因子-1α及其调控因子在缺氧性肺动脉高压新生大鼠肺组织的蛋白质表达研究[J]. 中华儿科杂志, 2012, 50(12): 919-924. DOI:10.3760/cma.j.issn.0578-1310.2012.12.011 (  0) 0) |
 2019, Vol. 21
2019, Vol. 21


