急性播散性脑脊髓炎(acute disseminated encephalomyelitis, ADEM)是一种急性的免疫介导的中枢神经系统炎性脱髓鞘疾病,好发于儿童,目前发病机制尚不十分明确。临床特征以脑病、多灶性神经系统症状和体征为主,伴多灶性脱髓鞘病灶。大多数ADEM患儿预后良好并完全康复,但约10%~30%患儿会复发[1],最终诊断为多相性播散性脑脊髓炎(MDEM)、多发性硬化(MS)或视神经脊髓炎谱系疾病(NMOSD)。目前ADEM复发的危险因素及转归预测仍存在困难。本研究对73例首次发生多灶性临床中枢神经系统事件,并符合2012版IPMSSG标准中ADEM诊断标准[2]患儿的临床资料及转归情况进行回顾性分析,以进一步深入认识ADEM的临床特征,探讨其复发因素及转归情况。
1 资料与方法 1.1 研究对象回顾性收集2011年11月至2017年1月于我院住院的152例首次发生多灶性中枢神经系统脱髓鞘患儿的临床资料,其中完全符合2012版IPMSSG修订标准中ADEM诊断标准的73例纳入本研究,并获得患儿监护人知情同意。
ADEM诊断标准包括[2]:(1)首次发作的多灶性中枢神经系统炎性脱髓鞘疾病。(2)具有不能由发热解释的脑病(意识障碍和/或精神行为异常)。(3)发病急性期(3个月内)具有异常的MRI表现,典型的MRI表现为:①弥漫性、边界模糊的较大的病灶(> 1~2 cm),且白质受累为主;②脑白质区T1低信号病灶较少见;③深部灰质病灶(如丘脑或基底节)可能受累。(4)发病3个月或以上无新发的症状、体征或MRI表现。
自起病起3个月后出现新的或旧的神经系统症状或MRI病灶定义为复发。参考2012版IPMSSG修订标准中MDEM及MS的诊断标准对复发进行临床诊断[2]。NMOSD的诊断标准参考2015版视神经脊髓炎谱系障碍国际共识[3]。而对于仅出现MRI病灶的复发,没有进一步临床事件发生的ADEM患者,目前尚无明确可归类疾病[2]。
1.2 研究方法对符合纳入标准的73例患儿的临床特征、辅助检查、治疗情况等进行回顾性分析,并通过返院或电话随访他们的转归及预后情况。随访时间定义为起病至最后一次随访的时间。根据患者转归情况将患儿分为单相ADEM组(未复发组)和复发组,比较两组在临床特征等方面的差异性,以探讨ADEM的复发因素。
1.3 统计学分析采用SPSS 19.0统计软件进行数据处理与分析。符合正态分布的数据采用均数±标准差(x±s)表示,非正态分布数据采用中位数(范围)表示。两组间正态分布的计量资料比较采用成组t检验。计数资料采用例数和百分率(%)表示,组间比较采用χ2检验。P < 0.05表示差异有统计学意义。
2 结果 2.1 一般资料73例ADEM患儿中,男35例,女38例;起病年龄1岁至16岁11个月,平均年龄7±3岁。出院后随访11~69个月,平均随访时间为49±16个月。
2.2 临床特征73例患儿中,43例(59%)具有前驱事件,其中41例(56%)有前驱感染,7例(10%)有疫苗接种史,均在起病前3 d至1个月内发生,以起病前1周内发生较多见。
所有ADEM患儿均具有脑病表现,其中47例(64%)表现为意识改变,54例(74%)表现为精神行为异常。余以发热(53例,73%)、运动障碍(47例,64%)、头痛(47例,64%)、呕吐(40例,55%)表现较为多见。其他常见的临床表现包括自主神经功能障碍(29例,40%)、感觉障碍(26例,36%)、共济失调(26例,36%)、视神经受累症状(23例,32%)、惊厥(17例,23%)等。体格检查发现41例(56%)患儿病理征阳性,仅有24例(33%)患儿脑膜刺激征阳性。
2.3 辅助检查结果(1)脑脊液检查:67例患儿行脑脊液检查,19例(28%)脑脊液白细胞升高[(18~260)×106/L,中位数36×106/L],多以单核细胞升高(84%)为主;14例(21%)脑脊液蛋白升高(0.46~2.22 g/L,中位数0.73 g/L)。
(2)影像学检查:所有患儿均完善了头颅MRI检查,但8例于外院行头颅MRI检查,仅见报告,描述为多灶性脱髓鞘病变,无原始图片溯源和分析。为便于对影像学特征进行详细分析,排除这8例患儿,选取于我院进行头颅MRI检查的65例患儿进行统计分析。其中60例(92%)的患儿表现为双侧受累。病灶边界较模糊、病灶范围较大,病灶部位常以皮层下白质(54例,83%)、丘脑及基底节等深部核团(60%,39例)、脑干(38例,58%)、小脑(27例,42%)受累较多见,而侧脑室旁白质(25例,38%)、胼胝体(17例,26%)、皮层灰质(11例,17%)、半卵圆中心(6例,9%)等部位受累相对少见。共43例患儿完成脊髓MRI检查,20例(47%)患儿有脊髓受累,主要表现为颈髓和/或胸髓受累,其中13例患儿表现为多节段受累(≥3个节段),7例患儿脊髓受累≤2个节段。截取其中几例患儿的头颅/脊髓的影像学图像,其影像学特征见图 1。
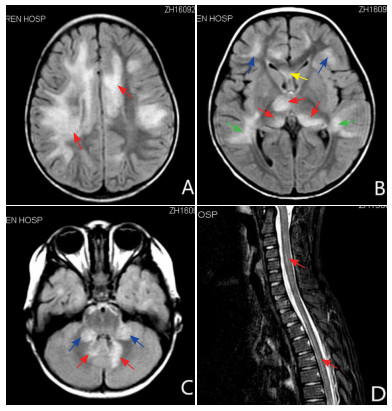
|
图 1 ADEM患儿脑/脊髓MRI图像 A:脑MRI,FLAIR相显示双侧半卵圆中心大片状异常信号(红色箭头所示);B:脑MRI,FLAIR相显示双侧丘脑(红色箭头)、额叶皮层下白质(蓝色箭头)、脑室旁深部白质(绿色箭头)、胼胝体(黄色箭头)异常信号;C:脑MRI,FLAIR相显示双侧小脑半球(红色箭头)及小脑中脚(蓝色箭头)异常信号;D:脊髓MRI,T2相显示颈胸段脊髓长节段异常信号(红色箭头)。 |
(3)特异性抗体检查:24例患儿完成血及脑脊液寡克隆抗体(OB)检查,其中血清OB检查均阴性,仅4例(17%)脑脊液OB阳性。9例患儿完成血及脑脊液NMO抗体检查,均阴性。
(4)诱发电位检查:50例患儿完成视觉诱发电位(VEP)检查,其中异常者占74%,主要表现为P100波波幅降低/缺失、潜伏期延长;18例患儿完成了脑干听觉诱发电位(BEAP)检查,异常者占61%(11例),主要表现为潜伏期延长或听阈增高;29例患儿完成了体感诱发电位(SEP)检查,异常者占66%(19例),主要表现为中枢性异常。
(5)脑电图检查:60例患儿完善了脑电图检查,44例(73%)患儿脑电图异常,以非特异性θ、δ波弥漫性增多较多见,仅4患儿有痫性放电,其中3例患者有惊厥发作表现。另有6例(10%)患儿为界限性脑电图,10例(17%)患儿为正常脑电图。
2.4 治疗患儿首次发病后主要予糖皮质激素和/或静脉用丙种球蛋白(IVIG)冲击治疗,其中43例(59%)予IVIG联合激素治疗;22例(30%)单用激素治疗;5例(7%)单用IVIG冲击治疗。还有3例(4%)为外院诊治后转入我院患儿,因病程已超过2周,且入院时临床症状已明显好转,故未使用激素/IVIG治疗。本研究中共31例患儿因病初院外诊断不明,导致至我院明确诊断后予以激素和/或IVIG治疗的时间较晚(距起病时间 > 2周)。
2.5 ADEM预后及复发因素分析随访时间为11~69个月(49±16个月)。随访发现1例患儿死亡,该患儿病情危重,具有严重脑病,伴惊厥、视神经炎、头痛等表现,院外予IVIG及甲强龙冲击治疗后转入我院,住院1 d家属放弃治疗,出院3 d后死亡。有2例患儿遗留神经系统后遗症,1例癫痫难以控制,1例遗留智力低下。上述3例患儿开始激素和/或IVIG治疗时间均较晚(> 2周)。
随访期间共15例(21%)患儿复发,最终4例诊断为MDEM,7例诊断为MS,2例诊断为NMOSD,余下2例目前尚无可归类疾病。复发时间为3~34个月,平均复发时间为9个月,其中14例在2年以内复发。
与单相ADEM组比较,复发组IVIG和/或激素治疗时间距起病 > 2周的比例更高(P=0.033);复发组较单相ADEM组更易出现深部核团受累(P=0.043);复发组脊髓损伤时更多表现为长节段脊髓(≥3个节段)损伤(P=0.005)。见表 1~3。
| 表 1 单相ADEM组与复发组治疗情况的比较[n(%)] |
|
|
| 表 2 单相ADEM组与复发组临床特征的比较 |
|
|
| 表 3 单相ADEM组与复发组辅助检查结果的比较[%(阳性数/总数)] |
|
|
ADEM是常见的中枢神经系统脱髓鞘疾病之一,不同国家发病率有所不同,这可能与种族、环境、气候的不同有关,相关研究报道国内ADEM每年的发病率约为0.3/10万[4]。ADEM临床表现复杂多样,且轻重不一,与炎症脱髓鞘累及的部位和严重程度有关[5]。其临床症状以急性脑病伴多灶性神经功能障碍为特征,病初常有发热、头痛、呕吐等非特异性表现,随着病情进展,逐渐出现神经系统症状,如脑病、锥体征、共济失调、急性偏瘫、视神经炎或其他脑神经损害、惊厥、脊髓炎综合征及言语障碍[6-7]。
ADEM发病高峰为5~9岁,男女发病率无显著差异[4, 8]。发病前常有前驱感染或疫苗接种史,以前驱感染较多见,但并不是所有ADEM患儿都具有前驱事件,有无前驱事件并不是诊断ADEM的特异指标[9-10]。前驱事件发生的时间目前尚无定论,可以是发病前2~30 d,甚或更久[11]。本研究纳入的患儿男女比例相当,发病年龄为7±3岁,56%有前驱感染,10%有疫苗接种史,多于发病前1周内发生。
根据ADEM诊断标准,脑病(意识障碍/精神行为异常)是其诊断的必要条件。本研究纳入的所有患儿均具脑病表现。但近年来关于ADEM是否必须具有脑病表现及脑病表现如何明确界定的争议越来越多。Koelman等[12]进行的一项关于ADEM的多中心大样本研究中,将无脑病但有其他典型ADEM表现的患者纳入分析,发现符合IPMSSG诊断标准的儿童患者仅占70%。有研究回顾性分析了52例2008~2015年按照丹麦实施的临床ADEM诊断标准(脑病及多灶性神经功能障碍并不是诊断ADEM的先决条件)诊断的丹麦病人,平均随访4.5年,与IPMSSG的ADEM诊断标准对比,发现仅71%的病人有脑病,50%的病人有多灶性神经功能障碍,而完全符合IPMSSG诊断标准的患者仅占35%。因此,该学者认为目前IPMSSG的ADEM诊断标准过于严格,当MRI及其他临床特征符合ADEM时,脑病及多灶性神经系统损害支持诊断,但并不是必须的,IPMSSG诊断标准的下一次更新将需要考虑这些发现[13-14]。本研究中,除了脑病外,以发热、运动障碍、头痛、呕吐表现较为多见,其他常见的临床症状包括自主神经功能障碍、感觉障碍、共济失调、视神经受累症状、惊厥等。
ADEM各实验室检查缺乏特异性,但影像学对诊断具有重要意义。头颅MRI相比于CT扫描,其特异性和敏感性更好,是诊断ADEM及病情随访、判断预后的重要证据。典型的头颅MRI表现为双侧多灶性、非对称性长T1长T2异常信号影,病变主要累及皮层下白质、脑干、小脑、丘脑及基底节[5-6]。与以往报道一致,本研究中以皮层下白质、丘脑/基底节等深部核团、脑干、小脑受累为主。ADEM亦可累及脊髓,相关文献报道脊髓受累率为11%~28%,通常累及颈胸髓[15]。而本研究中脊髓病变率高达47%,这可能与患者选择性完善脊髓检查有关,即更多是在临床考虑可能有脊髓病变情况下再行脊髓MRI检查,导致阳性率明显升高。
目前尚无ADEM标准治疗方案,目前公认的首选治疗方案是糖皮质激素及IVIG冲击治疗[6]。本研究中ADEM患者经正规治疗后,大多预后良好,仅3例患儿预后差,这3例患儿治疗时间均较晚,提示免疫治疗的时机对预后有重要影响,但还需进一步研究进行验证。
对ADEM复发危险因素的探讨一直是研究的热点,早在2004年Mikaeloff等[16]就对脱髓鞘疾病的复发危险因素进行探讨,发现MRI病变累及脊髓与疾病复发相关。陈小青等[17]回顾性分析34例ADEM患儿,发现视觉诱发电位异常、发病距大剂量糖皮质激素治疗时间延迟可能是ADEM复发的高危因素。Suppiej等[1]研究发现,脑脊液OB阳性及VEP异常可能是MDEM患儿慢性病程的早期征兆。还有研究发现,MRI幕下病变(小脑、脑干)、深部灰质受累患儿更有可能发生第二次脱髓鞘事件[18-19]。本研究经对比分析发现,≥3个节段的长节段脊髓受累、深部核团受累,以及IVIG和/或激素治疗的时间距起病 > 2周者更容易复发。
近年来越来越多的研究探讨髓鞘少突胶质细胞糖蛋白(MOG)抗体在ADEM中的作用。Duignan等[20]研究报道约64.3% ADEM患儿血清MOG抗体阳性,而在复发ADEM患儿中,血清MOG抗体阳性率高达96%,提示MOG抗体亦可能是ADEM复发的危险因素。
综上所述,ADEM并不是一种罕见的脱髓鞘疾病,当临床出现急性脑病症状及多灶性神经功能障碍时,需高度警惕此病,但当不具有典型脑病,而具有其他ADEM的典型表现是否可诊断为ADEM还需进一步探讨。目前就ADEM复发的危险因素尚无明确定论,不同研究得出的结果有所不同。本研究经对比分析发现,MRI深部核团受累、≥3个节段的长节段脊髓病变、IVIG和/或激素治疗时间较晚(> 2周)可能与ADEM复发相关,但尚需更多大样本的研究深入探讨ADEM复发的危险因素。
| [1] |
Suppiej A, Vittorini R, Fontanin M, et al. Acute disseminated encephalomyelitis in children:focus on relapsing patients[J]. Pediatr Neurol, 2008, 39(1): 12-17. DOI:10.1016/j.pediatrneurol.2008.03.009 (  0) 0) |
| [2] |
Krupp LB, Tardieu M, Amato MP, et al. International Pediatric Multiple Sclerosis Study Group criteria for pediatric multiple sclerosis and immune-mediated central nervous system demyelinating disorders:revisions to the 2007 definitions[J]. Mult Scler, 2013, 19(10): 1261-1267. DOI:10.1177/1352458513484547 (  0) 0) |
| [3] |
Wingerchuk DM, Banwell B, Bennett JL, et al. International consensus diagnostic criteria for neuromyelitis optica spectrum disorders[J]. Neurology, 2015, 85(2): 177-189. DOI:10.1212/WNL.0000000000001729 (  0) 0) |
| [4] |
Xiong CH, Yan Y, Liao Z, et al. Epidemiological characteristics of acute disseminated encephalomyelitis in Nanchang, China:a retrospective study[J]. BMC Public Health, 2014, 14: 111. DOI:10.1186/1471-2458-14-111 (  0) 0) |
| [5] |
Giri PP, Bhattyacharya S, Das D, et al. Acute disseminated encephalomyelitis:a clinical and neuroradiological profile of pediatric patients[J]. Neurol India, 2016, 64(6): 1187-1192. DOI:10.4103/0028-3886.193808 (  0) 0) |
| [6] |
Pohl D, Alper G, Van Haren K, et al. Acute disseminated encephalomyelitis:updates on an inflammatory CNS syndrome[J]. Neurology, 2016, 87(9 Suppl 2): S38-S45. (  0) 0) |
| [7] |
Wender M. Acute disseminated encephalomyelitis (ADEM)[J]. J Neuroimmunol, 2011, 231(1-2): 92-99. DOI:10.1016/j.jneuroim.2010.09.019 (  0) 0) |
| [8] |
Pohl D. Epidemiology, immunopathogenesis and management of pediatric central nervous system inflammatory demyelinating conditions[J]. Curr Opin Neurol, 2008, 21(3): 366-372. DOI:10.1097/WCO.0b013e3282fd172b (  0) 0) |
| [9] |
Karussis D, Petrou P. The spectrum of post-vaccination inflammatory CNS demyelinating syndromes[J]. Autoimmun Rev, 2014, 13(3): 215-224. DOI:10.1016/j.autrev.2013.10.003 (  0) 0) |
| [10] |
Young NP, Weinshenker BG, Lucchinetti CF. Acute disseminated encephalomyelitis:current understanding and controversies[J]. Semin Neurol, 2008, 28(1): 84-94. DOI:10.1055/s-2007-1019130 (  0) 0) |
| [11] |
Steiner I, Kennedy PG. Acute disseminated encephalomyelitis:current knowledge and open questions[J]. J Neurovirol, 2015, 21(5): 473-479. DOI:10.1007/s13365-015-0353-z (  0) 0) |
| [12] |
Koelman DL, Chahin S, Mar SS, et al. Acute disseminated encephalomyelitis in 228 patients:a retrospective, multicenter US study[J]. Neurology, 2016, 86(22): 2085-2093. DOI:10.1212/WNL.0000000000002723 (  0) 0) |
| [13] |
Hardy TA. How should we diagnose acute disseminated encephalomyelitis?[J]. Dev Med Child Neurol, 2018, 60(11): 1070. DOI:10.1111/dmcn.2018.60.issue-11 (  0) 0) |
| [14] |
Boesen MS, Blinkenberg M, Koch-Henriksen N, et al. Implications of the International Paediatric Multiple Sclerosis Study Group consensus criteria for paediatric acute disseminated encephalomyelitis:a nationwide validation study[J]. Dev Med Child Neurol, 2018, 60(11): 1123-1131. DOI:10.1111/dmcn.2018.60.issue-11 (  0) 0) |
| [15] |
Javed A, Khan O. Acute disseminated encephalomyelitis[J]. Handb Clin Neurol, 2014, 123: 705-717. DOI:10.1016/B978-0-444-53488-0.00035-3 (  0) 0) |
| [16] |
Mikaeloff Y, Adamsbaum C, Husson B, et al. MRI prognostic factors for relapse after acute CNS inflammatory demyelination in childhood[J]. Brain, 2004, 127(Pt 9): 1942-1947. (  0) 0) |
| [17] |
陈小青, 王治平, 江帆. 急性播散性脑脊髓炎临床特征及复发因素分析[J]. 华南国防医学杂志, 2014, 28(11): 1076-1079. (  0) 0) |
| [18] |
Kariyawasam S, Singh RR, Gadian J, et al. Clinical and radiological features of recurrent demyelination following acute disseminated encephalomyelitis (ADEM)[J]. Mult Scler Relat Disord, 2015, 4(5): 451-456. DOI:10.1016/j.msard.2015.06.013 (  0) 0) |
| [19] |
Verhey LH, Branson HM, Shroff MM, et al. MRI parameters for prediction of multiple sclerosis diagnosis in children with acute CNS demyelination:a prospective national cohort study[J]. Lancet Neurol, 2011, 10(12): 1065-1073. DOI:10.1016/S1474-4422(11)70250-2 (  0) 0) |
| [20] |
Duignan S, Wright S, Rossor T, et al. Myelin oligodendrocyte glycoprotein and aquaporin-4 antibodies are highly specifc in children with acquired demyelinating syndromes[J]. Dev Med Child Neurol, 2018, 60(9): 958-962. DOI:10.1111/dmcn.13703 (  0) 0) |
 2019, Vol. 21
2019, Vol. 21


