2. 汕头大学医学院第二附属医院新生儿科, 广东 汕头 515041;
3. 汕头大学医学院第一附属医院生殖医学中心, 广东 汕头 515041
随着经济发展和医疗水平的提高,早产儿的存活率逐渐增加[1],然而,由于早产儿各器官系统发育不成熟,与其快速生长营养的大量需求相矛盾,且代谢更易受体内外环境的影响,相对于足月儿具有较高的发病率和病死率[2]。研究表明,早产儿体内葡萄糖储存较少,利用率高,糖原消耗大,体内储存脂肪分解和酮体生成也增加[3],蛋白质转换率高,这会严重干扰其自身代谢环境的稳定,甚至诱发迟发性的代谢性酸中毒和引起神经系统损害[4]。了解该阶段早产儿的代谢特点对临床正确提供合理营养支持和寻找早产儿多发疾病的代谢靶点至关重要。
代谢组学是疾病相关重要生物标志物筛选的高效技术手段,对于早期诊断和预后具有重要意义[5],但多集中于癌症的研究领域,有关早产儿则较少。基于此,本研究拟收集喂养前早产儿临床血清学资料,应用气相色谱-质谱联用(GC-MS)技术,分析其代谢轮廓,探讨早产儿与足月儿的代谢差异。
1 资料与方法 1.1 临床资料选取2017年6月至2018年1月我院出生的未开始喂养的早产儿19例为早产儿组,出生月龄29+4~34+3周,出生体重1.5~2.2 kg;另选取未开始喂养的足月儿20例为足月儿组,出生月龄38+2~40+5周,出生体重2.6~3.8 kg。早产儿纳入标准:(1)妊娠≤35周出生;(2)体重≤2.2 kg;(3)无遗传代谢病或先天畸形,出生后生命体征稳定。足月儿纳入标准:(1)妊娠≥37周出生;(2)体重≥2.5 kg;(3)无遗传代谢病或先天畸形,出生后生命体征稳定。剔除标准:出生后立即进行喂养或出现严重疾病。本研究获得汕头大学医学院第二附属医院医学伦理委员会批准,样本的采集获得新生儿家属的知情同意。
1.2 血清GC-MS检测采集两组新生儿血清3 mL置于-80℃保存,移取样本80 μL至1.5 mL EP管中,加入10 μL内标(L-2-氯苯丙氨酸,0.3 mg/mL),涡旋震荡10 s。加入240 μL甲醇-乙腈(2 : 1)混合溶液,涡旋震荡1 min,冰水浴超声提取5 min,离心10 min,取150 μL上清液装入玻璃衍生瓶中。加入80 μL甲氧胺盐酸盐吡啶溶液,涡旋震荡2 min后进行肟化反应。将样本取出后再加入80 μL的BSTFA衍生试剂和20 μL的正己烷,涡旋震荡2 min后,于70℃反应60 min。质控样本由所有样本的提取液等体积混合制备而成。取出样本后进行GC-MS代谢组学分析。
采用美国安捷伦公司的7890B-5977A GC/MSD气质联用仪采集数据。色谱条件:DB-5MS毛细管柱,高纯氦气流速1.0 mL/min,260℃,进样量1 μL。质谱条件:电子轰击离子源230℃,四级杆150℃,电子能量70 eV。全扫描模式范围:m/z 50~500。每15个分析样本中插入1个质控样本,以考察分析过程的重复性。
1.3 数据分析将GC-MS的原始数据经ChemStation分析软件转换为CDF格式,导入ChromaTOF 4.34软件进行预处理,并使用Fiehn数据库对代谢物进行定性、峰对齐,导出CSV格式的三维数据矩阵,将数据矩阵中的数值进行log2转换后导入SIMCA 14.0软件进行多维分析。
通过MBROLE通路分析功能,差异代谢物[变量权重值(VIP) > 1或P < 0.01]根据数据库KEGG(http://www.genome.jp/KEGG/pathway.html)进行代谢途径的通路分析,获得其代谢通路的富集结果。
从临床检验结果中选择可能与差异代谢物存在紧密关系的指标,利用SPSS 21.0统计软件计算差异代谢物与临床相关指标间的Pearson相关系数。绘制受试者工作特征曲线(ROC)并计算出曲线下面积(AUC)。
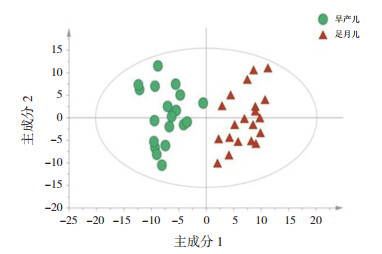
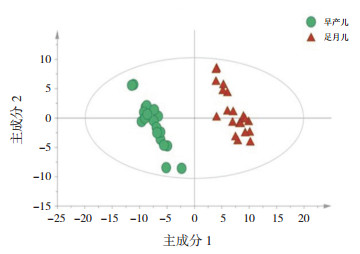
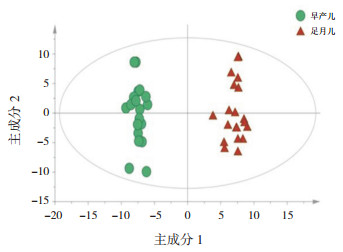
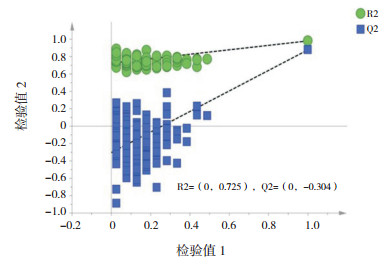
2 结果 2.1 喂养前早产儿组血清代谢轮廓分析两组标本的主成分分析(PCA)、偏最小二乘法判别分析(PLS-DA)、正交偏最小二乘法分析(OPLS-DA)得分散点图分别见图 1~3,OPLS-DA模型的200次响应排序检验图见图 4。
|
图 1 主成分分析得分散点图 |
|
图 2 偏最小二乘法判别分析得分散点图 |
|
图 3 正交偏最小二乘法分析得分散点图 |
|
图 4 正交偏最小二乘法分析的200次响应排序检验图 R2、Q2所形成的两条直线越平行表示模型拟合越好。 |
OPLS-DA模型显示喂养前早产儿组的代谢轮廓明显分开,该模型的R2X、R2Y及Q2值分别为0.602、0.980、0.877(Q2 > 0.5,R2X、R2Y越接近1,说明模型拟合越好);经过200次置换验证得到R2、Q2截距分别为0.725、-0.304,提示OPLS-DA模型未过拟合,两组样本在OPLS-DA得分图上具有显著的差异(谱分离)。
2.2 喂养前早产儿血清差异代谢物及代谢路径分析检测到的代谢物个数:397个。多维模式中,VIP > 2的差异代谢物有9种,在多元变量统计分析软件SIMCA中VIP > 1即有意义,表示差异代谢物在早产儿与足月儿之间的区分度高;单维模式中,经过t检验,P < 0.01即说明差异代谢物在早产儿与足月儿之间具有显著差别,其中P值最小的差异代谢物有9种;取上述两种情况并集的差异代谢物(13种),这些差异代谢物中,早产儿与足月儿中的变化倍数(FC)最大为毛地黄黄酮,最小为戊醛糖、月桂酸、邻琥珀酰高丝氨酸。筛选的结果见表 1。
| 表 1 喂养前早产儿组与足月儿组血清差异显著代谢物 |
|
|
喂养前早产儿/足月儿代谢通路富集图见图 5。被扰动的代谢通路包括ABC转运蛋白、β-丙氨酸、嘧啶、色氨酸、精氨酸和脯氨酸、半胱氨酸和蛋氨酸的代谢,以及脂肪酸、泛酸和辅酶A、不饱和脂肪酸、氨基酰-tRNA的合成。
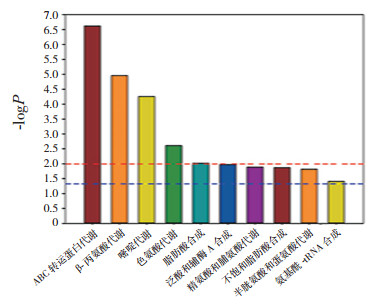
|
图 5 喂养前早产儿/足月儿代谢通路富集图 以代谢通路名称为横坐标,以-logP为纵坐标。图中-logP > 2.0(即P < 0.01时)及-logP > 1.3(即P < 0.05时),信号通路有显著差异性。 |
差异代谢物的ROC分析结果见图 6。计算得出O-膦酰苏氨酸、毛地黄黄酮、鞣酸、单硬脂酸甘油酯、柠康酸、D-果糖-1,6-二磷酸的AUC > 0.9。对这6个高效区分早产儿与足月儿的差异性代谢物的ROC进行拟合,使用SPSS 21.0中的逻辑回归算法绘制,计算出6个差异代谢物综合变量的AUC值为0.999(95%CI:0.998~1.000) > 0.95,所以,这6个差异代谢物的综合变量可作为区分早产儿与足月儿的生物指标。
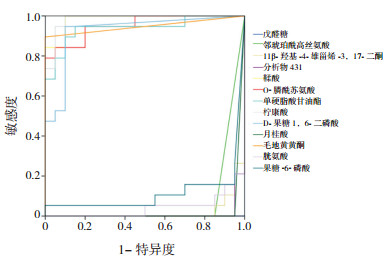
|
图 6 差异代谢物对于早产儿预测的ROC分析图 |
各差异代谢物与临床相关指标之间的Pearson相关系数见表 2。白蛋白与邻琥珀酰高丝氨酸、柠康酸、果糖-6-磷酸之间,总胆红素与戊醛糖、11β-羟基-4-雄甾烯-3,17-二酮、分析物431、鞣酸、单硬脂酸甘油酯、月桂酸、果糖-6-磷酸之间存在中度相关关系(0.5 < r < 0.8,P < 0.05)。
| 表 2 差异代谢物与临床相关指标之间的Pearson相关系数 |
|
|
早产儿出生后要快速适应外界环境,由于各系统发育不成熟,糖代谢功能处于未成熟状态,体内糖原和脂肪储备不足,容易受内外环境影响,引起体内各种内分泌激素的变化[6],同时,某些酶的活性较低或完全缺乏,也影响了相应氨基酸的代谢。若能系统地揭示某一时刻早产儿全面的代谢组学特征,将有助于提高我们对早产儿营养支持[7]及与早产密切相关疾病的认识[8]。
本研究选择血清作为检测标本,主要考虑血清代谢的改变可反映其生理或病理总体的代谢特征。血清代谢物主要受到受检者本身疾病、营养情况及检测条件等方面的影响,所以本研究选择了刚出生的新生儿血清,早产儿是以单纯早产在医院过渡,足月儿是刚出生健康足月儿,均未进行喂养及静脉营养,尽可能排除掉血清代谢物的干扰因素。
本研究利用VIP、P值及FC筛选出最为显著的差异代谢物,其中毛地黄黄酮在早产儿组中明显升高,戊醛糖、邻琥珀酰高丝氨酸、月桂酸等在早产儿组中明显降低,差异代谢物的代谢通路主要集中在氨基酸和脂肪的代谢与合成中。这一结果提示,在早产儿的营养支持中,为避免早产儿应用脂肪乳剂所导致的并发症危险[9]及补充充分的营养成分,可适当减少相应物质的供给(如不饱和脂肪酸),或补充相应的物质(如月桂酸)。通过差异代谢物及代谢通路分析,在早产儿合理补充氨基酸和脂肪乳,增加促进脂肪代谢物质,改善早产儿营养代谢状况具有重要意义[10]。
进一步查阅文献,了解差异代谢物与早产相关疾病的关系。此前有人研究早产儿代谢组学发现12个差异代谢物,其中月桂酸、胆固醇、D-甘露糖等差异明显[11],部分与本研究相一致。在这些差异代谢物中,戊醛糖具有较强的还原性,能够快速的诱导体外蛋白质发生非酶促糖基化反应,导致小鼠的认知功能损伤[12],在2型糖尿病中亦有毒性作用[13],而早产儿戊醛糖的减少或许是一种代谢方面的保护因素。邻琥珀酰高丝氨酸作为胞间信号分子协调细菌群体基因的表达[14],其在早产儿中的含量降低会导致菌群失调,这可能是早产儿容易发生肠炎性疾病、肺炎等疾病的重要因素之一。月桂酸进入人体后会与甘油结合成月桂酸甘油酯,可以破坏微生物外膜,杀灭微生物[15],而在母乳中富含月桂酸,母乳喂养可降低早产儿坏死性小肠结肠炎等疾病的发生[16],因此,早产儿易患感染性疾病可能与月桂酸的减少有关。毛地黄黄酮对重组人蛋白激酶CK2全酶活性具有抑制作用,从而影响多种细胞活动[17],早产儿血清中毛地黄黄酮升高的影响也应结合具体的细胞环境进行分析。这些差异代谢物或多或少与早产儿多发疾病有关,或许可通过干扰其代谢通路达到预防疾病的目的,目前也有人通过动物模型在进行尝试[18]。
此前,早产儿代谢组学与相关疾病的研究中,Stewart等[19]和Dessì等[20]均未发现单一代谢物可用于诊断小肠结肠炎等相关疾病,本研究中白蛋白、总胆红素等临床指标与某些差异代谢物虽呈现中度相关性,但这尚不能单独作为特定疾病的标记物,本课题组将在进一步的追踪中探索是否有多个代谢物可用于某类疾病的预测。
综上所述,本研究基于GC-MS技术对早产儿及足月儿血清进行代谢组学分析,发现了13种差异代谢物,其中4种差异最为显著,这对早产儿合理补充营养成分,防治早产相关疾病提供了一定的依据。
| [1] |
Helenius K, Sjörs G, Shah PS, et al. Survival in very preterm infants:an international comparison of 10 national neonatal networks[J]. Pediatrics, 2017, 140(6): e20171264. DOI:10.1542/peds.2017-1264 (  0) 0) |
| [2] |
Trembath AN, Payne AH, Colaizy TT, et al. The problems of moderate preterm infants[J]. Semin Perinatol, 2016, 40(6): 370-373. DOI:10.1053/j.semperi.2016.05.008 (  0) 0) |
| [3] |
Hamosh M. Lipid metabolism in premature infants[J]. Biol Neonate, 1987, 52(Suppl 1): 50-64. (  0) 0) |
| [4] |
姜燕飞, 戴智勇, 李勇. 早产儿的临床特点及营养支持对其生产发育的影响[J]. 食品与营养科学杂志, 2014, 3: 29-34. (  0) 0) |
| [5] |
Dudzik D, Barbas-Bernardos C, García A, et al. Quality assurance procedures for mass spectrometry untargeted metabolomics. a review[J]. J Pharm Biomed Anal, 2018, 147: 149-173. DOI:10.1016/j.jpba.2017.07.044 (  0) 0) |
| [6] |
Rozance PJ. Glucose metabolism in the preterm infant[J]. J Pediatr, 2011, 158(6): 874-875. DOI:10.1016/j.jpeds.2011.02.013 (  0) 0) |
| [7] |
吴鹰军, 吴时光, 李思涛, 等. 用串联质谱技术区别早产儿与足月儿血代谢组学生物标志物[J]. 中华实用儿科临床杂志, 2016, 31(17): 1325-1328. DOI:10.3760/cma.j.issn.2095-428X.2016.17.013 (  0) 0) |
| [8] |
Hicks LC, Ralphs SJ, Williams HR. Metabonomics and diagnostics[J]. Methods Mol Biol, 2015, 1277: 233-244. DOI:10.1007/978-1-4939-2377-9 (  0) 0) |
| [9] |
Jelliffe-Pawlowski LL, Norton ME, Baer RJ, et al. Gestational dating by metabolic profle at birth:a California cohort study[J]. Am J Obstet Gynecol, 2016, 214(4): 511.e1-511.e13. DOI:10.1016/j.ajog.2015.11.029 (  0) 0) |
| [10] |
郝虎, 周伟, 李思涛, 等. 基于质谱技术的早产儿与足月儿尿代谢组学研究[J]. 中华实用儿科临床杂志, 2014, 29(8): 605-607. DOI:10.3760/cma.j.issn.2095-428X.2014.08.012 (  0) 0) |
| [11] |
Atzori L, Antonucci R, Barberini L, et al. Metabolomics:a new tool for the neonatologist[J]. J Matern Fetal Neonatal Med, 2009, 22(3): 50-53. (  0) 0) |
| [12] |
Han C, Lu Y, Wei Y, et al. D-ribosylation induces cognitive impairment through RAGE-dependent astrocytic inflammation[J]. Cell Death Dis, 2014, 5: e1117. (  0) 0) |
| [13] |
Su T, He R. D-ribose, an overlooked player in type 2 diabetes mellitus?[J]. Sci China Life Sci, 2014, 57(3): 361. DOI:10.1007/s11427-014-4614-5 (  0) 0) |
| [14] |
宋水山. 酰基高丝氨酸内酯-细菌与真核生物之间信息交流的介导分子[J]. 自然科学进展, 2006, 16(8): 933-939. DOI:10.3321/j.issn:1002-008X.2006.08.003 (  0) 0) |
| [15] |
蒋增良, 张辉, 杜鹃, 等. 月桂酸单甘油酯抑菌机理、影响因素及其复配体系的抑菌特性[J]. 中国食品学报, 2016, 16(3): 146-151. (  0) 0) |
| [16] |
陈小兰, 赖春华, 杨春晖, 等. 早产儿母乳喂养与新生儿坏死性小肠结肠炎的关系探讨[J]. 中国妇幼卫生杂志, 2016, 7(6): 42-44. (  0) 0) |
| [17] |
李春梅, 刘新光, 林小聪, 等. 七种黄酮类化合物对重组人蛋白激酶CK2全酶抑制作用的结构效应关系[J]. 中南大学学报(医学版), 2009, 34(1): 20-26. DOI:10.3321/j.issn:1672-7347.2009.01.004 (  0) 0) |
| [18] |
Jiang P, Trimigno A, Stanstrup J, et al. Antibiotic treatment preventing necrotising enterocolitis alters urinary and plasma metabolomes in preterm pigs[J]. J Proteome Res, 2017, 16(10): 3547-3557. DOI:10.1021/acs.jproteome.7b00263 (  0) 0) |
| [19] |
Stewart CJ, Nelson A, Treumann A, et al. Metabolomic and proteomic analysis of serum from preterm infants with necrotising entercolitis and late-onset sepsis[J]. Pediatr Res, 2016, 79(3): 425-431. DOI:10.1038/pr.2015.235 (  0) 0) |
| [20] |
Dessì A, Pintus R, Marras S, et al. Metabolomics in necrotizing enterocolitis:the state of the art[J]. Expert Rev Mol Diagn, 2016, 16(10): 1053-1058. DOI:10.1080/14737159.2016.1211933 (  0) 0) |
 2019, Vol. 21
2019, Vol. 21


