牛奶蛋白过敏(cow's milk protein allergy, CMPA)是由特异性免疫反应介导的食物不良反应,可分为IgE介导、非IgE介导和混合介导三型,可重复出现且损害机体健康,逐渐成为一个公认的全球健康问题,大大降低患儿及其家庭的日常生活质量[1-2]。
CMPA最常见于1岁以内的婴儿,临床表现复杂多样,主要涉及皮肤、消化道和呼吸系统,其中50%~60%患者有胃肠道症状[3]。以胃肠道症状为主要表现的CMPA临床表现缺乏特异性,易被误诊、误治[4],病程迁延,更容易引起重度过敏,严重影响婴幼儿身体健康和生长发育。患儿本身具有特应质或过敏性疾病家族史已被认为是CMPA的危险因素[5],其他因素,如喂养方式、胎龄、分娩类型、纯母乳喂养时间等与CMPA的关系尚缺乏统一结论。本研究对280例以胃肠道症状为主要表现的CMPA患儿的临床资料进行回顾性分析,以探讨以胃肠道症状为主要表现的CMPA的流行病学特点及临床特征,寻找与其发生相关的危险因素。
1 资料与方法 1.1 研究对象收集2013年10月至2017年1月在深圳市儿童医院消化内科临床诊断为CMPA的1月龄至1岁住院患儿的临床资料,纳入对象均为以胃肠道症状为主要表现的CMPA患儿。排除标准:排除先天性遗传代谢病、免疫缺陷病、严重的心肺肾脏疾病;对腹泻、便血的患儿排除血液系统疾病、严重感染、炎症性肠病、息肉、乳糖不耐受等;对反复反流、呕吐的患儿排除上消化道畸形、幽门肥厚、胃食管反流病、食管裂孔疝等;对便秘患儿排除肠梗阻、肛门狭窄等。
1.2 观察指标一般情况:月龄、体重、母妊娠期疾病史、出生情况、喂养方式、母乳喂养时间及一级亲属过敏性疾病史;临床表现:消化系统、呼吸系统、皮肤黏膜及全身性过敏症状。
1.3 诊断标准参照国内关于CMPA的最新循证建议[5],本研究纳入对象的诊断标准如下:(1)以胃肠道症状为主要表现,包括厌食/拒食、溢乳、喂养困难、生长缓慢、吞咽困难、反流/呕吐、腹痛、腹胀、腹泻、血便、便秘(伴或不伴肛周皮疹)等,伴或不伴皮肤、心血管及呼吸系统表现;(2)牛奶蛋白回避试验阳性;(3)开放性牛奶蛋白口服激发试验阳性。
患儿回避牛奶蛋白饮食2~4周后,若临床症状改善或消失,考虑患儿症状与CMPA有关,在家长同意下行开放性牛奶蛋白激发试验,具体过程如下:重度过敏者选择深度水解配方,轻中度过敏者选择去乳糖配方奶进行激发试验。婴儿最后一次进食后2 h开始,取1滴无乳糖婴儿配方奶滴于患儿的口唇,观察皮肤反应等。如在15 min后无任何反应,每20 min增加一次配方乳的喂养量,共喂养5次,第1次1 mL,其余4次分别为3 mL、10 mL、30 mL、100 mL(或一餐最大进食量)。观察生命体征、皮肤、呼吸、消化道反应等,给予最大剂量后继续观察2 h。试验中一旦出现相关临床症状,立即停止。若没有发生过敏反应,患儿可出院观察。随后2周每日至少进食试验配方奶250 mL,不添加其他新食物,家长记录饮食日记,如有任何迟发反应立即向医生汇报。
根据临床表现,将CMPA分为轻-中度和重度[5]。重度患儿包括急性过敏综合征、休克、重度渗出性/过敏性皮炎和由消化道症状引起的生长障碍、缺铁性贫血、严重肠病(蛋白丢失性肠病、嗜酸性粒细胞性疾病、食物蛋白诱导性小肠结肠炎综合征、食物蛋白诱导性结肠直肠炎);不符合上述条件的患儿归为轻-中度。纳入对象诊断流程图见图 1。
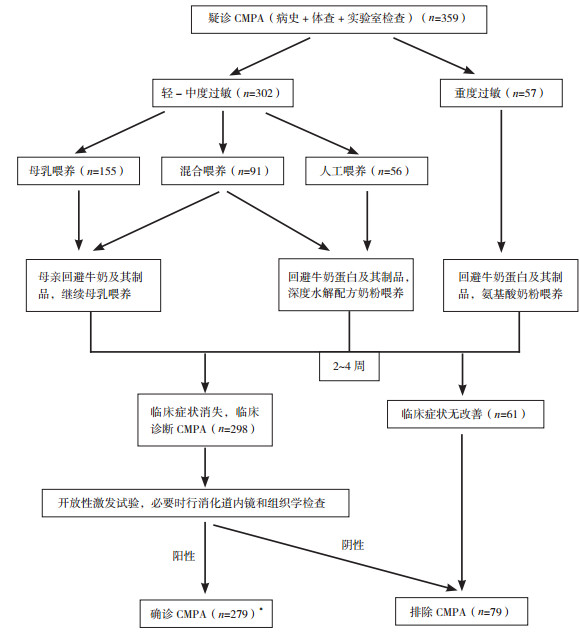
|
图 1 CMPA诊断流程 *1例患儿有严重速发过敏反应,检测血清牛奶特异性IgE阳性,直接确诊为CMPA。 |
采用SPSS 20.0统计软件进行统计学处理。符合正态分布的计量资料以均数±标准差(x±s)表示,不符合正态分布的计量资料以中位数(四分位数间距)[P50(P25,P75)]表示,两组间计量资料的比较采用成组t检验或非参数检验;多组间计量资料的比较采用单因素方差分析,组间两两比较采用SNK检验。计数资料以百分率(%)表示,组间比较采用卡方检验。P < 0.05为差异有统计学意义。计数资料组间两两比较采用Bonferroni法,调整检验水准为0.0167。
2 结果 2.1 一般资料符合纳入标准的患儿共280例,其中男164例,女116例;平均月龄为4.5±3.2个月,其中1个月~ 141例(50.4%),4个月~ 62例(22.1%),7个月~ 49例(17.5%),10~12个月28例(10.0%)。不同月龄段CMPA患儿的性别分布差异无统计学意义(χ2=2.808,P > 0.05)。
280例患儿中,母乳喂养136例(48.6%),人工喂养61例(21.8%),混合喂养83例(29.6%)。病情为轻-中度患儿258例(92.1%),重度为22例(7.9%)。
2.2 临床表现患儿症状包括腹泻、血便、呕吐、便秘、湿疹、营养不良,其中腹泻比例最高(61.1%,171例),其次是血便(53.2%,149例)、呕吐(25.4%,71例)、湿疹(20.4%,57例)、营养不良(15.0%,42例)、便秘(3.6%,10例)。重度CMPA患儿22例(7.9%),其中5例经肠镜黏膜活检证实为嗜酸性粒细胞性肠炎,9例为食物蛋白诱导性结肠直肠炎,1例有过敏性休克样表现。
不同喂养方式CMPA组患儿血便、营养不良发生率以及病情程度等方面的比较差异有统计学意义(P < 0.05)。两两比较发现,母乳喂养组营养不良发生率及重度CMPA患儿发生率均明显低于人工喂养组(Bonferroni校正,P < 0.0167),但人工喂养组的血便发生率显著低于母乳喂养组及混合喂养组(Bonferroni校正,P < 0.0167),见表 1。不同病情程度CMPA组间进行比较发现,重度CMPA患儿营养不良发生率明显高于轻-中度患儿,血便发生率及纯母乳喂养时间则低于轻-中度患儿,差异均有统计学意义(P < 0.05),见表 2。
| 表 1 不同喂养方式分组的CMPA患儿一般情况比较 |
|
|
| 表 2 不同病情程度患儿的一般情况比较 |
|
|
有证据表明,在儿童和青少年中,因过敏而住院的人数不断增加,其中最常见的原因是食物引起的过敏反应[6-7]。在婴幼儿期,奶制品在个人膳食计划中所占的比例最大,CMPA是最常见的食物过敏。在世界范围内,CMPA流行率约为2%~5%[8-10],而我国缺乏相关大规模、高质量的流行病学调查资料。
CMPA可累及皮肤、消化道、呼吸及心血管等系统,症状与累及部位相关。有学者统计,除外皮肤症状,胃肠道相关症状所占比例最高[11-12]。本研究选取了以胃肠道症状为主要表现的CMPA婴儿作为观察对象,发现不同症状的发生率由高到低依次为腹泻、血便、呕吐、湿疹、营养不良、便秘。按病情分组比较发现,重度过敏组血便发生率显著低于轻-中度CMPA组,而营养不良发生率则明显升高,提示重度CMPA导致的结果可能更多表现为营养不良,而血便并不只是重度CMPA的临床特征,大多数轻-中度CMPA患儿也常引起血便。Morita等[13]对食物诱导性小肠结肠炎综合征的研究发现,血便患儿的预后可能比无血便患儿更好,血便组患儿出现Th2偏倚免疫应答,比无血便组患儿更容易发生免疫耐受,这可能与其更高的IL-10浓度有关。
本研究发现,以胃肠道症状为主要表现的CMPA多发于6月龄以内婴儿,与Martorell等[11]报道一致。大部分CMPA患儿都可以在5岁以内发生免疫耐受,其发病率可随年龄的增加而减少[14]。
本组病例中,重度CMPA婴儿占7.9%,与Fleischer等[15]报道结果相近(11.4%)。既往研究指出,严重食物过敏的几率随着年龄的增长而逐渐增加[16-17],但本研究发现不同年龄组病情程度的比较差异无统计学意义,这可能与判定标准及研究人群的年龄组选择不同有关。美国的一项横断面研究表明,14~17岁的儿童出现严重食物过敏的几率比0~2岁的儿童高出1倍以上[17]。相比婴幼儿,青少年或年轻成年人的CMPA常常为更严重的类型[18],高达25%的人群曾表现出以喘息、气促、呼吸困难、发绀、心率加快等呼吸系统及心血管系统症状为主要临床特征的速发型反应[19]。
目前医学界对于不同喂养方式与CMPA的关系仍有很大争议。针对喂养方式进行随机对照试验是不符合伦理要求的,因此当前证据仍然局限于观察性研究。在这些研究中,患儿父母和回忆偏差会严重影响所收集数据的客观性[20]。在本研究所纳入的研究对象中,母乳喂养组的人数高于其他两组,统计结果可能受样本统计量和混杂因素(社会经济地位、母乳成分变化等)的影响。当前关于母乳喂养在过敏性疾病发展中的保护作用,学界存在许多相互矛盾的研究结果。由于母乳成分存在复杂性和多变性,不同的个体、环境暴露、饮食暴露均会影响其构成组分,从而影响婴儿的免疫应答[21]。母乳中含有许多免疫因子,可以增强新生婴儿肠道的防御机制,但母亲所摄入的鸡蛋、牛奶、海鲜等外源性过敏原可在母乳少量出现,而这种低剂量表达的过敏原可在纯母乳喂养儿中诱导IgE免疫应答的发生[22]。虽然很多临床研究指出早期和持续的低剂量食物抗原喂养可降低机体对该抗原发生食物过敏的风险,诱导口服免疫耐受,但这种现象在儿童中被一致认可的食物是鸡蛋和花生[23-24],尚无充足证据证实牛奶的早期口服免疫耐受。
本研究显示,人工喂养组营养不良发生率和重度CMPA发生率显著高于母乳喂养组,重度CMPA婴儿纯母乳喂养时间明显少于轻-中度婴儿。新生儿发育不成熟的肠道对大分子物质渗透性更高,早期接触牛奶蛋白可以增加变应原的吸收率,促进过敏性疾病的发生。Saarinen等[25]的研究发现,早期配方奶喂养增加了CMPA的发病,而纯母乳喂养并不能降低风险。因此,外源性牛奶蛋白及引入时间对CMPA的发生有重要影响,并可能进一步促进病情发展,而母乳喂养与CMPA的关系有待进一步研究。
另一方面,目前医学界认为过敏体质(具有已确诊的变应性鼻炎、哮喘、特应性皮炎、荨麻疹、已确认的食物过敏等过敏性疾病患者视为特应性个体[26])、家族过敏性疾病史(如哮喘、湿疹、鼻炎、其他食物过敏史等)是婴幼儿发生CMPA的危险因素,且遗传易感性、多重食物过敏在迟发型CMPA患儿免疫耐受中具有重要作用[9, 27]。对于剖宫产出生、早产、母乳喂养时间等因素与CMPA发病关系的研究也逐渐增多,但报道不一,目前仍缺乏统一的结论。不同的出生方式及生后喂养方法均可引起不同的肠道菌群变化[28],这可能会改变免疫反应,降低促进肠道耐受性的细胞因子的表达水平[29]。早产儿肠道黏膜屏障不成熟,在伴有缺血缺氧情况下,更有利于高分子质量抗原吸收。然而,上述因素与CMPA病情程度的研究较少,本研究发现,CMPA病情程度与患儿出生方式、早产、过敏体质及阳性家族过敏史无明显关系,但与纯母乳喂养时间有关。
综上所述,本研究显示,以胃肠道症状为主要表现的CMPA好发于6个月以内婴儿,以腹泻、血便为主要表现,病情大多为轻-中度。评估严重反应风险对于管理食物过敏的病人具有至关重要的作用,本研究发现喂养方式与CMPA病情有关,人工喂养的婴儿更容易导致重度CMPA,引起营养不良,而早产、剖宫产及过敏性疾病家族史与CMPA程度无关。母乳喂养在过敏性疾病发展中的作用有待进一步研究,充分了解不同的环境暴露下,与婴儿明确的临床和免疫结果有关的母乳成分的变化,有助于建立一种新的预防模式,以促进婴儿的健康发育。
| [1] |
Lieberman JA, Sicherer SH. Quality of life in food allergy[J]. Curr Opin Allergy Clin Immunol, 2011, 11(3): 236-242. DOI:10.1097/ACI.0b013e3283464cf0 (  0) 0) |
| [2] |
Walkner M, Warren C, Gupta RS. Quality of life in food allergy patients and their families[J]. Pediatr Clin North Am, 2015, 62(6): 1453-1461. DOI:10.1016/j.pcl.2015.07.003 (  0) 0) |
| [3] |
Host A, Halken S. Cow's milk allergy:where have we come from and where are we going?[J]. Endocr Metab Immune Disord Drug Targets, 2014, 14(1): 2-8. DOI:10.2174/1871530314666140121142900 (  0) 0) |
| [4] |
Vandenplas Y. Algorithms for common gastrointestinal disorders[J]. J Pediatr Gastroenterol Nutr, 2016, 63: S38-S40. (  0) 0) |
| [5] |
中华医学会儿科学分会免疫学组, 中华医学会儿科学分会儿童保健学组, 中华医学会儿科学分会消化学组, 等. 中国婴幼儿牛奶蛋白过敏诊治循证建议[J]. 中华儿科杂志, 2013, 51(3): 183-186. DOI:10.3760/cma.j.issn.0578-1310.2013.03.006 (  0) 0) |
| [6] |
Lin RY, Anderson AS, Shah SN, et al. Increasing anaphylaxis hospitalizations in the frst 2 decades of life:New York State, 1990-2006[J]. Ann Allergy Asthma Immunol, 2008, 101(4): 387-393. DOI:10.1016/S1081-1206(10)60315-8 (  0) 0) |
| [7] |
Tejedor-Alonso MA, Moro-Moro M, Mosquera Gonzalez M, et al. Increased incidence of admissions for anaphylaxis in Spain 1998-2011[J]. Allergy, 2015, 70(7): 880-883. DOI:10.1111/all.12613 (  0) 0) |
| [8] |
Nwaru BI, Hickstein L, Panesar SS, et al. Prevalence of common food allergies in Europe:a systematic review and meta-analysis[J]. Allergy, 2014, 69(8): 992-1007. DOI:10.1111/all.12423 (  0) 0) |
| [9] |
Fiocchi A, Brozek J, Schünemann H, et al. World Allergy Organization (WAO) Diagnosis and Rationale for Action against Cow's Milk Allergy (DRACMA) Guidelines[J]. Pediatr Allergy Immunol, 2010, 21(Suppl 21): 1-125. (  0) 0) |
| [10] |
Rona RJ, Keil T, Summers C, et al. The prevalence of food allergy:a meta-analysis[J]. J Allergy Clin Immunol, 2007, 120(3): 638-646. DOI:10.1016/j.jaci.2007.05.026 (  0) 0) |
| [11] |
Martorell A, Plaza AM, Boné J, et al. Cow's milk protein allergy. A multi-centre study:clinical and epidemiological aspects[J]. Allergol Immunopathol (Madr), 2006, 34(2): 46-53. DOI:10.1157/13086746 (  0) 0) |
| [12] |
Høst A, Halken S. A prospective study of cow milk allergy in Danish infants during the frst 3 years of life. Clinical course in relation to clinical and immunological type of hypersensitivity reaction[J]. Allergy, 1990, 45(8): 587-596. DOI:10.1111/all.1990.45.issue-8 (  0) 0) |
| [13] |
Morita H, Suzuki H, Orihara K, et al. Food protein-induced enterocolitis syndromes with and without bloody stool have distinct clinicopathologic features[J]. J Allergy Clin Immunol, 2017, 140(6): 1718-1721. DOI:10.1016/j.jaci.2017.06.002 (  0) 0) |
| [14] |
Koletzko S, Niggemann B, Arato A, et al. Diagnostic approach and management of cow's-milk protein allergy in infants and children:ESPGHAN GI Committee practical guidelines[J]. J Pediatr Gastroenterol Nutr, 2012, 55(2): 221-229. (  0) 0) |
| [15] |
Fleischer DM, Perry TT, Atkins D, et al. Allergic reactions to foods in preschool-aged children in a prospective observational food allergy study[J]. Pediatrics, 2012, 130(1): e25-e32. DOI:10.1542/peds.2011-1762 (  0) 0) |
| [16] |
Shah E, Pongracic J. Food-induced anaphylaxis:who, what, why, and where?[J]. Pediatr Ann, 2008, 37(8): 536-541. (  0) 0) |
| [17] |
Gupta RS, Springston EE, Warrier MR, et al. The prevalence, severity, and distribution of childhood food allergy in the United States[J]. Pediatrics, 2011, 128(1): e9-e17. DOI:10.1542/peds.2011-0204 (  0) 0) |
| [18] |
Luyt D, Ball H, Makwana N, et al. BSACI guideline for the diagnosis and management of cow's milk allergy[J]. Clin Exp Allergy, 2014, 44(5): 642-672. DOI:10.1111/cea.2014.44.issue-5 (  0) 0) |
| [19] |
Lam HY, van Hoffen E, Michelsen A, et al. Cow's milk allergy in adults is rare but severe:both casein and whey proteins are involved[J]. Clin Exp Allergy, 2008, 38(6): 995-1002. DOI:10.1111/j.1365-2222.2008.02968.x (  0) 0) |
| [20] |
Matheson MC, Allen KJ, Tang ML. Understanding the evidence for and against the role of breastfeeding in allergy prevention[J]. Clin Exp Allergy, 2012, 42(6): 827-851. DOI:10.1111/j.1365-2222.2011.03925.x (  0) 0) |
| [21] |
Munblit D, Peroni DG, Boix-Amorós A, et al. Human milk and allergic diseases:an unsolved puzzle[J]. Nutrients, 2017, 9(8): pii:E894. DOI:10.3390/nu9080894 (  0) 0) |
| [22] |
Jarrett EE. Perinatal influences on IgE responses[J]. Lancet, 1984, 2(8406): 797-799. (  0) 0) |
| [23] |
Ierodiakonou D, Garcia-Larsen V, Logan A, et al. Timing of allergenic food introduction to the infant diet and risk of allergic or autoimmune disease:a systematic review and metaanalysis[J]. JAMA, 2016, 316(11): 1181-1192. DOI:10.1001/jama.2016.12623 (  0) 0) |
| [24] |
Du Toit G, Roberts G, Sayre PH, et al. Randomized trial of peanut consumption in infants at risk for peanut allergy[J]. N Engl J Med, 2015, 372(9): 803-813. DOI:10.1056/NEJMoa1414850 (  0) 0) |
| [25] |
Saarinen KM, Juntunen-Backman K, Järvenpää AL, et al. Breast-feeding and the development of cows' milk protein allergy[J]. Adv Exp Med Biol, 2000, 478: 121-130. (  0) 0) |
| [26] |
中华医学会儿科学分会免疫学组, 《中华儿科杂志》编辑委员会. 婴儿过敏性疾病预防、诊断和治疗专家共识[J]. 中华儿科杂志, 2009, 47(11): 835-838. DOI:10.3760/cma.j.issn.0578-1310.2009.11.009 (  0) 0) |
| [27] |
Iacono G, Cavataio F, Montalto G, et al. Persistent cow's milk protein intolerance in infants:the changing faces of the same disease[J]. Clin Exp Allergy, 1998, 28(7): 817-823. DOI:10.1046/j.1365-2222.1998.00334.x (  0) 0) |
| [28] |
Salminen S, Gibson GR, McCartney AL, et al. Influence of mode of delivery on gut microbiota composition in seven year old children[J]. Gut, 2004, 53(9): 1388-1389. (  0) 0) |
| [29] |
Tsabouri S, Priftis KN, Chaliasos N, et al. Modulation of gut microbiota downregulates the development of food allergy in infancy[J]. Allergol Immunopathol (Madr), 2014, 42(1): 69-77. DOI:10.1016/j.aller.2013.03.010 (  0) 0) |
 2019, Vol. 21
2019, Vol. 21


