(1)病史:患儿女,8岁,因发现肝功能异常8年伴血压高1周入院。患儿生后第5天因颜面部黄染就诊,查肝功能异常(未见详细资料),肾功能、电解质、C-反应蛋白(CRP)、巨细胞病毒(cytomegalovirus, CMV)检测未见异常,予以对症治疗,2个月后复查肝功能仍异常:丙氨酸氨基转移酶(ALT)206.4 U/L,门冬氨酸氨基转移酶(AST)362.4 U/L,总胆红素(TBIL)140.9 μmol/L,直接胆红素(DBIL)92.23 μmol/L;腹部彩超示肝实质回声强、光点粗。出院后皮肤黄染逐渐消退,未予复诊。1月余前查肝功能示ALT、AST及总胆汁酸(TBA)均升高。1周前发现血压明显升高,予3种以上降压药联合治疗血压仍控制不佳。
(2)既往史、出生史及家族史:患儿生后第5天发现“先天性青光眼”,1个月前行“双眼复合式小梁切除术+外路小梁切开术”治疗。患儿系第1胎第1产,足月顺产,出生时无窒息史,出生体重2.7 kg。母孕期无特殊病史。家族中无类似病史。
(3)入院体查:血压160/102 mm Hg,身高120 cm(-1 SD~-2 SD),体重20 kg(-1 SD~-2 SD),神志清楚,体格发育落后,消瘦,皮下脂肪0.2 cm,前额宽阔、眼距宽,眼窝深陷(图 1);皮肤、巩膜无黄染,浅表淋巴结未触及。双眼结膜无充血,角膜透明,右眼瞳孔椭圆形直径约6 mm、左眼瞳孔椭圆形直径约4 mm,对光反射灵敏。口唇无发绀,扁桃体不大。伸舌居中,颈软。双肺听诊无异常;心率120次/min,心界无扩大,主动脉瓣区及主动脉第2听诊区可闻及2级喷射性杂音;腹软,肝脾肋下未触及。脊柱四肢、肛门外生殖器未见异常。
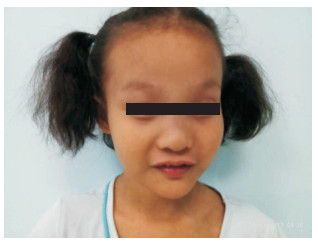
|
图 1 患儿特殊面容 前额宽阔、眼距宽,眼窝深陷。 |
(4)实验室检查:肝功能:TBIL 19.4~ 46.8 μmol/L(参考值:1.7~17.1 μmol/L),DBIL 8.4~17.4 μmol/L(参考值:0.0~6.8 μmol/L),TBA 42.1~253.5 μmol/L(参考值:0~12 μmol/L),ALT 49.2~109.4 U/L(参考值:7~40 U/L),AST 60.7~157.7 U/L(参考值:13~35 U/L);肝病酶学:碱性磷酸酶628.8 U/L(参考值:45.0~125.0 U/L),谷氨酰转肽酶420.7 U/L(参考值:7.0~45.0 U/L),5核苷酸酶46.7 U/L(参考值:< 10.0 U/L),岩藻糖苷酶75.4 IU/L(5.0~40.0 IU/L),线粒体谷草转氨酶46.8 U/L(参考值:0~18.0 U/L);血脂:甘油三脂(TG)1.74 mmol/L(参考值:< 1.7 mmol/L),胆固醇(TC)11.41 mmol/L(参考值:< 5.18 mmol/L),高密度脂蛋白2.89 mmol/L(参考值:1.04~ 1.55 mmol/L),低密度脂蛋白7.12 mmol/L(参考值:1.55~3.19 mmol/L);免疫全套:补体C3 1 670 mg/L(参考值:790~1 520 mg/L),IgG 6.0 g/L(参考值:7.2~16.8 g/L),余项正常。卧位肾素+醛固酮(发光法):醛固酮386.0 pg/mL(参考值:30~ 236 pg/mL),醛固酮/肾素比值正常,肾素346.6 μIU/mL(参考值:2.8~39.9 μIU/mL)。三大常规、肾功能、心肌酶、电解质、血糖、凝血功能、肝炎全套、甲胎蛋白、自免肝全套、乳酸、血氨、铜蓝蛋白、输血前检查、血气分析均未见异常。
心电图示窦性心律不齐。腹部彩超示脾大。心脏彩超示三尖瓣及肺动脉瓣轻度返流。心脏大血管CTA示腹主动脉、双肾动脉起始部狭窄(图 2)。
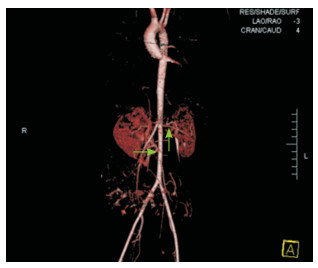
|
图 2 患儿心脏大血管CTA 腹主动脉、双肾动脉起始部狭窄。 |
血遗传代谢病氨基酸和酰基肉碱谱分析及尿有机酸分析未见明显异常。外周血染色体核型分析:46,XX,为正常女性核型。
2 诊断思维8岁女性,新生儿期即出现黄疸:DBIL > 17.1 μmol/L,DBIL/TBIL比值> 20%,伴ALT、AST及肝病酶学增高(碱性磷酸酶高于正常上限1.5倍、谷氨酰转氨酶高于正常上限3倍)和TBA持续增高。根据2015年胆汁淤积性肝病诊断及治疗共识[1],可诊断为胆汁淤积性肝病,病因与胆道结构异常、感染、遗传/代谢紊乱等相关疾病有关。本例患儿大便颜色正常,黄疸无进行性加深,腹部B超未提示胆道闭锁,无胆道结构异常依据,应考虑非梗阻性胆汁淤积性肝病。患儿生后第5天即发现黄疸,需注意宫内感染,如先天性CMV感染,但CMV感染在儿童期往往遗留听力及神经系统损害,该患儿巨细胞病毒检测阴性,也没有先天性CMV感染后遗症表现,母孕期无感染病史,可排除此病;患儿肝炎病毒检测、HIV检测均阴性,也不支持其他病毒感染性肝炎。对于新生儿期起病的长程胆汁淤积性肝病,应注意遗传代谢性疾病:如进行性家族性肝内胆汁淤积症3型(progressive familial intrahepatic cholestasis type 3, PFIC3),此病可新生儿期起病,表现为黄疸、瘙痒、生长发育迟缓,肝功能表现为DBIL、ALT、AST、TBA升高,典型的临床特点是儿童阶段出现非常严重的皮肤瘙痒。本例患儿并无全身皮肤瘙痒,也无家族史,不支持该病,可行基因检查以明确。Citrin蛋白缺乏症是位于线粒体内膜的载体蛋白Citrin异常所引起的先天性代谢性疾病,可于新生儿期出现黄疸、肝功能异常、瓜氨酸血症,以及半乳糖血症、低蛋白血症、出血倾向、低血糖等,但该患儿无低蛋白血症,凝血功能正常,血遗传代谢病氨基酸和酰基肉碱谱分析及尿有机酸分析未见明显异常,不支持此病。α1-抗胰蛋白酶缺乏症患儿可在出生后1周出现胆汁淤积性黄疸,黄疸持续2~4个月后可逐渐消退,少数可持续进展于2岁后出现肝硬化。但本研究患儿病程长达8年仍无肝硬化表现,不支持。Alagille综合征(Alagille syndrome, ALGS)具有几个重要的临床特征:胆汁淤积、心脏缺陷、脊柱畸形(蝴蝶椎)、眼部异常(角膜后胚胎环)、血管异常和突出的面部特征。本研究患儿有长程的无症状胆汁淤积性肝病、先天性青光眼及特殊面容,伴新近发现的高血压、血管畸形,故该患儿应高度考虑ALGS,进一步行基因检测有助于诊断此病。
3 进一步检查征得患儿父母知情同意,采集患儿及父母外周血进行全外显子组基因测序(北京迈基诺医学研究所),发现患儿JAG1基因外显子12区域存在c.1485delC(缺失胞嘧啶)杂合突变,导致氨基酸改变p.C496Vfs*2(移码突变),其父母的JAG1基因在该位点无异常,见图 3。根据美国医学遗传学与基因组学学会(ACMG)遗传变异分类标准与指南[2]对该变异进行致病性分析:该变异为新发的移码变异,移码突变属于功能缺失变异(PVSl),该变异在ESP、外显子组整合(Exome Aggregation Consortium, ExAC)数据库及千人数据库中的等位基因频率为0(PM2);因此判定JAG1基因c.1485delC变异为致病性变异。
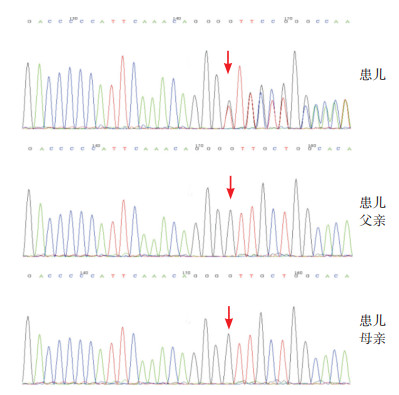
|
图 3 患儿及其父母JAG1基因突变的检出情况 患儿JAG1基因于外显子12区域存在c.1485delC杂合突变,患儿父母该位点无异常。突变位点如箭头所示。 |
根据Kamath[3]和Guru Murthy等[4]提出的最新标准可诊断为ALGS。依据:(1)胆汁淤积性肝病;(2)先天性青光眼;(3)面部畸形:前额宽阔、眼距宽,眼窝深陷;(4)血管畸形:腹主动脉、双肾动脉起始部狭窄;(5)JAG1基因存在杂合突变。
5 临床经过给予谷胱甘肽、复方甘草酸苷、熊去氧胆酸降酶利胆,硝普钠持续泵入以及普萘洛尔、依那普利、硝苯地平联合降压等对症治疗,半个月后ALT、AST及TBA明显下降,但血压波动在102~140/53~89 mm Hg;全麻下行肾动脉造影+肾动脉球囊扩张成形术,术后患儿继续予以普萘洛尔片(30 mg/d)、依那普利片(5 mg/d)、硝苯地平控释片(30 mg/d)联合降压,血压波动在110~120/60~80 mm Hg。术后随访9个月病情稳定,其远期预后有待长期随访观察。
6 讨论ALGS是于1975年由Alagille等[5]首次报道的一种累及多脏器的罕见常染色体显性遗传病,发病率为1 : 30 000。其典型临床特征包括胆汁淤积、小叶间胆管减少或缺如(肝活检病理证实)、先天性心脏病、角膜后胚胎环形成、特殊面容以及骨骼畸形(蝴蝶椎)[5-7]。ALGS的主要致病原因是Notch信号通路的JAG1和NOTCH2基因突变或缺失,94%的病例由JAG1基因突变引起,1%~2%由NOTCH2基因变异所致[7]。到2014年止,已有超过440多种JAG1基因突变以及10余种NOTCH2基因突变被报道,突变方式多样,具有明显异质性,如错义突变、无义突变、缺失、插入、剪接突变、移码突变等,但目前尚不能证明基因型-表型之间的关联[8-9]。本例患儿JAG1基因发现1个杂合突变:c.1485delC(缺失胞嘧啶),导致氨基酸改变p.C496Vfs*2。
ALGS器官受累分布情况如下:(1)肝脏:95%患者出现胆汁淤积,表现为黄疸、皮肤瘙痒、白陶土样大便及高脂血症,其中约33%的患儿出现皮肤瘙痒。病程 > 6个月的患者肝活检往往提示肝内胆管缺乏。最后发展为肝硬化终末期肝病的比例高达15%[7, 10-12];(2)心脏:超过90%患者有心脏畸形,以肺动脉狭窄(67%)、法洛四联症(16%)较常见,还包括室间隔缺损、房间隔缺损、主动脉狭窄、主动脉缩窄等[11-12];(3)肾脏:Kamath等[13]在一项关于ALGS患者肾脏受累的大型回顾性研究中,对466名JAG1基因突变阳性个体进行了评估,发现大约39%患者存在肾脏受累,其中肾发育不良(58.9%)、肾小管酸中毒(9.5%)、膀胱输尿管返流(8.2%)、尿路梗阻(8.2%),还包括蛋白尿及高血压(伴中主动脉综合征或肾动脉狭窄)[13-14];(4)骨骼畸形:以蝴蝶椎最多见,占80%,还可表现为半椎体、颅缝早闭、远端指骨缩短(梭状)[7];(5)眼:有角膜后胚胎环(90%)和阿克森费尔德异常(13%,表现为双眼发育异常及青光眼)[12];(6)特殊面容:前额宽阔、眼窝深陷、耳廓突出、眼距增宽、鼻梁直、鼻尖呈球状、尖下巴(呈倒三角形)[7, 11-12, 15];(7)血管异常:ALGS的血管异常可见于肺、主动脉、肾脏、颅内、腹腔和肠系膜等部位[10],目前报道的有动脉瘤、烟雾综合征、脑动脉异常、肾血管异常和中段主动脉综合征等[7, 11]。
本例新生儿期即出现黄疸和肝功能异常,而且ALT、AST和TBA持续增高,伴有先天性青光眼(生后第5天确诊)、血压高和特殊面容(前额宽阔、眼距宽、眼窝深陷)以及血管畸形(腹主动脉、双肾动脉起始部狭窄),临床特点与ALGS器官受累的特点一致。ALGS患者的高血压可能与中主动脉、肾血管或肾实质受累有关[14]。Bérard等[16]强调对ALGS患者进行血压监测,对于血压增高的ALGS患者应该注意是否有肾血管或者中主动脉异常。Salem等[17]报道5例有高血压的ALGS病例,均有中主动脉综合征和腹主动脉狭窄,并伴有肾动脉闭塞或狭窄、动脉瘤。Kamath等[18]对268例ALGS病例进行回顾性分析,9%患者有血管异常。本研究患儿尿常规、肾功能、肾脏超声均无异常,CTA发现腹主动脉、双肾动脉起始部狭窄,高血压原因与血管受累有关。
Notch信号通路缺陷也是导致ALGS的主要原因,Notch信号在血管形成过程中起着至关重要的作用[19]。血管内皮细胞通过与血管内皮生长因子(vascular endothelial growth factor, VEGF)受体2结合成为顶端细胞或柄细胞,顶端细胞和柄细胞在VEGF和Notch信号通路的调控下形成新血管的主干,而Notch信号可通过抑制血管内皮细胞增殖来维持血管的稳态[19-20]。因此,Notch信号通路的JAG1和NOTCH2基因突变或缺失可引起一系列血管异常。本研究患儿的JAG1基因存在1个杂合移码突变,其高血压、血管异常可能与此有关。
ALGS目前无特效治疗,主要为对症支持治疗和监测可能受累的器官功能。其预后主要取决于肝脏和心脏累及的严重程度[11]。Hirai等[21]认为经皮血管腔内血管成形术及支架植入术是治疗ALGS肾动脉狭窄的有效方法之一。本例患儿肾动脉球囊扩张成形术后,配合降压药物治疗可控制血压在正常范围、肾功能基本正常。
7 结语儿童早期起病的长程的胆汁淤积性肝病,如伴高血压、特殊面容等多系统受累应注意鉴别ALGS,警惕其高血压是否由于血管异常所致,积极寻找遗传学病因,以及时诊治。
| [1] |
中华医学会肝病学分会. 胆汁淤积性肝病诊断和治疗共识(2015)[J]. 中华消化杂志, 2015, 35(12): 39-51. (  0) 0) |
| [2] |
Richards S, Aziz N, Bale S, et al. Standards and guidelines for the interpretation of sequence variants:a joint consensus recommendation of the American College of Medical Genetics and Genomics and the Association for Molecular Pathology[J]. Genet Med, 2015, 17(5): 405-424. DOI:10.1038/gim.2015.30 (  0) 0) |
| [3] |
Kamath BM. Alagille syndrome[M]//Suchy FJ, Sokal RJ, Balistreri WF, et al. Liver disease in children. 3rd ed. New York: Cambridge University Press, 2007: 326-345.
(  0) 0) |
| [4] |
Guru Murthy GS, Rana BS, Das A, et al. Alagille syndrome:a rare disease in an adolescent[J]. Dig Dis Sci, 2012, 57(11): 3035-3037. DOI:10.1007/s10620-012-2226-0 (  0) 0) |
| [5] |
Alagille D, Odièvre M, Gautier M, et al. Hepatic ductular hypoplasia associated with characteristic facies, vertebral malformations, retarded physical, mental, and sexual development, and cardiac murmur[J]. J Pediatr, 1975, 86(1): 63-71. DOI:10.1016/S0022-3476(75)80706-2 (  0) 0) |
| [6] |
Kamath BM, Yin W, Miller H, et al. Outcomes of liver transplantation for patients with Alagille syndrome:the studies of pediatric liver transplantation experience[J]. Liver Transpl, 2012, 18(8): 940-948. DOI:10.1002/lt.v18.8 (  0) 0) |
| [7] |
Turnpenny PD, Ellard S. Alagille syndrome:pathogenesis, diagnosis and management[J]. Eur J Hum Genet, 2012, 20(3): 251-257. DOI:10.1038/ejhg.2011.181 (  0) 0) |
| [8] |
Jurkiewicz D, Gliwicz D, Ciara E, et al. Spectrum of JAG1 gene mutations in Polish patients with Alagille syndrome[J]. J Appl Genet, 2014, 55(3): 329-336. DOI:10.1007/s13353-014-0212-2 (  0) 0) |
| [9] |
高美玲, 钟雪梅, 马昕, 等. 目标基因捕获结合第二代测序技术诊断Alagille综合征患儿四例[J]. 中华儿科杂志, 2016, 54(6): 441-445. DOI:10.3760/cma.j.issn.0578-1310.2016.06.011 (  0) 0) |
| [10] |
高美玲. Alagille综合征各系统损害的研究进展[J]. 国际儿科学杂志, 2016, 43(5): 360-364. DOI:10.3760/cma.j.issn.1673-4408.2016.05.004 (  0) 0) |
| [11] |
Diaz-Frias J, Kondamudi NP. Alagille syndrome[M/OL]. (2018-12-21). https://www.ncbi.nlm.nih.gov/books/NBK507827/.
(  0) 0) |
| [12] |
马艳立, 宋元宗. Alagille综合征诊断治疗进展[J]. 中国当代儿科杂志, 2014, 16(11): 1188-1192. DOI:10.7499/j.issn.1008-8830.2014.11.025 (  0) 0) |
| [13] |
Kamath BM, Podkameni G, Hutchinson AL, et al. Renal anomalies in Alagille syndrome:A disease-defning feature[J]. Am J Med Genet A, 2012, 158A(1): 85-89. DOI:10.1002/ajmg.a.34369 (  0) 0) |
| [14] |
Kamath BM, Spinner NB, Rosenblum ND. Renal involvement and the role of Notch signalling in Alagille syndrome[J]. Nat Rev Nephrol, 2013, 9(7): 409-418. DOI:10.1038/nrneph.2013.102 (  0) 0) |
| [15] |
Shrivastava R, Williams A, Mikhail A, et al. An unusual cause of hypertension and renal failure:a case series of a family with Alagille syndrome[J]. Nephrol Dial Transplant, 2010, 25(5): 1501-1506. DOI:10.1093/ndt/gfp692 (  0) 0) |
| [16] |
Bérard E, Sarles J, Triolo V, et al. Renovascular hypertension and vascular anomalies in Alagille syndrome[J]. Pediatr Nephrol, 1998, 12(2): 121-124. DOI:10.1007/s004670050418 (  0) 0) |
| [17] |
Salem JE, Bruguiere E, Iserin L, et al. Hypertension and aortorenal disease in Alagille syndrome[J]. J Hypertens, 2012, 30(7): 1300-1306. DOI:10.1097/HJH.0b013e3283531e1f (  0) 0) |
| [18] |
Kamath BM, Spinner NB, Emerick KM, et al. Vascular anomalies in Alagille syndrome:a signifcant cause of morbidity and mortality[J]. Circulation, 2004, 109(11): 1354-1358. DOI:10.1161/01.CIR.0000121361.01862.A4 (  0) 0) |
| [19] |
Zhang P, Yan XC, Chen Y, et al. Notch signaling in blood vessels:from morphogenesis to homeostasis[J]. Sci China Life Sci, 2014, 57(8): 774-780. DOI:10.1007/s11427-014-4716-0 (  0) 0) |
| [20] |
洪日, 戚基萍, 吴鹤. Notch信号通路在血管生成方面的作用[J]. 医学综述, 2017, 23(21): 4189-4193. DOI:10.3969/j.issn.1006-2084.2017.21.006 (  0) 0) |
| [21] |
Hirai H, Santo Y, Kogaki S, et al. Successful stenting for renal artery stenosis in a patient with Alagille syndrome[J]. Pediatr Nephrol, 2005, 20(6): 831-833. DOI:10.1007/s00467-004-1774-8 (  0) 0) |
 2019, Vol. 21
2019, Vol. 21


