2. 江苏省妇幼保健院新生儿科, 江苏 南京 210036
近年来,随着围产医学及新生儿危重症救治水平的提高,极早产儿存活率也不断攀升。然而,其后期生存质量却备受关注。早产儿肺发育常不成熟,易患支气管肺发育不良(bronchopulmonary dysplasia, BPD)、呼吸窘迫综合征(respiratory distress syndrome, RDS)等肺发育相关性疾病,严重影响患儿预后。相关研究表明肺发育相关性疾病可影响患儿认知功能[1]、肺功能[2-3],致睡眠呼吸障碍[4]等疾患的发病率升高。因此,肺发育的相关机制越发引起临床工作者的重视。
自进入后基因时代,microRNA在细胞发育时序、细胞增殖、信号转导、干细胞分化和肿瘤发生发展等生物过程中有显著调控作用。目前已发现100余条特异miRNAs维持肺正常发育的动态平衡,如miRNA-127调控气管分支[5],miRNA-17-92 cluster调控肺上皮祖细胞的增殖分化[6]。miR-431是本课题组前期研究中利用芯片技术筛选出的在大鼠胎肺发育过程中连续低表达[7],并在RDS患儿血清中高表达[8]的microRNA。本研究通过对大鼠肺发育的连续形态学观察,并选取关键时间点进行miR-431的原位杂交及实时荧光定量PCR(RT-qPCR)检测,探讨miR-431在大鼠肺发育形态学中的表达差异,为后期进一步研究miR-431调控肺发育机制奠定基础。
1 材料与方法 1.1 实验动物健康成年Sprague-Dawley大鼠48只,由南京医科大学实验动物供应中心提供,其中雌雄鼠各24只,饲养于SPF级环境中。将无交配史,体重约为250~350 g的雌鼠,在发情期与雄鼠按照1 : 1比例进行单独合笼交配,次日晨检查托盘,以见白色阴栓日记为雌鼠妊娠第1天。将24只孕鼠随机分为8组,每组3只,分别为孕16 d(E16)、孕19 d(E19)、孕21 d(E21)、生后1 d(P1)、生后3 d(P3)、生后7 d(P7)、生后14 d(P14)及生后10周(P10周)组。
1.2 取材E16、E19、E21组孕鼠在妊娠16 d、19 d、21 d时用2%水合氯醛麻醉后采用颈椎脱臼法处死(0.2 mL/10 g),快速解剖所有胎鼠取肺组织。P1、P3、P7、P14及P10周组在新生大鼠生后1 d、3 d、7 d、14 d及10周时用同法处死后取肺组织。每组保留3份肺组织用于形态学观察,分别用4%多聚甲醛及电镜固定液进行固定;剩余肺组织在PBS溶液中进行洗涤后放入EP管中,储存在-80℃冰箱中。
1.3 苏木精-伊红染色每组保留的3份左侧肺组织于4%多聚甲醛中固定24 h。石蜡包埋制作成石蜡标本,切片厚度为4 μm;常规二甲苯脱蜡20 min×3次;100%乙醇脱水5 min×3次,95%乙醇脱水5 min×3次,流动自来水中冲洗2 min;苏木素染色5 min,用流水稍冲洗;1%HCl酒精溶液分化3 s,自来水冲洗返蓝30 min;伊红染色2 min;75%乙醇脱水5 min,85%乙醇脱水5 min,95%乙醇脱水5 min,100%乙醇脱水3 min×2次;二甲苯中透明5 min×3次;中性树胶封片,置于光镜下拍照。
1.4 透射电镜每组保留的3份右侧肺组织放入电镜固定液(武汉谷歌生物科技有限公司),4℃固定2~4 h,室温固定2 h;向肺组织中依次加入梯度酒精(50%~100%)-100%丙酮行脱水,每次15 min;丙酮、812包埋剂(美国SPI公司)渗透;37℃烤箱过夜,60℃烤箱聚合48 h;制作厚度60~80 nm切片;分别以2%醋酸铀饱和酒精溶液、枸橼酸铅染色15 min;室温干燥过夜,透射电镜下观察拍照。
1.5 冰冻切片荧光探针原位杂交E19、E21及P3组各取3份左侧肺组织放入4%多聚甲醛固定1~2 h;固定后放入15%蔗糖溶液中8 h,换30%蔗糖溶液过夜;冰冻切片室温晾干,置于4%多聚甲醛固定10 min,于PBS中在脱色摇床上晃动洗涤3次,每次5 min;基因笔画圈,根据不同组织不同指标特性,滴加蛋白酶K(20 μg/mL)37℃消化8 min,纯水冲洗后PBS洗3次×5 min;滴加预杂交液,37℃孵育1 h;去预杂交液后滴加含探针rno-mir-431 probe(5' -FAM-GCATGACGGCCTGCAAGACA-FAM-3' )杂交液(浓度8 ng/μL),恒温箱37℃杂交过夜;杂交后洗去杂交液;切片滴加DAPI染液,避光孵育8 min,冲洗后滴加抗荧光淬灭封片剂封片;切片于尼康正置荧光显微镜下观察并采集图像。
1.6 RT-qPCR法检测rno-miR-431表达以U6为内参设计合成rno-miR-431引物序列(表 1),rno-miR-431引物序列由上海捷瑞生物工程有限公司设计合成。提取E19、E21及P3组(每组6只胎鼠)右侧肺组织总RNA,利用变性琼脂糖凝胶电泳确保RNA完整性后进行逆转录,具体操作步骤按逆转录试剂盒(Epicentre,美国)说明书进行。获得cDNA后,按照PCR试剂盒(Arraystar,美国)操作说明,测定肺组织中rno-miR-431的表达。RT-qPCR反应体系(10 μL):SYBR Green/Florurscein qPCR Master Mix(2×)5 μL,上下游引物(10 μmol/L)各0.5 μL,DEPC水2 μL,cDNA 2 μL。RT-qPCR反应条件:95℃ 10 min;95℃ 10 s,60℃ 60 s,40个循环;95℃ 10 s,60℃ 60 s,95℃ 15 s。反应结束后确认RT-qPCR扩增曲线及融解曲线,由计算机自动计算定量结果Ct值,实验独立重复3次,每次每个样本设3个复孔,取其平均值。采用△△CT法来计算所测目的基因rno-miR-431的相对表达量,计算公式:△△CT = [CT(待测样本目的基因)-CT(待测样本内参)] - [CT(对照样本目的基因)-CT(对照样本内参)],相对表达量=2-△△CT。
| 表 1 用于RT-qPCR的引物 |
|
|
采用SPSS 17.0统计软件对数据进行统计学分析,服从正态分布计量资料以均数±标准差(x±s)表示,两组间比较采用两独立样本t检验。P < 0.05为差异有统计学意义。
2 结果 2.1 光镜观察E16组胎鼠胎肺可见分支形态的发生,原始支气管出现树枝状分支,此时管腔较小,管腔由多层柱状上皮细胞所包绕,间质厚,毛细血管几乎不可见,未见囊腔;E19组胎鼠胎肺可见树状分支进一步增加,管腔较前扩张,间质仍较厚,毛细血管腔可见,囊腔开始出现,囊腔被单层立方状上皮细胞包绕;E21组胎鼠胎肺可见管腔进一步扩大,囊腔数量增加,上皮细胞渐向扁平状发展,间质较前变薄;P1组大鼠肺组织可见囊腔极度扩张,原始间隔清晰可见;P3组大鼠肺组织可见原始间隔上出现向管腔内生长的组织隆起,即次级间隔形成;P7组大鼠肺组织可见次级间隔变薄,双层毛细血管系统渐靠拢;P14组大鼠肺组织可见肺泡结构基本趋于成熟,双层毛细血管渐变为单层毛细血管;P10周组大鼠肺组织可见肺泡结构与P14组类似,间质极薄,肺泡、肺泡管、肺泡囊等结构清晰可见,毛细血管系统已成为单层毛细血管,次级间隔发育成为成熟的薄壁肺泡隔。见图 1~2。
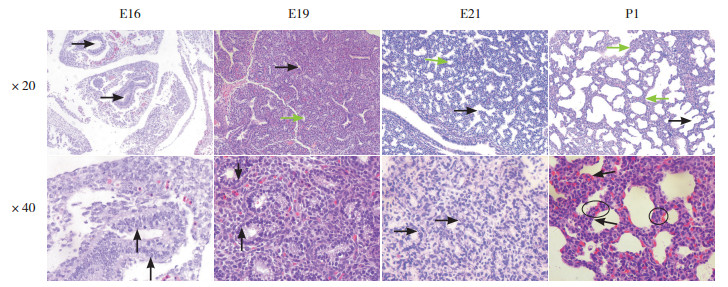
|
图 1 妊娠不同时间点胎鼠胎肺及生后1 d大鼠肺组织发育情况(苏木精-伊红染色) 20倍物镜下,E16组胎鼠胎肺可见原始支气管(黑色箭头);E19组胎鼠胎肺可见气管分支增多(黑色箭头所示为细支气管,绿色箭头所示为囊腔);E21组胎鼠胎肺可见管腔(黑色箭头)进一步扩大、呈树枝状分支,囊腔(绿色箭头)较前扩张;P1组大鼠肺组织可见肺泡管(黑色箭头)、纤毛上皮细胞(绿色箭头)。40倍物镜下,E16组大鼠胎肺可见柱状上皮细胞(黑色箭头);E19组大鼠胎肺可见立方形上皮细胞(黑色箭头);E21组大鼠胎肺可见立方形上皮细胞渐变为扁平(黑色箭头);P1组大鼠肺组织可见原始间隔(圆圈内所示),具有双层毛细血管层,箭头所示为细胞核扁平的Ⅰ型肺泡上皮细胞。 |
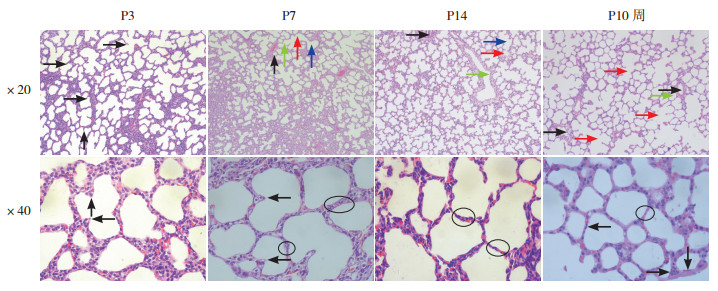
|
图 2 生后不同时间点大鼠肺组织发育情况苏木精-伊红染色) (20倍物镜下,P3组大鼠肺组织可见大量肺泡隔(箭头指示);P7组大鼠肺组织可见肺泡(黑色箭头)、肺泡囊(绿色箭头)、肺泡管(红色箭头)及呼吸性细支气管(蓝色箭头);P14组大鼠肺组织可见终末细支气管(黑色箭头)、支气管(绿色箭头)、肺泡囊(红色箭头)及肺泡管(蓝色箭头);P10周组大鼠肺组织肺泡结构成熟、间质极薄,可见动脉(黑色箭头)、肺泡(绿色箭头)、肺泡管(红色箭头)。40倍物镜下,P3组大鼠肺组织可见次级间隔(黑色箭头);P7组大鼠肺组织次级间隔较前变薄(黑色箭头),双层毛细血管渐靠拢,间隔变薄(圆圈内所示);P14组大鼠肺组织可见肺泡壁双层毛细血管间距进一步减小(圆圈内所示);P10周组大鼠肺组织可见肺泡壁极薄,单层毛细血管系统已形成(圆圈内所示),箭头所示为Ⅰ型肺泡上皮细胞。 |
E16组胎鼠胎肺细胞多为未分化细胞,未见Ⅱ型肺泡上皮细胞,未分化细胞中可见较多细胞器,尚无板层小体出现;E19组胎鼠胎肺出现Ⅱ型肺泡上皮细胞分化,细胞游离面有少量微绒毛,胞质内第1次出现嗜锇板层小体;E21组胎鼠胎肺的Ⅱ型肺泡上皮细胞增大,游离面微绒毛数量增加,胞质内可见较多板层小体、线粒体、多泡体等细胞器;P1组大鼠肺组织板层小体数量增加,体积增大,可见宽大而扁薄的Ⅰ型肺泡上皮细胞;P3组、P7组、P14组及P10周组大鼠肺组织均可见细胞表面微绒毛渐增长,胞质内大量结构致密的板层小体聚集且渐向细胞壁靠近,并自胞质内排出。见图 3。
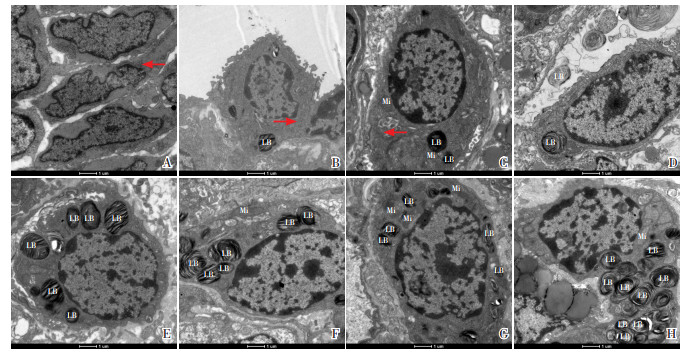
|
图 3 不同时间点妊娠期胎鼠胎肺及生后大鼠肺组织电镜结果(×4 800) LB为板层小体,Mi为线粒体。A:E16组胎鼠胎肺组织可见未分化细胞(红色箭头);B:E19组胎鼠胎肺组织出现Ⅱ型肺泡上皮细胞,有微绒毛,且在胞质内出现板层小体,箭头所指为糖原颗粒。C:E21组胎鼠胎肺组织可见Ⅱ型肺泡上皮细胞、板层小体、线粒体及糖原颗粒(红色箭头);D:P1组大鼠肺组织出现了Ⅰ型肺泡上皮细胞,板层小体排出胞质;P3组(E)、P7组(F)、P14组(G)及P10周(H)组大鼠肺组织均可见板层小体数量逐渐增加并聚集。 |
为研究miR-431在大鼠胎肺组织中的表达情况,利用冰冻切片荧光探针原位杂交技术分别检测肺发育关键时间点E19、E21及P3中miR-431的表达情况。结果表明,miR-431在细胞质中表达,且在E19组中表达量高,在P3组中几乎不表达,随时间延长呈现递减趋势。见图 4。
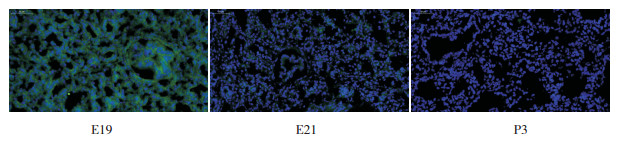
|
图 4 大鼠肺发育关键时间点肺组织中miR-431表达情况(原位杂交,×40) 绿色荧光信号表示miR-431的表达,蓝色荧光信号代表细胞核。可见绿色荧光信号围绕蓝色细胞核,提示miR-431在细胞质中表达。E19组中miR-431表达最强,E21组中miR-431表达较弱,P3组中几乎未见到miR-431表达。 |
为进一步探索miR-431在大鼠肺发育过程中的表达差异,利用RT-qPCR技术对大鼠肺发育关键时期E19、E21及P3组中miR-431表达水平进行定量分析。结果发现,miR-431在3个时间点的表达差异有统计学意义(F=526.2,P < 0.001),且E19组中的表达水平显著高于E21和P3组(P < 0.05),见图 5。
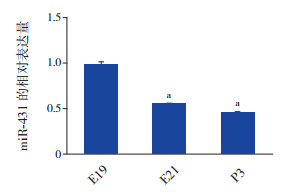
|
图 5 RT-qPCR法检测大鼠肺发育过程中肺组织miR-431表达比较(n=6) a示与E19组比较,P < 0.001。 |
肺发育包括肺结构与功能两大部分,其中肺结构的发育是功能成熟的解剖学基础。本研究基于肺发育的五个经典阶段[9]:胚芽期(大鼠E1~13,人类孕3~7周)、假腺管期(大鼠E13~18,人类孕7~17周)、小管期(大鼠E18~20,人类孕17~27周)、囊泡期(大鼠E20~22或E23,人类孕27~36周)及肺泡期(大鼠P1~P5,人类孕36周至生后7~10年),观察到E16组胎鼠胎肺细胞尚处于未分化状态,上皮性的管道开始出现;至E19时胎肺细胞内第1次出现板层小体。板层小体是肺泡表面活性物质(pulmonary surfactant, PS)的细胞内储存单位[10],该物质的出现预示着Ⅱ型肺泡上皮细胞开始合成并分泌PS[11],这是肺发育成熟的重要节点。E21至P1,可见板层小体自胞质内排出,这与此期PS开始分泌至气道腔内,促进出生后肺复张的机理相符,临床上相当于足月儿出生时,此时肺发育基本完成,因PS缺乏引起呼吸窘迫发生的情况显著减少。自P1至成年可见肺泡形成迅速发生,肺泡结构逐渐成熟。肺形态结构发育异常和PS合成异常是支气管肺发育不良(BPD)及呼吸窘迫综合征(RDS)发生的主要原因。BPD是极早产儿后期存活最常见、最严重的并发症之一,发病率随着胎龄的降低而增加[12]。目前BPD主要发生在≤28周胎龄的婴儿[13],即对应于本研究中E19(小管期)及E21(囊泡期)。本研究发现E19时方出现板层小体及Ⅱ型肺泡上皮细胞,直至P3时才出现次级间隔将囊状单位进一步分开,从而增加肺泡数量,减小肺泡大小,这与BPD的特征性改变相符,BPD常表现为Ⅱ型肺泡上皮细胞数量少,缺乏PS,顺应性差,肺泡数量少,肺泡结构简单化一致[14]。维生素A被认为是预防BPD的强烈推荐用药[15],而维生素A与次级间隔的发生、成熟相关[16],这从间接印证了肺发育不成熟是BPD发病的决定性因素之一。尽管目前认为应用PS对于降低BPD的发病率没有显著价值[17],但这可能与PS的应用提升早产儿存活率有关。另一导致早产儿呼吸功能不全甚至死亡的重要原因为RDS,其发生发展的关键环节是由于PS合成与分泌的相对或绝对不足[18]。Condo等[19]发现在小于34周的早产儿中RDS的发生率为45%,而在34周后新生儿中该比例降至5%。本研究观察到大鼠在E21至P1时(对应人类孕27~36周)才开始出现板层小体的聚集并自胞质排出,表明PS合成和分泌方开始加速,因而此期以前出生的早产儿RDS发生率高。
本课题组前期研究发现miR-431与肺发育相关[7-8]。目前,miR-431的研究主要局限在肿瘤的恶性特征[20-23]、脊髓性肌萎缩[24]、骨骼肌的生长[25-26]等相关领域,尚无miR-431与肺发育相关的报道。本研究基于形态学的关键时间点E19、E21及P3,进行胎肺的原位杂交,结果发现miR-431主要在细胞质中表达,E19组miR-431表达水平显著高于E21及P3组。本研究进一步对三个时间点的miR-431进行RT-qPCR检测,发现随着胎龄的增加,miR-431表达水平递减,其中E19组分别与E21、P3组两两之间比较差异有统计学意义。虽然E21与P3组之间无明显统计学差异,这可能与至E21时肺发育已基本成熟有关。以上研究结果表明,miR-431可能与肺发育密切相关,而miR-431如何通过靶基因进而影响肺发育的机制还需后续进一步研究。
综上所述,本实验对大鼠8个连续关键时间点,涉及肺发育假腺管期、小管期、囊泡期及肺泡期进行了观察分析,获得了系统而连续的大鼠肺发育的形态学资料。并利用原位杂交及RT-qPCR技术发现miR-431在肺发育过程中可能起重要的负向调控作用,为后续进一步研究肺发育及相关性疾病的机制提供基础和方向。
| [1] |
de Mello RR, Rodrigues Reis AB, da Silva KS. Cognitive performance of premature infants:association between bronchopulmonary dysplasia and cognitive skills. Crosssectional study[J]. Sao Paulo Med J, 2017, 135(4): 383-390. DOI:10.1590/1516-3180.2017.0010190317 (  0) 0) |
| [2] |
Schmalisch G, Wilitzki S, Roehr CC, et al. Development of lung function in very low birth weight infants with or without bronchopulmonary dysplasia:longitudinal assessment during the frst 15 months of corrected age[J]. BMC Pediatr, 2012, 12: 37. DOI:10.1186/1471-2431-12-37 (  0) 0) |
| [3] |
Stocks J, Hislop A, Sonnappa S. Early lung development:lifelong effect on respiratory health and disease[J]. Lancet Respir Med, 2013, 1(9): 728-742. DOI:10.1016/S2213-2600(13)70118-8 (  0) 0) |
| [4] |
Ortiz LE, McGrath-Morrow SA, Sterni LM, et al. Sleep disordered breathing in bronchopulmonary dysplasia[J]. Pediatr Pulmonol, 2017, 52(12): 1583-1591. DOI:10.1002/ppul.v52.12 (  0) 0) |
| [5] |
Bhaskaran M, Wang Y, Zhang H, et al. MicroRNA-127 modulates fetal lung development[J]. Physiological genomics, 2009, 37(3): 268-278. DOI:10.1152/physiolgenomics.90268.2008 (  0) 0) |
| [6] |
Lu Y, Thomson JM, Wong HY, et al. Transgenic over-expression of the microRNA miR-17-92 cluster promotes proliferation and inhibits differentiation of lung epithelial progenitor cells[J]. Dev Biol, 2007, 310(2): 442-453. DOI:10.1016/j.ydbio.2007.08.007 (  0) 0) |
| [7] |
Yang Y, Kai G, Pu XD, et al. Expression profle of microRNAs in fetal lung development of Sprague-Dawley rats[J]. Int J Mol Med, 2012, 29(3): 393-402. (  0) 0) |
| [8] |
Kan Q, Ding S, Yang Y, et al. Expression profile of plasma microRNAs in premature infants with respiratory distress syndrome[J]. Mol Med Rep, 2015, 12(2): 2858-2864. DOI:10.3892/mmr.2015.3699 (  0) 0) |
| [9] |
Hussain M, Xu C, Lu M, et al. Wnt/beta-catenin signaling links embryonic lung development and asthmatic airway remodeling[J]. Biochim Biophys Acta, 2017, 1863(12): 3226-3242. DOI:10.1016/j.bbadis.2017.08.031 (  0) 0) |
| [10] |
柳琪林, 胡森, 盛志勇. 肺泡Ⅱ型上皮细胞形态与功能的研究进展[J]. 中国危重病急救医学, 2003, 15(7): 445-446. DOI:10.3760/j.issn:1003-0603.2003.07.026 (  0) 0) |
| [11] |
El-Gendy N, Kaviratna A, Berkland C, et al. Delivery and performance of surfactant replacement therapies to treat pulmonary disorders[J]. Ther Deliv, 2013, 4(8): 951-980. DOI:10.4155/tde.13.72 (  0) 0) |
| [12] |
Wang H, Gao X, Liu C, et al. Morbidity and mortality of neonatal respiratory failure in China:surfactant treatment in very immature infants[J]. Pediatrics, 2012, 129(3): e731-e740. DOI:10.1542/peds.2011-0725 (  0) 0) |
| [13] |
Strueby L, Thebaud B. Advances in bronchopulmonary dysplasia[J]. Expert Rev Respir Med, 2014, 8(3): 327-338. DOI:10.1586/17476348.2014.899907 (  0) 0) |
| [14] |
Ali Z, Schmidt P, Dodd J, et al. Bronchopulmonary dysplasia:a review[J]. Arch Gynecol Obstet, 2013, 288(2): 325-333. DOI:10.1007/s00404-013-2753-8 (  0) 0) |
| [15] |
Jensen EA, Foglia EE, Schmidt B. Evidence-based pharmacologic therapies for prevention of bronchopulmonary dysplasia:application of the grading of recommendations assessment, development, and evaluation methodology[J]. Clin Perinatol, 2015, 42(4): 755-779. DOI:10.1016/j.clp.2015.08.005 (  0) 0) |
| [16] |
刘友红, 陈贻骥. 维生素A在肺泡分隔期中的作用[J]. 实用儿科临床杂志, 2008, 23(16): 1287-1289. DOI:10.3969/j.issn.1003-515X.2008.16.025 (  0) 0) |
| [17] |
Jain D, Bancalari E. Bronchopulmonary dysplasia:clinical perspective[J]. Birth Defects Res A Clin Mol Teratol, 2014, 100(3): 134-144. DOI:10.1002/bdra.23229 (  0) 0) |
| [18] |
Bishop AE. Pulmonary epithelial stem cells[J]. Cell Prolif, 2004, 37(1): 89-96. DOI:10.1111/cpr.2004.37.issue-1 (  0) 0) |
| [19] |
Condo V, Cipriani S, Colnaghi M, et al. Neonatal respiratory distress syndrome:are risk factors the same in preterm and term infants?[J]. J Matern Fetal Neonatal Med, 2017, 30(11): 1267-1272. DOI:10.1080/14767058.2016.1210597 (  0) 0) |
| [20] |
Pan L, Ren F, Rong M, et al. Correlation between downexpression of miR-431 and clinicopathological signifcance in HCC tissues[J]. Clin Transl Oncol, 2015, 17(7): 557-563. DOI:10.1007/s12094-015-1278-y (  0) 0) |
| [21] |
Liu Y, Li L, Liu Z, et al. Downregulation of MiR-431 expression associated with lymph node metastasis and promotes cell invasion in papillary thyroid carcinoma[J]. Cancer Biomark, 2018, 22(4): 727-732. DOI:10.3233/CBM-181253 (  0) 0) |
| [22] |
Yang J, Zhu H, Jin Y, et al. MiR-431 inhibits cell proliferation and induces cell apoptosis by targeting CDK14 in pancreatic cancer[J]. Eur Rev Med Pharmacol Sci, 2018, 22(14): 4493-4499. (  0) 0) |
| [23] |
Su WB, Liu ZY. MiR-431 inhibits colorectal cancer cell invasion via repressing CUL4B[J]. Eur Review Med Pharmacol Sci, 2018, 22(10): 3047-3052. (  0) 0) |
| [24] |
Wertz MH, Winden K, Neveu P, et al. Cell-type-specifc miR-431 dysregulation in a motor neuron model of spinal muscular atrophy[J]. Hum Mol Genet, 2016, 25(11): 2168-2181. DOI:10.1093/hmg/ddw084 (  0) 0) |
| [25] |
Lee KP, Shin YJ, Panda AC, et al. miR-431 promotes differentiation and regeneration of old skeletal muscle by targeting Smad4[J]. Genes Dev, 2015, 29(15): 1605-1617. DOI:10.1101/gad.263574.115 (  0) 0) |
| [26] |
Wu R, Li H, Li T, et al. Myostatin regulates miR-431 expression via the Ras-Mek-Erk signaling pathway[J]. Biochem Biophys Res Commun, 2015, 461(2): 224-229. DOI:10.1016/j.bbrc.2015.03.150 (  0) 0) |
 2019, Vol. 21
2019, Vol. 21


