2. 华中科技大学同济医学院附属武汉儿童医院新生儿科, 湖北 武汉 430016;
3. 南京医科大学附属儿童医院新生儿医疗中心, 江苏 南京 210008;
4. 上海市儿童医院新生儿科, 上海 200062;
5. 西北妇女儿童医院新生儿科, 陕西 西安 710061
外源性肺表面活性物质(pulmonary surfactant, PS)可显著降低新生儿,尤其早产儿呼吸窘迫综合征(respiratory distress syndrome, RDS)的发生率或减轻其病情程度,改善患儿预后, 目前几乎成为RDS预防和治疗的常规用药被广泛应用,并被写入多个指南[1-4]。近10年来,国产外源性PS(珂立苏,calsurf)也被广泛应用于新生儿RDS的预防和治疗,同样取得了显著效果[5-8],且得到多中心临床研究的验证[6]。
近年来,已有使用外源性PS治疗新生儿重症肺炎的报道,显示外源性PS在促进患儿病情恢复方面具有一定效果[9-10]。但尚缺乏系统、前瞻性、多中心、大样本研究进一步验证。肺炎、尤其重症感染性肺炎,是我国新生儿住院和新生儿呼吸衰竭的第一位原因、新生儿死亡的第二位原因[11-13]。因此,通过多中心研究进一步明确外源性PS对新生儿重症肺炎的疗效具有重要临床价值。意大利学者Facco等[14]利用气相色谱和气相色谱-质谱分析技术对31例需要接受呼吸机治疗的足月和近足月儿PS的主要成分——不饱和二棕榈酸磷脂酰胆碱(disaturated-phosphatidylcholine)药代动力学进行了研究,在活体内证实了重症肺炎患儿存在PS的缺乏。因此,我们推测补充外源性PS将有助于促进重症肺炎患儿的恢复。为此,本项目组织了国内5家专科医院的新生儿科对国产外源性PS [珂立苏(calsurf),北京双鹤现代医药技术有限责任公司]治疗新生儿重症肺炎的效果进行了前瞻性临床研究,报道如下。
1 资料与方法 1.1 研究对象及分组2017年1月至2018年6月间,在北京市朝阳区妇幼保健院、华中科技大学同济医学院附属武汉儿童医院、南京医科大学附属南京儿童医院、上海市儿童医院和西北妇女儿童医院等5家医院新生儿科和新生儿重症监护室住院、且符合以下条件者列为研究对象:(1)根据病史、临床表现和实验室检查,诊断为感染性肺炎(包括宫内感染性肺炎和社区获得性肺炎,不包括院内感染性肺炎);(2)符合美国儿童感染病协会关于儿童重症肺炎的诊断标准,即具有一项或一项以上主要指标(有创机械通气、液体复苏难以纠正的休克、急需无创正压通气、低氧血症要求吸入氧浓度大于一般护理单元提供的氧浓度)或具有两项或两项以上次要指标(呼吸频率增加、呼吸暂停、呼吸做功增加、氧合指数 < 250、肺多野浸润、儿童早期预警评分 > 6分、意识状态改变、低血压、胸腔积液、合并异常血红蛋白SS或免疫抑制或免疫缺陷、不能解释的代谢性酸中毒)[15]。为尽可能缩小各协作机构之间可能存在的纳入标准的偏差,本研究所采用的重症肺炎诊断标准为满足该标准中主要标准的第一条,即入院时需要接受有创机械通气,或次要标准中需无创机械通气+氧合指数 < 250。在患儿入院时根据家长意愿,同意接受珂立苏治疗者为观察组,不同意接受珂立苏治疗者为对照组。
1.2 治疗方法两组患儿入院后均常规给予机械通气及抗生素治疗等常规治疗。在此基础上,珂立苏组于患儿入院后给予气管插管,在正压通气下将珂立苏70~100 mg/kg分次注入至肺内。为保证PS在肺内充分均匀分布,一般每次注入70 mg,正压通气10 min后,再注入另外70 mg直至注射完毕,并继续正压通气10 ~20 min后,根据患儿情况适当下调呼吸机参数或改为无创机械通气。
1.3 观察指标(1)入院时对氧的依赖程度(即维持经皮血氧饱和度正常需要吸入的氧浓度);(2)治疗前和治疗后1 h患儿对氧依赖程度的变化及动脉血气变化;(3)机械通气时间和住院时间;(4)主要并发症,如气胸、肺出血、继发性RDS、持续性肺动脉高压、三级以上颅内出血等的发生率(入院时已经发生者不包括在内);(5)住院费用;(6)珂立苏补充前和补充后4~6 h肺脏超声变化;(7)预后(治愈率、病死率等)。
1.4 统计学分析采用SPSS 18.0软件进行统计学处理。计数资料采用例数和百分率(%)表示,组间比较采用χ2检验。计量资料以均值±标准差(x±s)表示,组间比较采用成组或配对资料的t检验。P < 0.05为差异具有统计学意义。
2 结果 2.1 两组患儿基本情况的比较符合纳入标准且资料较完整的新生儿共208例,其中珂立苏组127例(年龄10 min~22 d),对照组81例(年龄0.5 h~21 d)。两组患儿性别分布、胎龄、出生体重、出生方式、早产与足月儿构成比的比较差异均无统计学意义(P > 0.05),见表 1。两组患儿中,早产儿及足月儿一般情况的比较差异亦无统计学意义(P > 0.05),见表 2。
| 表 1 两组患儿基本情况的比较 |
|
|
| 表 2 两组患儿中早产儿及足月儿基本情况的比较 |
|
|
由表 1和表 2可知,两组患儿胎龄、出生体重及早产与足月的构成等基本情况差异无统计学意义,故在下面的分析中,两组早产儿与足月儿资料综合在一起进行分析。
为观察珂立苏对重症肺炎患儿动脉血气的改善情况,本研究对两组患儿入院时(治疗前)及治疗后1 h动脉血气的变化进行了比较,结果见表 3。
| 表 3 治疗前后两组患儿动脉血气等的变化 (x±s) |
|
|
从表 3可以看出:珂立苏治疗组在入院时(治疗前)对氧的需求更高(需要吸入更高浓度的氧),但PaCO2更高,PaO2更低,氧合指数更低(P < 0.05),提示该组患儿整体病情更重。治疗1 h后,两组患儿动脉血气分析结果均明显改善(PaO2、PaCO2恢复正常),氧合指数明显升高(P < 0.05);珂立苏组氧合指数高于对照组(P < 0.05)。
2.3 珂立苏治疗前后肺脏超声变化本研究对两组72例(珂立苏组40例、对照组32例)重症肺炎患儿进行了动态肺脏超声检查,在入院时(治疗前)肺脏超声均表现为大面积肺实变伴支气管充气征、胸膜线模糊或消失、A-线消失。入院后,珂立苏组患儿在接受珂立苏治疗4~6 h后肺实变即明显减轻,而对照组在治疗12~24 h后才有明显变化。
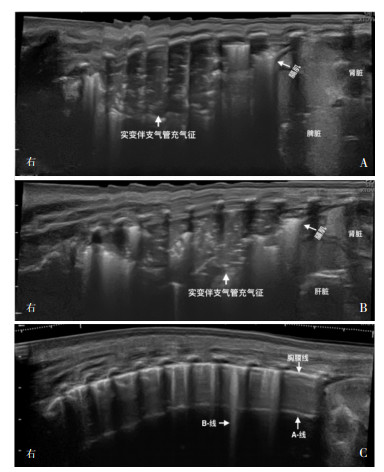
典型病例介绍:患儿男,胎龄39+2周,剖宫产出生,出生体重3 720 g。因咳嗽、发热、呼吸困难3 d于生后17 d入院。入院时T 38.5℃,双肺闻及密集细湿性啰音。入院时动脉血气分析:pH 7.17,PaO2 48.6 mm Hg,PaCO2 62.7 mm Hg,SaO2 80%,乳酸6.6 mmol/L,BE -8.9 mmol/L。血常规WBC 23.5×109/L,N 81%,CRP 66.8 mg/L,降钙素原11.3 ng/mL。肺脏超声(宽景成像)显示双肺边缘不规则的大面积实变区伴支气管充气征、胸膜线消失或模糊、A-线消失(图 1A)。给予珂立苏280 mg气管内注入,1 h后复查肺脏超声,显示双肺肺实变明显减轻(图 1B);1.5 d后肺脏超声显示肺实变完全消失,恢复正常(图 1C)。
|
图 1 珂立苏治疗前后肺炎的超声表现 A:治疗前肺脏超声显示右肺大面积实变伴支气管充气征、实变区边界不规则,胸膜线模糊或消失,A-线消失。B:治疗后1 h肺脏超声,显示双肺实变范围均较前明显减轻。C:治疗1.5 d后复查肺脏超声,显示肺实变完全消失,仅有少许B-线,胸膜线与A-线清晰显示。 |
从表 4可见,两组患儿预后均良好,但使用珂立苏治疗能够缩短患儿机械通气时间和住院时间,并使患儿住院费用降低近10%;两组患儿并发症的发生率比较差异无统计学意义。
| 表 4 两组患儿机械通气时间、住院时间、住院费用、并发症及预后比较 |
|
|
重症肺炎常导致内源性PS缺乏和/或其活性不足,其主要原因与机制包括细菌(或其他病原微生物)感染与炎症反应直接导致肺泡Ⅱ型细胞损伤;大量炎症细胞聚集和炎症因子释放,通过介导炎症反应而导致弥漫性肺泡损害;感染引起的缺氧、酸中毒等可抑制PS的合成、释放及其功能;肺泡-毛细血管渗透性增加,血浆蛋白等成分进入肺泡破坏PS的性质,并引起严重的非心源性肺水肿;如发生肺出血等并发症,则血液中的某些成分如血红蛋白、红细胞等可使PS灭活;肺内液体增多可导致PS释放减少及PS失活;此外,随病程进展,PS的消耗增加及婴儿对PS的需要量增加等,均可使重症肺炎患儿发生PS缺乏或活性不足,尤其Facco等[14]的体内研究,进一步证实了重症感染性肺炎患儿存在PS的严重缺乏,为重症肺炎患儿补充外源性PS治疗提供了理论支持。
本多中心研究结果表明,重症肺炎患儿补充外源性PS对促进其恢复具有重要作用,如能够迅速降低患儿对氧的需求、迅速改善患儿动脉血气分析(如降低PaCO2、提高PaO2等)及改善患儿氧合状态,进而缩短患儿机械通气时间和住院时间,并在一定程度上降低患儿住院费用。
此外,本研究显示,珂立苏治疗组患儿在入院时对氧的需求更高,且PaCO2更高、PaO2更低,氧合指数更低,说明该组患儿在入院时病情程度更为严重。但两组患儿气胸、肺出血、持续性肺动脉高压、继发性RDS及三级以上颅内出血等并发症的发生率与对照组相比并无明显差异,提示珂立苏治疗有降低重症肺炎患儿严重并发症发生率的趋势,这也是本组患儿病情较重,但呼吸机使用时间较短、住院时间也较短的原因之一。
近年来,肺脏超声已成功用于诊断新生儿肺炎[16-17]及其他肺脏疾病,具有准确、可靠、无射线损害、可在床边开展、便于动态观察等优点。本研究对72例患儿进行了肺部超声检查,发现补充外源性PS能使重症肺炎患儿的肺部实变程度迅速减轻、肺部超声影像学变化迅速改善,可用于指导治疗和病情观察,建议有条件的医疗机构开展。
本组病例中有22例需要第2次或第3次使用珂立苏,重复用药率为17.3%。重复用药的可能原因有:(1)患儿入院时病情过于严重;(2)开始给予外源性PS的时间太迟;(3)首次剂量严重不足;(4)随着病情进展、肺部病理改变加重、自身PS进一步减少;(5)PS失活。因此,在对重症感染性肺炎患儿给予外源性PS治疗过程中,需要关注上述因素。
总之,本多中心前瞻性研究结果表明,珂立苏用于新生儿重症感染性肺炎的治疗具有良好效果,证实外源性PS(珂立苏)可用于新生儿重症肺炎的治疗,值得临床推广应用。本研究的主要局限性在于系非随机对照研究,可能会造成一定程度的结果偏差;观察的指标尚不够深入、系统和细化,有待于在今后的研究中加以改进。
| [1] |
Sweet DG, Camielli V, Greisen G, et al. European Consensus Guidelines on the Management of Respiratory Distress Syndrome -2016 Update[J]. Neonatology, 2017, 111(2): 107-125. DOI:10.1159/000448985 (  0) 0) |
| [2] |
Walsh BK, Daigle B, DiBlasi RM, et al. AARC Clinical Practice Guideline. Surfactant replacement therapy:2013[J]. Respir Care, 2013, 58(2): 367-375. DOI:10.4187/respcare.02189 (  0) 0) |
| [3] |
Polin RA, Carlo WA, Committee on Fetus and Newborn, et al. Surfactant replacement therapy for preterm and term neonates with respiratory distress[J]. Pediatrics, 2014, 133(1): 156-163. DOI:10.1542/peds.2013-3443 (  0) 0) |
| [4] |
中国医师协会新生儿科医师分会, 《中华围产医学杂志》编辑委员会. 早产儿呼吸窘迫综合征早期防治专家共识[J]. 中华围产医学杂志, 2017, 20(8): 557-559. DOI:10.3760/cma.j.issn.1007-9408.2017.08.002 (  0) 0) |
| [5] |
董声焕, 孙眉月, 寇同欣, 等. 肺表面活性剂(珂立苏)治疗新生儿呼吸窘迫综合征多中心临床试验[J]. 中国小儿急救医学, 2009, 16(2): 120-124. DOI:10.3760/cma.j.issn.1673-4912.2009.02.008 (  0) 0) |
| [6] |
李文斌, 夏世文, 王琳, 等. 注射用牛肺表面活性物质防治新生儿呼吸窘迫综合征多中心调查[J]. 中华实用儿科临床杂志, 2013, 28(14): 1061-1064. DOI:10.3760/cma.j.issn.2095-428X.2013.14.007 (  0) 0) |
| [7] |
石云, 杨娜, 刘敬, 等. 国产肺表面活性物质珂立苏治疗足月新生儿呼吸窘迫综合征临床疗效评价[J]. 中国现代医药杂志, 2011, 13(6): 9-12. DOI:10.3969/j.issn.1672-9463.2011.06.003 (  0) 0) |
| [8] |
刘敬, 李静雅, 韩涛, 等. 珂立苏治疗足月新生儿呼吸窘迫综合征临床研究[J]. 中国小儿急救医学, 2014, 21(5): 259-262. (  0) 0) |
| [9] |
刘晓梅. 肺表面活性物质在新生儿重症肺炎治疗中的应用[J]. 中国卫生标准管理, 2017, 8(24): 47-48. DOI:10.3969/j.issn.1674-9316.2017.24.022 (  0) 0) |
| [10] |
马丽娜. 肺表面活性物质在新生儿重症肺炎治疗中的应用价值[J]. 航空航天医学杂志, 2017, 28(5): 553-555. DOI:10.3969/j.issn.2095-1434.2017.05.020 (  0) 0) |
| [11] |
郭艳梅, 刘翠青. 河北省儿童医院新生儿呼吸衰竭的临床流行病学特点[J]. 中华围产医学杂志, 2012, 15(11): 670-675. DOI:10.3760/cma.j.issn.1007-9408.2012.11.009 (  0) 0) |
| [12] |
饶懿. 7970例新生儿住院病例分析[J]. 中国病案, 2012, 13(5): 71-73. DOI:10.3969/j.issn.1672-2566.2012.05.040 (  0) 0) |
| [13] |
赵鸿, 金真菊. 1509例新生儿死亡因素分析[J]. 中国妇幼健康研究, 2009, 20(6): 686-688. DOI:10.3969/j.issn.1673-5293.2009.06.029 (  0) 0) |
| [14] |
Facco M, Nespeca M, Simonato M, et al. In vivo effect of pneumonia on surfactant disaturated-phosphatidylcholine kinetics in newborn infants[J]. PLoS One, 2014, 9(12): e93612. DOI:10.1371/journal.pone.0093612 (  0) 0) |
| [15] |
李熙鸿. 儿童重症肺炎诊断标准的优缺点[J]. 中华实用儿科临床杂志, 2017, 32(6): 408-411. DOI:10.3760/cma.j.issn.2095-428X.2017.06.003 (  0) 0) |
| [16] |
肖甜甜, 金梅, 巨容, 等. 床旁肺部超声在新生儿肺炎中的诊断价值[J]. 中国当代儿科杂志, 2018, 20(6): 444-448. (  0) 0) |
| [17] |
Liu J, Liu F, Liu Y, et al. Lung ultrasonography for the diagnosis of severe neonatal pneumonia[J]. Chest, 2014, 146(2): 383-388. DOI:10.1378/chest.13-2852 (  0) 0) |
 2019, Vol. 21
2019, Vol. 21


