2. 中南大学湘雅公共卫生学院流行病与卫生统计学系, 湖南 长沙 410078;
3. 中南大学湘雅三医院, 湖南 长沙 410013;
4. 南华大学附属第一医院, 湖南 衡阳 421000;
5. 厦门市儿童医院, 福建 厦门 361006
儿童急性淋巴细胞白血病(acute lymphoblastic leukemia, ALL)的危险分层治疗及高级支持治疗出现后,其预后显著改善,儿童ALL 5年无事件生存率(event-free survival, EFS)在发达国家已高达90%[1-2],在发展中国家也有85%左右[3],然而初期缓解患儿中仍有15%~20%在早期或晚期面临复发[4]。此外,有部分低危患儿接受了过强的化疗,导致严重感染[5]等治疗相关毒副作用,对患者的生存质量造成了不可逆的影响。因此,需要进行更精准的个体化治疗。传统的儿童ALL个体化治疗因素包括疾病初始状态(如患者年龄、性别、首诊白细胞计数、免疫表型、染色体核型)、早期反应和微小残留病灶(MRD)[6],然而最新的研究发现基因多态性[7]、特殊miRNA[8]及其蛋白衍生物[9]将会是儿童ALL个体化治疗因素中的新成员。
S100A8作为钙结合蛋白S100蛋白家族成员之一,定位于人染色体lq21,该区易发生染色体的缺失、易位、重叠等改变,稳定性差,与肿瘤的发生、发展密切相关,故预示其在癌症预后中的潜在作用。有研究发现S100A8在多种肿瘤中有过表达现象,尤其是乳腺癌[10],同时它在胃癌的发生与发展中也发挥了重要作用[11]。在MLL重排的婴儿ALL患者中[12],过表达S100A8/S100A9可发生糖皮质激素抵抗,而在新发急性髓系白血病中,S100A8可视为不良预后因素[13]。然而S100A8在儿童ALL中的临床意义仍未可知。
本课题组在早期研究中发现,S100A8可通过细胞自噬调控白血病细胞耐药[14],同时也发现在耐药白血病细胞株中有S100A8过表达现象,且S100A8靶向siRNA可通过抑制细胞自噬增强三氧化二砷诱导急性髓系白血病细胞死亡[15]。本研究回顾性分析了377例初治ALL患儿S100A8表达情况,旨在探讨S100A8在儿童ALL中的潜在作用。
1 资料与方法 1.1 研究对象病例来自于2009~2014年中南大学湘雅医院、中南大学湘雅三医院、南华大学附属第一医院的初诊ALL患儿,共377例。其纳入标准为:(1)未经治疗的初诊ALL患儿;(2)诊断标准参照FAB和WHO 2008白血病诊断标准[16],危险度分级采用中国儿童白血病协作组CCLG-2008-ALL方案[17];(3)按照CCLG-2008-ALL方案[17]化疗,随访期间无干细胞移植;(4)无第二肿瘤放疗及化疗史;(5)病历资料完整。
根据激素诱导化疗第8天外周血细胞数分为外周血幼稚细胞 < 1×106/L的激素诱导良好组(prednisone good response, PGR)和外周血幼稚细胞 > 1×106/L的激素诱导不良组(prednisone poor response, PPR)。按中国儿童白血病协作CCLG-2008-ALL方案危险度分层标准[17]将患儿分为标危(standard risk)、中危(median risk)及高危(high risk)组。以S100A8表达中位水平为界,将患儿分为S100A8≥中位数的S100A8过表达组及小于中位数的S100A8低表达组。另外,将患儿分为无事件组和事件组:随访56个月期间无复发或无死亡等不良事件发生的患儿为无事件组,而随访期间发生死亡、复发或发生第二种恶性肿瘤等不良事件的患儿为事件组。
1.2 样本采集患儿诊断穿刺时留取骨髓,按1 : 1加入碱性介质盐水/磷酸盐缓冲盐水(PBS)稀释,加入淋巴细胞分离液经离心机3 000 rpm离心30 min后提取单个核细胞,与Trizol混合存入-80°冰箱,待下一步提取mRNA。
1.3 ELISA检测血清S100A8表达水平根据ELISA试剂盒操作说明检测血清中的S100A8表达。ELISA试剂盒由北京康为世纪生物科技有限公司提供,该试剂盒中使用的是小鼠单克隆抗过蛋白(abcam)作为捕获抗体,最后在酶标仪450 nm处读取平板数值。
1.4 RT-PCR检测S100A8 mRNA的表达采用Trizol试剂盒(Invitmgen公司产品)按说明提取总RNA。将2 μg总RNA与HiFi-MMLV酶(北京康为世纪生物)混合用于进行逆转录(RT),将cDNA用于实时定量聚合酶链式反应(PCR)(TaqMan探针)来评估S100A8 mRNA表达,以β-肌动蛋白作为内部对照。引物序列如下:S100A8上游引物5'-CCTAACCGCTATAAAAAGGAG-3',S100A8下游引物5'-ATGATGCCCACGGACTTGCC-3';GAPDH上游引物5'-GGCACCCAGCACAATGA-AGA-3',GAPDH下游引物5'-CGTCATACTCC-TGCTTGCTG-3'。β内参作为内部对照用于检测S100A8表达情况。PCR条件:94℃变性2 min,继而94℃变性30 s,56℃(β-内参,50℃持续30 s)退火30 s,72℃延伸30 s,30个循环,72℃终延伸5 min。PCR产物经1.0%琼脂糖凝胶电泳、EB染色拍照、扫描后通过Band Leader软件进行条带灰度半定量分析。
1.5 统计学分析采用SPSS 19.0软件进行统计学分析。采用Kaplan-Meier用于分析患者生存状态,秩检验分析各组患儿中S100A8表达差异,Cox比例风险回归模型用于分析预后因素,用95%置信区间(CI)估计风险比,P < 0.05为差异有统计学意义。无事件生存期定义为自诊断到第1次事故(包括复发或完全缓解期间的死亡)出现的时期。总生存期指自诊断到死亡或末次失访日期。
2 结果 2.1 一般情况及影响预后的因素377例ALL患儿中,中位年龄为42个月(范围:3~180个月);男234例,女143例。标危组117例(31.0%),中危组182例(48.3%),高危组78例(20.7%)。共随访56个月,其中41例(10.9%)患儿死亡,死亡主要原因是感染(24例,6.4%)和复发(15例,4.0%),其总生存率为89.1%,中位无事件生存时间为55个月(范围:13~99个月)。
将各可能影响儿童ALL结局的因素纳入Cox风险比例模型中进行分析(表 1),结果显示,患儿性别、年龄及对泼尼松的反应与生存无关,而化疗后第33天MRD(P=0.004)、危险度分层(P=0.023)及S100A8的表达水平(P=0.001)与患儿的生存相关。
| 表 1 377例儿童ALL预后因素Cox回归分析 |
|
|
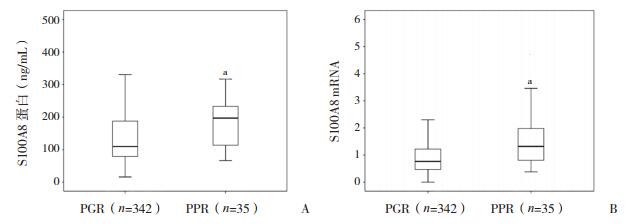
377例患儿均接受CCLG-ALL-2008方案治疗,在联合化疗开始时均予泼尼松诱导化疗,治疗7 d后,根据患儿外周血中白细胞数评估激素治疗反应,PGR组342例,PPR组35例。PGR组和PPR组血清S100A8蛋白水平中位值分别为109.50、196.94 ng/mL,两组比较差异有统计学意义(P < 0.01)(图 1A)。通过RT-PCR进一步检测,PGR组S100A8 mRNA中位表达水平为0.76(范围:0~41),PPR组为1.32(范围:0.38~17.23),两组比较差异有统计学意义(P < 0.01),见图 1B。
|
图 1 PGR与PPR组S100A8表达情况 A:S100A8蛋白表达;B:S100A8 mRNA表达。a示与PGR组比较,P < 0.01。 |
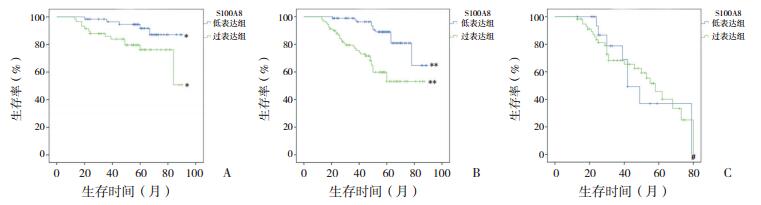
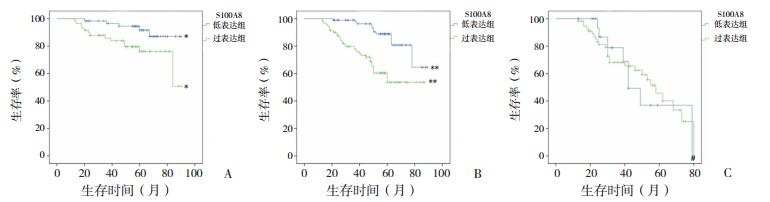
在标危患儿中,在蛋白水平和mRNA水平S100A8过表达组EFS均明显低于低表达组,差异有统计学意义(P < 0.05),见图 2A和图 3A。在中危患儿中,在蛋白水平和mRNA水平S100A8过表达组EFS亦低于低表达组(P < 0.01,图 2B和图 3B)。然而,在高危患儿中,在蛋白水平和mRNA水平S100A8过表达和低表达两组EFS差异均无统计学意义(P > 0.05),见图 2C和图 3C。
|
图 2 S100A8蛋白表达水平与预后的关系 图A、B、C分别为标危、中危、高危患儿S100A8蛋白表达水平与患儿EFS关系的Kaplan-Meier生存曲线。 |
|
图 3 S100A8 mRNA表达水平与预后的关系 图A、B、C分别为标危、中危、高危患儿S100A8 mRNA表达水平与患儿EFS关系的Kaplan-Meier生存曲线。 |
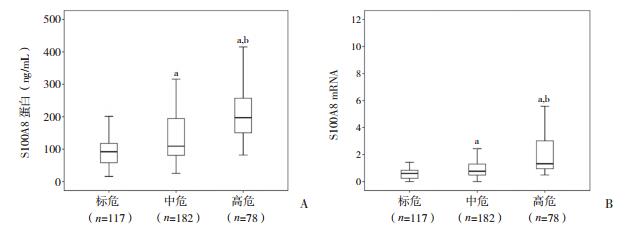
上述结果已显示非高危儿童ALL的S100A8表达水平与EFS呈负相关,因此进一步比较不同危险度分层患儿的S100A8表达情况。ELISA检测显示,在标危、中危和高危组中S100A8中位表达水平分别为91.98、109.32、197.15 ng/mL,三组比较差异有统计学意义(P < 0.01)。PCR检测结果亦显示,标危、中危和高危组三组间S100A8 mRNA表达差异有统计学意义(P < 0.01)。见图 4。
|
图 4 不同危险度分层患儿S100A8表达情况 A:S100A8蛋白表达;B:S100A8 mRNA表达。a示与标危组比较,P < 0.01;b示与中危组比较,P < 0.01。 |
根据随访结果将患儿分为两个亚组,即事件组与无事件组,结果显示事件组患儿血清S100A8表达水平(中位数为257.10 ng/mL)明显高于无事件组(中位数为106.30 ng/mL),差异有统计学意义(P < 0.01)。RT-PCR检测相关mRNA得到相同结果。见图 5。
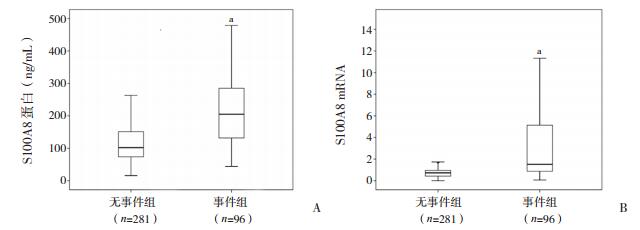
|
图 5 事件组与无事件组S100A8表达情况 A:S100A8蛋白表达;B:S100A8 mRNA表达。a示与无事件组比较,P < 0.01。 |
S100A8蛋白是S100蛋白家族成员之一,由93个氨基酸组成,分子质量为10 835 Da,常以二聚体形式存在。研究发现S100A8与人类多种实体肿瘤有关,与血液系统疾病也有千丝万缕的联系,本课题组早前的研究证实S100A8可通过细胞自噬参与白血病细胞的耐药[14],并提示S100A8可能是改善白血病治疗的新靶点,敲除S100A8蛋白相关mRNA后,白血病细胞对化疗敏感性及细胞凋亡均明显增加[15]。Spijkers-Hagelstein等[12]的研究也得到相似的结果,他们的研究证实S100A8在急性髓细胞性白血病中发挥重要作用,提示S100A8可能与白血病的发生发展和预后密切相关[18-19]。本研究显示,S100A8与儿童ALL的EFS、危险度分层及不良事件的发生均有关,提示过表达S100A8可能为儿童ALL的不良预后因素。结合本课题组的前期研究,S100A8影响儿童ALL预后可能与自噬相关[14],具体机制有待进一步研究证实。
Spijkers-Hagelstein等[12]的研究指出,S100A8的过表达与胞浆中游离Ca2+减少和泼尼松诱导不良有关,提示S100A8高表达与泼尼松诱导不良相关,S100A8可能影响激素治疗反应。本研究发现,在377例儿童ALL患儿激素诱导治疗阶段有35例患儿高表达S100A8,其泼尼松诱导效果差,另342例S100A8低表达,其激素诱导效果良好,且PGR组与PPR组的S100A8表达两者比较差异有统计学意义,与既往研究结果[12]一致。
然而,S100A8与肿瘤的关系目前仍未完全阐明,其在肿瘤组织中的差异性表达,并且既有抗肿瘤作用,亦有促肿瘤作用,推测此双重作用与其局部浓度及不同机制有关[20-22]。Hermani等[23]和Petersson等[24]均发现S100A8在恶性肿瘤及良性肿瘤细胞中分布有差异。本研究显示,在不同危险度分层患儿中,S1001A8表达差异有统计学意义,其中危险度较高的患儿S1001A8表达相对较高。在标危和中危患者中,S100A8过表达组其EFS显著低于低表达组。由于在目前的危险分层治疗中,整体上仍有20%左右的复发率[4],提示在目前的危险分层治疗中,仍有部分患儿接受的化疗强度偏弱,进一步增加危险分层指标成为必要。本研究结果提示,S1001A8可作为进一步细分危险分层的指标,以指导诊疗,降低复发风险。本研究还显示,在高危ALL患儿中,S100A8表达水平与EFS无关。强烈的联合化疗是高危型ALL患儿的基础治疗方案,强化疗后并发的粒缺期感染是影响ALL患儿生存的重要因素,其病死率占ALL治疗相关死亡的72%[17, 25],提示一方面儿童ALL高危组患儿生存率与患儿感染死亡、诱导缓解率低等相关性更大,另一方面S100A8在高危ALL中筛选出需要降低或增强化疗强度的病例簇群意义不大,其更重要的意义在于在中低危病人中筛选出需要提高化疗强度的病例簇群。
过去几十年基因组学和表观遗传学分析的进展使我们对ALL的生物学和复发有了更深一步的理解,这将更加有助于对患者进行精确风险分层,也大大提高了儿童ALL的长期无病生存率和治疗相关事件,但仍有一部分患儿接受了过强的化疗导致治疗相关死亡,而另一部分患儿接受了相对低强度的化疗而导致复发[1, 26]。因此增加危险度评估因子进行更加精准的个体化治疗成为必然。本研究探讨了S100A8与儿童ALL预后之间的关系,发现S100A8高表达可能与预后不良有关,提示它有望作为评价儿童ALL预后的重要因子,成为经典危险分层治疗基础上进一步细分危险度的重要新指标,并有望在此基础上成为一种潜在的治疗靶点。
| [1] |
Pui CH, Carroll WL, Meshinchi S, et al. Biology, risk stratification, and therapy of pediatric acute leukemias:an update[J]. J Clin Oncol, 2011, 29(5): 551-565. DOI:10.1200/JCO.2010.30.7405 (  0) 0) |
| [2] |
Trehan A, Bansal D, Varma N, et al. Improving outcome of acute lymphoblastic leukemia with a simplified protocol:report from a tertiary care center in north India[J]. Pediatr Blood Cancer, 2017, 64(4). DOI:10.1002/pbc.26281.Epub2016Oct20 (  0) 0) |
| [3] |
陈波, 宪莹, 苏庸春, 等. CCLG-ALL 08方案治疗儿童急性淋巴细胞白血病毒副作用的临床研究[J]. 中国当代儿科杂志, 2013, 15(9): 737-742. (  0) 0) |
| [4] |
Schneidawind C, Hagmaier V, Faul C, et al. Second allogeneic hematopoietic cell transplantation enables long-term diseasefree survival in relapsed acute leukemia[J]. Ann Hematol, 2018, 97(12): 2491-2500. DOI:10.1007/s00277-018-3454-y (  0) 0) |
| [5] |
Hakim H, Dallas R, Zhou Y, et al. Acute respiratory infections in children and adolescents with acute lymphoblastic leukemia[J]. Cancer, 2016, 122(5): 798-805. DOI:10.1002/cncr.v122.5 (  0) 0) |
| [6] |
许金云, 罗建明. BIM基因与儿童急性淋巴细胞白血病对糖皮质激素耐药的相关性[J]. 中国当代儿科杂志, 2017, 19(8): 945-949. (  0) 0) |
| [7] |
Bahari G, Hashemi M, Naderi M, et al. Association of SHMT1 gene polymorphisms with the risk of childhood acute lymphoblastic leukemia in a sample of Iranian population[J]. Cell Mol Biol (Noisy-le-grand), 2016, 62(2): 45-51. (  0) 0) |
| [8] |
Swellam M, El-Khazragy N. Clinical impact of circulating microRNAs as blood-based marker in childhood acute lymphoblastic leukemia[J]. Tumour Biol, 2016, 37(8): 10571-10576. DOI:10.1007/s13277-016-4948-7 (  0) 0) |
| [9] |
Kim DY, Park HS, Choi EJ, et al. Immunophenotypic markers in adult acute lymphoblastic leukemia:the prognostic significance of CD20 and TdT expression[J]. Blood Res, 2015, 50(4): 227-234. DOI:10.5045/br.2015.50.4.227 (  0) 0) |
| [10] |
Yin C, Li H, Zhang B, et al. Erratum to:RAGE-binding S100A8/A9 promotes the migration and invasion of human breast cancer cells through actin polymerization and epithelialmesenchymal transition[J]. Breast Cancer Res Treat, 2016, 156(2): 407-408. DOI:10.1007/s10549-016-3754-7 (  0) 0) |
| [11] |
Kwon CH, Moon HJ, Park HJ, et al. S100A8 and S100A9 promotes invasion and migration through p38 mitogen-activated protein kinase-dependent NF-κB activation in gastric cancer cells[J]. Mol Cells, 2013, 35(3): 226-234. DOI:10.1007/s10059-013-2269-x (  0) 0) |
| [12] |
Spijkers-Hagelstein JA, Schneider P, Hulleman E, et al. Elevated S100A8/S100A9 expression causes glucocorticoid resistance in MLL-rearranged infant acute lymphoblastic leukemia[J]. Leukemia, 2012, 26(6): 1255-1265. DOI:10.1038/leu.2011.388 (  0) 0) |
| [13] |
Yang XY, Zhang MY, Zhou Q, et al. High expression of S100A8 gene is associated with drug resistance to etoposide and poor prognosis in acute myeloid leukemia through influencing the apoptosis pathway[J]. Onco Targets Ther, 2016, 9: 4887-4899. DOI:10.2147/OTT (  0) 0) |
| [14] |
Yang M, Zeng P, Kang R, et al. S100A8 contributes to drug resistance by promoting autophagy in leukemia cells[J]. PLoS One, 2014, 9(5): e97242. DOI:10.1371/journal.pone.0097242 (  0) 0) |
| [15] |
Yang L, Yang M, Zhang H, et al. S100A8-targeting siRNA enhances arsenic trioxide-induced myeloid leukemia cell death by down-regulating autophagy[J]. Int J Mol Med, 2012, 29(1): 65-72. (  0) 0) |
| [16] |
Möricke A1, Reiter A, Zimmermann M, et al. Risk-adjusted therapy of acute lymphoblastic leukemia can decrease treatment burden and improve survival:treatment results of 2169 unselected pediatric and adolescent patients enrolled in the trial ALL-BFM 95[J]. Blood, 2008, 111(9): 4477-4489. DOI:10.1182/blood-2007-09-112920 (  0) 0) |
| [17] |
吴敏媛, 李志刚. "儿童急性淋巴细胞白血病诊疗建议(第四次修订)"解读[J]. 中华儿科杂志, 2014, 52(9): 645-648. DOI:10.3760/cma.j.issn.0578-1310.2014.09.002 (  0) 0) |
| [18] |
McConkey DJ1, Nicotera P, Hartzell P, et al. Glucocorticoids activate a suicide process in thymocytes through an elevation of cytosolic Ca2+ concentration[J]. Arch Biochem Biophys, 1989, 269(1): 365-370. DOI:10.1016/0003-9861(89)90119-7 (  0) 0) |
| [19] |
Kaiser N, Edelman IS. Further studies on the role of calcium in glucocorticoid-induced lymphocytolysis[J]. Endocrinology, 1978, 103(3): 936-942. DOI:10.1210/endo-103-3-936 (  0) 0) |
| [20] |
Eisenblaetter M, Flores-Borja F, Lee JJ, et al. Visualization of tumor-immune interaction-target-specific imaging of S100A8/A9 reveals pre-metastatic niche establishment[J]. Theranostics, 2017, 7(9): 2392-2401. DOI:10.7150/thno.17138 (  0) 0) |
| [21] |
Kraakman MJ, Lee MK, Al-Sharea A, et al. Neutrophil-derived S100 calcium-binding proteins A8/A9 promote reticulated thrombocytosis and atherogenesis in diabetes[J]. J Clin Invest, 2017, 127(6): 2133-2147. DOI:10.1172/JCI92450 (  0) 0) |
| [22] |
Ruma IM, Putranto EW, Kondo E, et al. MCAM, as a novel receptor for S100A8/A9, mediates progression of malignant melanoma through prominent activation of NF-κB and ROS formation upon ligand binding[J]. Clin Exp Metastasis, 2016, 33(6): 609-627. DOI:10.1007/s10585-016-9801-2 (  0) 0) |
| [23] |
Hermani A, Hess J, De Servi B, et al. Calcium-binding proteins S100A8 and S100A9 as novel diagnostic markers in human prostate cancer[J]. Clin Cancer Res, 2005, 11(14): 5146-5152. DOI:10.1158/1078-0432.CCR-05-0352 (  0) 0) |
| [24] |
Petersson S, Bylander A, Yhr M, et al. S100A7(Psoriasin), highly expressed in ductal carcinoma in situ (DCIS), is regulated by IFN-gamma in mammary epithelial cells[J]. BMC Cancer, 2007, 7: 205. DOI:10.1186/1471-2407-7-205 (  0) 0) |
| [25] |
Lund B, Asberg A, Heyman M, et al. Risk factors for treatment related mortality in childhood acute lymphoblastic leukaemia[J]. Pediatr Blood Cancer, 2011, 56(4): 551-559. DOI:10.1002/pbc.v56.4 (  0) 0) |
| [26] |
Smith MA, Altekruse SF, Adamson PC, et al. Declining childhood and adolescent cancer mortality[J]. Cancer, 2014, 120(16): 2497-2506. DOI:10.1002/cncr.28748 (  0) 0) |
 2019, Vol. 21
2019, Vol. 21


