遗传性球形红细胞增多症(hereditary spherocytosis, HS)是一种常见的遗传性溶血病。世界各地均有发病,北欧和北美地区患病率高达1/2 000[1],国内也有不少病例报道[2-4]。即使在一个家族中,HS的临床严重程度也有很大差异,这反映了该疾病的遗传异质性。HS临床表现为贫血、黄疸、脾肿大,外周血涂片中可见球形红细胞。但其症状不典型, 实验室检查易受影响, 误诊、漏诊率高[5-7]。本研究对5例HS患儿临床特点及遗传学特点进行总结分析,以提高对该病的认识。
1 资料与方法 1.1 研究对象收集2016年4月至2018年7月湖南省人民医院儿童医学中心收治的5例HS患儿的临床资料,5例患儿均通过外周血基因检测确诊。5例患儿中,男2例,女3例;年龄2个月至10岁。
1.2 基因检测经患儿监护人知情同意后,采集患儿外周静脉血4 mL(EDTA抗凝),父母静脉血各2 mL,行全外显子基因测序及Sanger验证,由基因检测公司完成。
2 结果 2.1 临床资料患儿首诊症状均是贫血,其中4例合并感染后病情加重,表现为面色苍白、皮肤黄染、尿色加深,病程中病情反复而多次就诊;既往均有新生儿高胆红素血症,但排除G6PD酶缺乏及母儿ABO血型不合;病例4患儿姨妈曾确诊为HS并行脾切除术,患儿母亲因脾肿大行脾切除术(具体病因不详)。5例患儿实验室检测结果提示造血功能正常,排除自身免疫性溶血性贫血、缺铁性贫血、地中海贫血及血红蛋白尿。患儿的一般资料见表 1。
| 表 1 5例HS患儿主要临床特点及实验室检查结果 |
|
|
基因检测结果显示(表 2),病例1存在ANK1基因的移码突变c.3398(exon29)delA,其父母在该位点未发现相同突变,为新生突变。病例2在ANK1基因上发现一个无义突变c.4306C > T,Arg突变为终止密码子,从而使肽链合成提前终止,其父母在该位点均未发现相同突变。病例3存在ANK1基因的移码突变c.957(exon9)_c.961(exon9)delAATCT,其父母在该位点均未发现相同突变。病例4存在SPTB基因移码突变c.318(exon3)delG,其父母在该位点未发现相同突变。病例5为SPTB基因移码突变c.3484delC,为自发突变,具有致病性,父母均未见突变异常;同时合并存在SLC4A1基因杂合移码突变c.2558C > T,来自父亲该位点的纯合突变,但患儿父亲无相关临床症状,此为非致病基因(图 1)。
| 表 2 5例HS基因测序分析结果 |
|
|
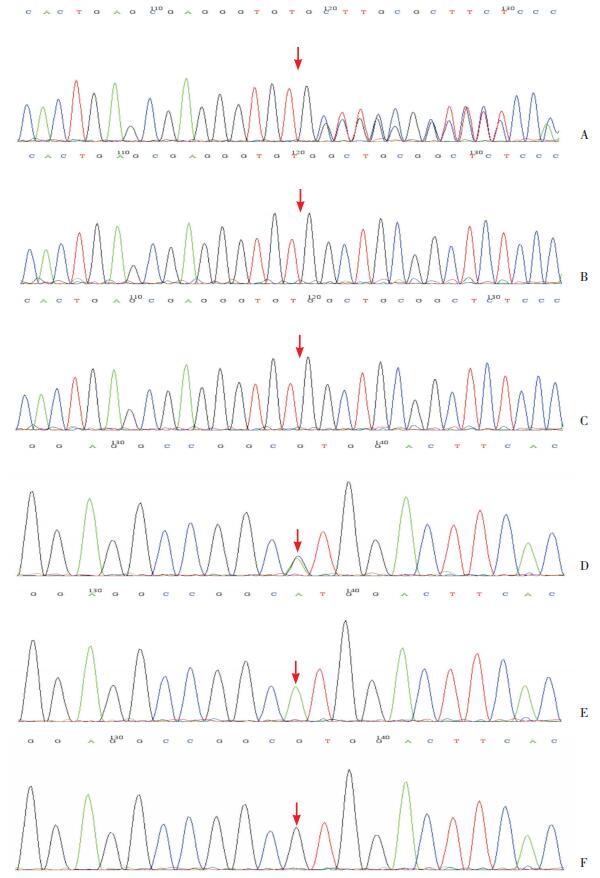
|
图 1 病例5患儿及其父母全外显子基因测序图谱 A:患儿SPTB基因移码突变c.3484delC;B、C:患儿父亲、母亲SPTB基因型为野生型;D:患儿SLC4A1基因移码突变c.2558C > T;E:患儿父亲SLC4A1基因在该位点为纯合变异(无致病性);F:患儿母亲SLC4A1基因型为野生型。图A、D、E箭头所指为突变位点,图B、C、F箭头所指位点无突变。 |
HS大多为常染色体显性遗传(占75%),少数为常染色体隐性遗传(占25%);男女均可发病;其分子生物学基础是基因突变导致红细胞膜蛋白缺陷[8]。目前发现的致病基因有5种,为SLC4A1、ANK1、SPTA1、SPTB、EPB42,分别编码带3蛋白、锚蛋白、α-收缩蛋白、β-收缩蛋白、4.2蛋白[1, 9],其中以ANK1基因的突变最为常见。男女均可发病,纯合子多在胎儿期死亡,临床就诊患儿几乎全部为杂合子。
本组病例均以贫血、黄疸、脾肿大等慢性溶血性贫血为临床表现,早期均有新生儿高胆红素血症。HS的诊断通常需结合实验室检查结果,血涂片中的球形红细胞增多是该病的重要标志,但不是HS所特有的,仅用来筛查典型病例[9]。HS患者球形红细胞百分比可从1%~2%到60%~70%不等[10]。周玲等[11]的研究结果提示,对于HS的诊断,不可过分注重外周血球形红细胞所占比例。Bianchi等[12]研究了150例HS患者的实验室检查结果,发现18%的患者在外周血涂片中很少有球形红细胞。本研究中仅1例球形红细胞计数达10%以上。因此,外周血涂片球形红细胞计数不能作为HS排除诊断的依据。红细胞渗透脆性增高是HS的主要特征, 但它不能检测不典型和轻微的HS病例,并受到与红细胞膜缺陷无关因素的影响,如网织红细胞计数、自身免疫性溶血性贫血或其他溶血性疾病[1]。伊红-5-马来酰亚胺(EMA)结合试验和酸化甘油溶解试验(AGLT)灵敏度、特异度高[13-15],而流式细胞仪EMA结合试验可简便、快速确诊HS [16]。十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分析红细胞膜蛋白可确诊HS并鉴定特异性蛋白质缺乏症,但对轻微型HS和无症状的携带者不敏感,因此指南建议在特殊病例进行此检查[1]。Crisp等[17]的研究指出,SDS-PAGE不应该作为HS诊断的常规检测项目。HS的诊断和管理指南建议[1],HS可通过相关基因的分子检测进行诊断,适用于一些临床症状轻微的HS患者,特别是当家族病史阴性或常规实验室检测无法明确诊断时[18],可被认为是HS诊断的新标准。Wang等[19]通过下一代测序(NGS)报道了首例ANK1c.4276C > T(p.R1426*)杂合无义突变所致的HS,认为NGS是一个快速检测HS的方法。Chen等[20]认为基因检测可确定疾病的遗传模式,可了解HS的生物学机制及丰富HS的基因突变谱,增加对疾病的认识。该组病例临床表现不典型,有可疑阳性家族史患儿的外周血涂片球形红细胞增多不明显,常规实验室检查均无法明确诊断,因此进一步完善基因检测对疾病精准诊断具有重要意义。
国内外均有学者对HS的分子生物学机制进行了研究,Narla等[21]对红细胞膜的结构和功能进行了研究,并探究了膜蛋白结构异常对红细胞功能的影响以及所导致的疾病。HS的突变数量最多存在于基因ANK1和SPTB中[22-23],并且也是中国HS患者的主要致病原因[24]。本组病例中8号染色体上ANK1基因突变占3例,其中1例为新发突变,14号染色体上SPTB基因突变2例,其中1例有可疑阳性HS家族史,1例同时合并SLC4A1基因突变,与报道相符。Luo等[25]的研究发现移码突变是膜结合域和膜收缩蛋白结合域中最常见的突变类型,而无义突变则是调节域中最常见的,本组病例中有4例移码突变,1例无义突变,移码突变多见,与Luo等[25]的报道相符。ANK1突变可引起显性和隐性疾病,新生突变率高,是家族史阴性患儿的常见病因[24, 26],临床可有轻微到重度的表现。本组病例中病例1为ANK1新生突变。基因突变可改变其编码的蛋白质,或提前终止蛋白合成,从而导致红细胞膜蛋白缺陷,改变红细胞膜形态结构,使其功能发生异常,因而导致红细胞破坏,并出现贫血、黄疸、脾肿大的临床表现。Perrotta等[27]研究发现,STPB基因突变的患者通常有轻度到中度的贫血,可不需要输血。本研究中病例4、病例5均为SPTB基因突变,均需输血治疗,与报道不同。Park等[28]研究发现,HS基因型与表型之间存在相关性,与其他突变相比,膜收缩蛋白结合域的突变患儿有更严重的贫血,且更亦发生再障危象。本研究病例数尚少,基因型与表型之间是否存在相关性有待进一步研究。
脾切除术是治疗HS的唯一方法,因脾切除术后远期可能并发脓毒症[29]及血栓形成[30],为了延缓这些并发症的出现,目前小儿外科医生建议5岁以上HS患儿行部分脾切除术。研究提示腹腔镜下部分脾切除术可改善HS患儿临床症状及血液学指标,但大约10%的患儿需要行全脾切除[31],不排除基因突变影响部分脾切除术的治疗效果,尚需要多中心研究证实。
综上所述,HS患儿的临床表现无特异性,对反复贫血、黄疸、脾肿大的患儿,排除其他溶血性贫血及其他相关因素后,建议考虑HS。多数HS患儿外周血涂片球形红细胞计数无明显异常,球形红细胞计数增高不能单独作为HS的诊断依据。临床医生应加深对HS临床表现及实验室检查的认识,基因检测有助于HS的精准诊疗。
| [1] |
Bolton-Maggs PH, Langer JC, Iolascon A, et al. Guidelines for the diagnosis and management of hereditary spherocytosis-2011 update[J]. Br J Haematol, 2012, 156(1): 37-49. DOI:10.1111/bjh.2011.156.issue-1 (  0) 0) |
| [2] |
张丹, 万伍卿. ANK1基因突变致遗传性球型红细胞增多症1例报告[J]. 临床儿科杂志, 2017, 35(9): 691-693. DOI:10.3969/j.issn.1000-3606.2017.09.014 (  0) 0) |
| [3] |
马亚南, 刘玉峰. 儿童遗传性球形红细胞增多症88例临床特点分析[J]. 河南医学研究, 2017, 26(6): 992-993. DOI:10.3969/j.issn.1004-437X.2017.06.012 (  0) 0) |
| [4] |
方潇倩, 徐酉华. 儿童遗传性球形细胞增多症35例[J]. 中国小儿血液与肿瘤杂志, 2013, 18(2): 74-77. (  0) 0) |
| [5] |
张碧红, 陈纯, 岑丹阳, 等. 遗传性球形红细胞增多症26例[J]. 实用儿科临床杂志, 2008, 23(15): 1162-1164. DOI:10.3969/j.issn.1003-515X.2008.15.008 (  0) 0) |
| [6] |
Ma S, Deng X, Liao L, et al. Analysis of the causes of the misdiagnosis of hereditary spherocytosis[J]. Oncol Rep, 2018, 40(3): 1451-1458. (  0) 0) |
| [7] |
Deng Z, Liao L, Yang W, et al. Misdiagnosis of two cases of hereditary spherocytosis in a family and review of published reports[J]. Clin Chim Acta, 2015, 441: 6-9. DOI:10.1016/j.cca.2014.12.002 (  0) 0) |
| [8] |
Gallagher PG. Abnormalities of the erythrocyte membrane[J]. Pediatr Clin North Am, 2013, 60(6): 1349-1362. DOI:10.1016/j.pcl.2013.09.001 (  0) 0) |
| [9] |
Bolton-Maggs PH. Hereditary spherocytosis; new guidelines[J]. Arch Dis Child, 2004, 89(9): 809-812. DOI:10.1136/adc.2003.034587 (  0) 0) |
| [10] |
张之南, 沈悌. 血液病诊断及疗效标准[M]. 北京: 科学出版社, 2007: 43-46.
(  0) 0) |
| [11] |
周玲, 刘敏, 陈钟. 球形红细胞计数在遗传性球形红细胞增多症诊断中的意义[J]. 大理医学院学报, 2000, 9(2): 9-10. (  0) 0) |
| [12] |
Bianchi P, Fermo E, Vercellati C, et al. Diagnostic power of laboratory tests for hereditary spherocytosis:a comparison study in 150 patients grouped according to molecular and clinical characteristics[J]. Haematologica, 2012, 97(4): 516-523. DOI:10.3324/haematol.2011.052845 (  0) 0) |
| [13] |
Hunt L, Greenwood D, Heimpel H, et al. Toward the harmonization of result presentation for the eosin-5'-maleimide binding test in the diagnosis of hereditary spherocytosis[J]. Cytometry B Clin Cytom, 2015, 88(1): 50-57. DOI:10.1002/cytob.21187 (  0) 0) |
| [14] |
Arora RD, Dass J, Maydeo S, et al. Flow cytometric osmotic fragility test and eosin-5'-maleimide dye-binding tests are better than conventional osmotic fragility tests for the diagnosis of hereditary spherocytosis[J]. Int J Lab Hematol, 2018, 40(3): 335-342. DOI:10.1111/ijlh.2018.40.issue-3 (  0) 0) |
| [15] |
Ma S, Deng X, Liao L, et al. Analysis of the causes of the misdiagnosis of hereditary spherocytosis[J]. Oncol Rep, 2018, 40(3): 1451-1458. (  0) 0) |
| [16] |
Chari PS, Prasad S. Flow cytometric eosin-5'-maleimide test is a sensitive screen for hereditary spherocytosis[J]. Indian J Hematol Blood Transfus, 2018, 34(3): 491-494. DOI:10.1007/s12288-017-0907-8 (  0) 0) |
| [17] |
Crisp RL, Solari L, Vota D, et al. A prospective study to assess the predictive value for hereditary spherocytosis using five laboratory tests (cryohemolysis test, eosin-5'-maleimide flow cytometry, osmotic fragility test, autohemolysis test, and SDSPAGE) on 50 hereditary spherocytosis families in Argentina[J]. Ann Hematol, 2011, 90(6): 625-634. DOI:10.1007/s00277-010-1112-0 (  0) 0) |
| [18] |
Russo R, Andolfo I, Manna F, et al. Multi-gene panel testing improves diagnosis and management of patients with hereditary anemias[J]. Am J Hemato, 2018, 93(5): 672-682. DOI:10.1002/ajh.v93.5 (  0) 0) |
| [19] |
Wang X, Yi B, Mu K, et al. Identification of a novel de novo ANK1 R1426* nonsense mutation in a Chinese family with hereditary spherocytosis by NGS[J]. Oncotarget, 2017, 8(57): 96791-96797. (  0) 0) |
| [20] |
Chen J, Zhou Y, Gao Y, et al. A genetic features and gene interaction study for identifying the genes that cause hereditary spherocytosis[J]. Hematology, 2017, 22(4): 240-247. DOI:10.1080/10245332.2016.1235673 (  0) 0) |
| [21] |
Narla J, Mohandas N. Red cell membrane disorders[J]. Int J Lab Hematol, 2017, 39(Suppl 1): 47-52. (  0) 0) |
| [22] |
Delaunay J. The molecular basis of hereditary red cell membrane disorders[J]. Blood Rev, 2007, 21(1): 1-20. DOI:10.1016/j.blre.2006.03.005 (  0) 0) |
| [23] |
He BJ, Liao L, Deng ZF, et al. Molecular genetic mechanisms of hereditary spherocytosis:current perspectives[J]. Acta Haematol, 2018, 139(1): 60-66. DOI:10.1159/000486229 (  0) 0) |
| [24] |
Wang R, Yang S, Xu M, et al. Exome sequencing confirms molecular diagnoses in 38 Chinese families with hereditary spherocytosis[J]. Sci China Life Sci, 2018, 61(8): 947-953. DOI:10.1007/s11427-017-9232-6 (  0) 0) |
| [25] |
Luo Y, Li Z, Huang L, et al. Spectrum of ankyrin mutations in hereditary spherocytosis:a case report and review of the literature[J]. Acta Haematol, 2018, 140(2): 77-86. DOI:10.1159/000492024 (  0) 0) |
| [26] |
Miraglia del Giudice E, Francese M, Nobili B, et al. High frequency of de novo mutations in ankyrin gene (ANK1) in children with hereditary spherocytosis[J]. J Pediatr, 1998, 132(1): 117-120. DOI:10.1016/S0022-3476(98)70495-0 (  0) 0) |
| [27] |
Perrotta S, Gallagher PG, Mohandas N. Hereditary spherocytosis[J]. Lancet, 2008, 372(9647): 1411-1426. DOI:10.1016/S0140-6736(08)61588-3 (  0) 0) |
| [28] |
Park J, Jeong DC, Yoo J, et al. Mutational characteristics of ANK1 and SPTB genes in hereditary spherocytosis[J]. Clin Genet, 2016, 90(1): 69-78. (  0) 0) |
| [29] |
Chong J, Jones P, Spelman D, et al. Overwhelming postsplenectomy sepsis in patients with asplenia and hyposplenia:a retrospective cohort study[J]. Epidemiol Infect, 2017, 145(2): 397-400. DOI:10.1017/S0950268816002405 (  0) 0) |
| [30] |
Kimmig LM, Palevsky HI. Review of the association between splenectomy and chronic thromboembolic pulmonary hypertension[J]. Ann Am Thorac Soc, 2016, 13(6): 945-954. DOI:10.1513/AnnalsATS.201512-826FR (  0) 0) |
| [31] |
Pugi J, Carcao M, Drury LJ, et al. Results after laparoscopic partial splenectomy for children with hereditary spherocytosis:are outcomes influenced by genetic mutation?[J]. J Pediatr Surg, 2018, 53(5): 973-975. DOI:10.1016/j.jpedsurg.2018.02.027 (  0) 0) |
 2019, Vol. 21
2019, Vol. 21


