赖氨酸尿性蛋白耐受不良(lysinuric protein intolerance, LPI)由Perheentupa于1965年首次报道[1],是阳离子氨基酸转运体缺陷导致尿中赖氨酸、精氨酸、鸟氨酸排泄增高,属常染色体隐性遗传。芬兰发病率最高,为1/76 000;其次日本、意大利较多报道,世界各地散发[2-4]。该病常累及呼吸、血液、肾脏和消化等多个系统,临床医生因对该病的认识不足,常常孤立分析各个系统的临床表现,进而发生误诊。该病虽然临床表现复杂,但仍有规律可循,肺间质病变常常是该病突出的临床表现及主要死因之一[5]。如出现肺间质病变并伴生长发育落后、贫血、肝脾肿大等症状和体征,同时实验室检查如血清铁蛋白、血氨、尿乳清酸等指标升高,血赖氨酸、精氨酸、鸟氨酸降低,应高度怀疑本病。尽早检测相关基因明确诊断,尽早治疗是改善患儿预后的关键。本文通过两家系3例患儿的临床及基因诊断资料分析,以加深临床医生对该病的认识。
1 资料与方法 1.1 研究对象病例1:女,8岁8月。因面色苍白、发热伴加重1 d于2017年6月5日入院。患儿系第2胎第2产,足月顺产,出生体重2.15 kg,出生时有缺氧,于当地医院住院3 d(具体不详),生长发育同正常同龄儿。既往史:患儿自幼进食母乳及配方奶无明显异常,断奶后进食肉类、奶制品,易呕吐,喜食青菜和米饭。6年前外院诊断“贫血”,曾输血1次,2年前曾左侧膝部骨折。家族史:父亲39岁,体健;母亲33岁,幼时有过敏性紫癜病史;姐姐同为该病患儿(见病例2)。查体:身高110 cm(< -3 SD),体重15 kg(< -3 SD)。面色苍白,双下肢散见瘀斑,双侧颈部淋巴结肿大,左下颌腺肿痛。双肺呼吸音粗,未闻及干湿啰音。心脏查体未见异常。肝右肋下2 cm,脾左肋下5 cm,质地较硬,边界清楚。神经系统查体未见异常。辅助检查:血常规示WBC 1.8×109/L(参考值:5.0~12.0×109/L),Hb 61 g/L(参考值:110~160 g/L),PLT 81×109/L(参考值:100~300×109/L)。C反应蛋白(CRP)19.8 mg/L(参考值:0~10.0 mg/L)。肝功能:白蛋白(ALB)28.3 g/L(参考值:35.0~55.0 g/L),余正常。心肌酶:乳酸脱氢酶(LDH)1 327 IU/L(参考值:140~280 IU/L),余正常。电解质:血钙1.86 mmol/L(参考值:2.25~2.75 mmol/L),余正常。贫血七项:铁蛋白(FER)706 ng/mL(参考值:10~291 ng/mL),促红细胞素(EPO)107.87 mIU/mL(参考值:1.48~31.88 mIU/mL),叶酸(FA)7.24 ng/mL(参考值:8.86~96.24 ng/mL),可溶性转铁蛋白受体(sTFR)39.88 nmol/L(参考值:12.16~27.25 nmol/L)。血淀粉酶1 108 U/L(参考值:28~100 U/L),尿淀粉酶1 612 U/L(参考值:0~450 U/L)。血氨、血乳酸、可提取性核抗原抗体谱(ENA)、抗双链DNA抗体、抗核抗体、血管炎三项均正常。骨髓涂片示骨髓增生明显活跃,中性粒系成熟障碍伴巨幼样变,红系及巨核系未见明显异常,血小板减少,全片见少量组织细胞,偶见噬血细胞。彩超示左侧腮腺、颌下腺炎性增大,肝脏、脾脏弥漫性增大。左腕关节X线示骨质疏松。
病例2:女,11岁6月,病例1之姐姐。患儿系第1胎第1产,足月顺产,出生体重2.82 kg,出生情况可,生长发育正常。既往史:自幼不喜肉类、奶类,进食高蛋白食物后出现呕吐,平时易疲劳。查体:身高122 cm(< -2 SD),体重20.5 kg(< -3 SD)。面色苍白,心肺查体未见明显异常。肝右肋下2 cm,脾左肋下2 cm,质地较硬,边缘清楚。神经系统检查未见异常。辅助检查:血常规示WBC 3.1×109/L,Hb 103 g/L,PLT 104×109/L,余正常。肝功能:ALB 30.9 g/L,余正常。心肌酶:LDH 969 IU/L,余正常。电解质:血钙1.93 mmol/L,余正常。血脂:甘油三酯(TG)2.5 mmol/L(参考值:< 1.7 mmol/L),余正常。贫血七项:FER 1 826 ng/mL,余正常。血氨正常。左腕关节X线示骨质疏松。
病例3:女,1岁10月,因气促、纳差半年,加重伴咳嗽、发热1周于2018年2月21日入院。半年前无明显诱因出现气促,伴纳差,体重下降约2 kg,门诊多次Hb波动在65~75 g/L之间,无显著活动受限,未予特殊治疗。近1周患儿出现发热、咳嗽、气促、乏力和精神欠佳,无抽搐、无昏迷、无呕吐、无腹泻。患儿系第3胎第2产,足月顺产,出生体重3.1 kg,出生情况可。3月龄会抬头,5月龄会翻身,6月龄认人,10月龄会独坐,12月龄说话,14月龄会走。既往史无特殊。父母体健,无家族遗传病史。查体:体温38.7℃,脉搏192次/分,呼吸68次/分,血压102/70 mm Hg,身高76 cm(< -2 SD),体重9 kg(< -2 SD),神志清,精神反应差,贫血貌,口唇面色苍白,呼吸急促,三凹征(+),双肺呼吸音粗,双肺可闻及湿罗音、喘鸣音,心脏查体未见异常,腹软,肝右肋下2 cm,质软,脾左肋下3 cm,质硬。神经系统查体未见异常。双足轻度杵状趾。辅助检查:血常规示WBC 4.5×109/L,Hb 75 g/L,PLT 172×109/L,余正常。肝功能:门冬氨酸氨基转移酶(AST)129 IU/L(参考值:0~40 IU/L),ALB 28.6 g/L,余正常。心肌酶:LDH 2 244 IU/L,余正常。电解质:血钙2.11 mmol/L,余正常。血氨71.8 μmmol/L(参考值:14.0~65.0 μmmol/L)。血脂:TG 7.23 mmol/L,余正常。贫血七项:FER 7 842 ng/mL,EPO 186.87 mIU/mL,sTFR 74.31 nmol/L,余正常。乳酸正常。左腕关节X线示骨质疏松,彩超示肝、脾弥漫性增大,心脏无异常。纤维支气管镜示气管内膜炎症,取肺泡灌洗液做细胞病理,可见10%中性粒细胞,其余为组织细胞,含铁血黄素染色(-)。双肺CT示两肺纹理增多,两肺大片状模糊片絮影,双肺下叶为著,局部与相邻胸膜分界不清,双侧叶间胸膜增厚,双肺可见胸膜下线,考虑两肺弥漫性间质病变。
1.2 遗传代谢病筛查应用液相-串联质谱仪(API3200)行血氨基酸和酰基肉碱分析,尿有机酸分析在岛津气质联用仪(GP2020)上完成。
1.3 SLC7A7基因检测抽取3例患儿及父母静脉血2 mL,应用DNA抽提试剂盒(GentraPuregene Blood Kit)提取全基因组DNA。送至北京金准医学检验所,应用二代测序技术检测遗传代谢病相关基因Panel(包含947个基因)寻找致病突变。高通量测序采用IDT公司的xGen Exome研究芯片,经Illumina Hiseq 2500平台完成测序,覆盖度不低于99%。找到突变位点后,用Sanger法进行验证。
1.4 基因突变位点致病性分析根据美国医学遗传学与基因组学学会(ACMG)遗传变异分类标准与指南[6]评判基因变异致病性。
2 结果 2.1 遗传代谢病筛查例1、例3血精氨酸降低和血谷氨酰胺升高,3例尿乳清酸均升高,见表 1。
| 表 1 三例赖氨酸尿性蛋白耐受不良患儿辅助检查资料 |
|
|
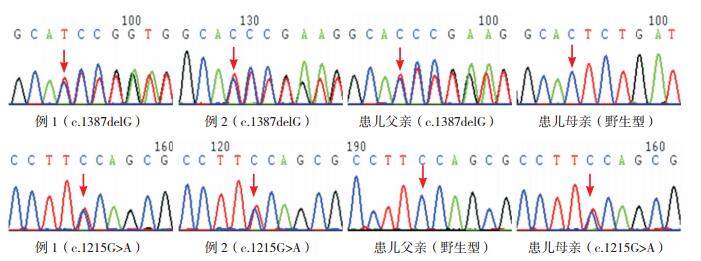
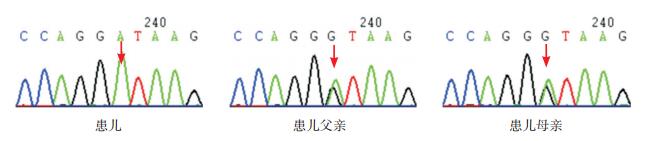
发现例1、例2在SLC7A7基因存在c.1387delG(p.V463CfsX56)和c.1215G > A(p.W405X)复合杂合突变,分别来自父母,见图 1;例3在SLC7A7基因Intron 4处存在c.625+1G > A纯合剪接突变,分别源自父母,见图 2。c.1215G > A为新发突变,检索万方、中国知网、人类基因突变数据库(HGMD)、千人基因组和dbSNP数据库,均未见SLC7A7基因c.1215G > A突变。根据ACMG指南,c.1215G > A为无义突变(PVS1),这个变异不属于多态性变化,在人群中发生频率极低(PM2),认为c.1215G > A突变为致病性突变。
|
图 1 患儿例1、例2(例1之姐)及其父母SLC7A7基因的Sanger测序图 红色箭头示碱基发生突变的位置。例1、例2 SLC7A7基因均检出c.1387delG和c.1215G>A复合杂合突变,父母分别携带c.1387delG、c.1215G>A杂合突变。 |
|
图 2 患儿例3及其父母SLC7A7基因的Sanger测序图 红色箭头示碱基发生突变的位置。例3 SLC7A7基因检出c.625+1G>A纯合突变,父母分别携带c.625+1G>A杂合突变。 |
3例患儿诊断明确后,予低蛋白饮食,补充瓜氨酸100 mg/(kg · d)、蛋白琥珀酸铁4 mg/(kg · d)、葡萄糖酸钙锌10 mL/d、维生素D 400 IU/d。例3还予醋酸泼尼松5 mg/d治疗。例1治疗6月和1年、例2治疗6月、例3治疗3月后随访,症状体征均有不同程度改善,辅助检查见表 1。3例患儿经治疗后精氨酸和乳清酸均恢复正常。例1在治疗6月后因发热咳嗽第2次入院,诊断为肺炎,肺部CT示两肺充气不均,可见散在斑点斑片状及细条片状高密度影,主动脉弓旁可见条片状致密影,边界较清,考虑两肺感染病变(实质+间质)。治疗1年后血氨稍高至81.8 μmol/L,白蛋白偏低,淀粉酶增高,胸片示肺纹理增强,但仍偶有单、双声咳嗽。三系减少明显改善。例2治疗6月后,无肺部症状体征,仅见胸片示肺纹理增强。贫血明显改善。LDH由969 IU/L升高至1 011 IU/L,TG由2.5 mmol/L升高至7.9 mmol/L。例1、例2肝脾回缩不明显但未继续增大。例3治疗3个月后血氨降至正常,LDH、FER、TG均有不同程度降低,贫血明显改善,仍有气促,需带氧生存。2018年5月21日复查肺部CT:与2018年2月23日对比,双肺下叶病变较前好转,左肺上叶及右肺中上叶病变较前增多。
3 讨论LPI是一种罕见的常染色体隐性遗传代谢病,由SLC7A7基因突变导致y+LAT1蛋白缺陷,影响小肠吸收和肾小管重吸收赖氨酸、精氨酸、鸟氨酸。y+LAT1蛋白的功能是与细胞表面4F2HC(CD98)结合,负责阳性氨基酸转运。SLC7A7基因定位于14q11.2,包含11个外显子[7]。截止至2018年4月,在HGMD专业版中检索SLC7A7基因突变,共报道67种突变,包括27种错义突变、7种无义突变、6种剪切突变、微缺失和微重复分别有10种和8种、大片段缺失9种,大多为纯合突变。
本文共发现3种突变:c.1387delG、c.1215G > A、c.625+1G > A。c.1387delG杂合突变仅日本报道一例,该突变为1 387位鸟嘌呤缺失,导致第463位缬氨酸被半胱氨酸替代后发生移码,认为c.1387delG突变与致病性相关[8]。c.625+1G > A是发生在第4内含子和第3外显子拼接区的一个剪接突变,导致第4外显子缺失,该突变影响第4跨膜结构域到第3胞外结构域功能,引起y+LAT1蛋白构象改变[3]。该位点为无义突变,会造成第405位色氨酸翻译提前终止,产生截短蛋白,从而影响蛋白功能。c.1215G > A为新发错义突变,根据ACMG指南分析为致病性突变。例2与例1为姐妹关系,例1却表现出间质性肺炎和全血细胞减少等更为严重的临床表现。因此,这两例含有相同突变的姐妹临床表型具有异质性,这与以往报道的观点一致[4, 9]。
截至2018年12月,全球共有231例患者,其中儿童患者195例,我国仅有5例报道。LPI可在任何年龄发病,婴幼儿时期,大多无明显临床症状,断乳后会出现呕吐、腹泻、喂养困难等消化系统表现,常被误诊为消化不良和食物不耐受[2]。儿童期,主要表现为生长发育落后、骨质疏松、全血细胞减少、肺间质病变等。部分患儿到成年才得到诊断,主要表现为慢性肺间质病变、肾脏病变等[5, 10]。
LPI是一种多系统受累的疾病,肺部受累是其较为常见且严重的并发症。经检索发现已报道50例肺部受累患者,男34例,女16例,年龄2.9(产前~28)岁[5, 10-17]。其中儿童患者45例,大多表现为肺间质病变,较易发展为肺泡蛋白沉积症,14例患儿死亡,均在15岁前死于肺泡蛋白沉积症、肺出血等。发病初期患者可无任何呼吸系统症状,高分辨率CT可提高无症状患者的检出率[14]。据Parto报道[15],约有1/3无呼吸系统症状患者在数年后出现肺纤维化的影像学表现,肺部并发症的严重程度与影像学没有明显相关性,肺部病变出现越早,死亡率越高。近期研究表明SLC1A7/y+LAT1有抑制炎症反应的作用,当巨噬细胞和呼吸道上皮细胞SLC1A7/y+LAT1均缺陷时,会加剧LPI患者肺部炎症反应[18]。
本文3例共性的临床表现:断乳后均有拒食高蛋白饮食,出现呕吐、腹泻和贫血,生长发育明显落后,肝脾肿大,骨质疏松,实验室检查均有多项巨噬细胞活化指标异常,如外周血细胞减少,LDH、FER、TG升高等。3例均表现为乳清酸增高,例1、例3血精氨酸降低,血鸟氨酸降低不明显,血氨正常或仅轻度增高,这些指标的改变会让医生怀疑是否有鸟氨酸氨甲酰转移酶缺乏症(OTC)。但OTC患儿更多表现为神经系统的异常,血氨升高更明显,结合患儿病史和SLC7A7基因分析可明确诊断。3例患儿肺部病变的严重程度差别很大。例3在1岁4个月左右出现明显气促、咳嗽,在1岁10个月病情加重,肺CT提示弥漫性间质性肺病,肺泡灌洗液未见异常,并未发现肺泡蛋白沉积症的表现。例1确诊半年后出现间质性肺炎,1年后胸片仅表现为肺纹理增强,患儿偶有咳嗽。例2至今未出现呼吸系统症状和体征,仅胸片示肺纹理增多。3例患儿均在进一步随访观察中。
LPI以“控氨、营养、防并发症”为一般治疗原则[2]。补充瓜氨酸可纠正细胞内精氨酸缺乏,控制血氨在正常水平,并予适当蛋白,以促生长发育。本文3例患儿予瓜氨酸、维生素D、葡萄糖酸钙锌、蛋白琥珀酸铁,低蛋白饮食,例3肺间质病变重,伴有明显咳喘,予醋酸泼尼松5 mg/d,分两次口服。3例患儿经3个月~1年治疗,贫血症状明显改善,红细胞、白细胞、血小板均有回升,肝脾回缩不明显但未继续增大。但例1偶有咳嗽,例1、例2血淀粉酶仍偏高116~168(28~100 U/L),例2血脂由2.5 mmol/L升高到7.9 mmol/L。Parenti [11]曾报道两例反复发作胰腺炎合并高血脂、淀粉酶增高的患者,腹腔镜观察到胰腺纤维化和脂肪坏死。这与我们这两例的生化特点类似,本病引起高脂和高淀粉酶的机理尚不清楚,是否高脂血症导致胰脏功能受损尚需进一步观察。例3虽然咳喘等症状稍有缓解,但仍存在低氧血症,肺部影像学表现未见改善,仍表现有明显的肺间质病变。目前,肺间质病变尚无有效、安全的治疗方案。以往报道[19],粒细胞-巨噬细胞集落刺激因子(GM-CSF)雾化可以明显改善患儿的呼吸系统症状,但GM-CSF有诱发肺纤维化的危险。Santamaria[20]报道了一例合并肺泡蛋白沉积症的患儿进行肺移植,18个月后患儿肺部症状得到缓解,然而26个月后因肺泡蛋白沉积症复发死亡。
综上,LPI是一种多系统受累的疾病,通过常规实验室检测诊断困难,确定诊断需要基因检测。目前的治疗方案并不能阻止病情进展,不会改善肺间质病变,但贫血、白细胞减少、血小板减少、骨质疏松、肝脾肿大等会得到不同程度地纠正和改善。优化并尝试新的治疗方案,是提高患儿生存质量的关键。
| [1] |
Perheentupa J, Visakorpi JK. rotein intolerance with deficient transport of basic aminoacids. Another inborn error of metabolism[J]. Lancet, 1965, 2(7417): 813-816. (  0) 0) |
| [2] |
Sebastio G, Sperandeo MP, Andria G. Lysinuric protein intolerance:reviewing concepts on a multisystem disease[J]. Am J Med Genet C Semin Med Genet, 2011, 157C(1): 54-62. (  0) 0) |
| [3] |
Sperandeo MP, Bassi MT, Riboni M, et al. Structure of the SLC7A7 gene and mutational analysis of patients affected by lysinuric protein intolerance[J]. Am J Hum Genet, 2000, 66(1): 92-99. DOI:10.1086/302700 (  0) 0) |
| [4] |
Sperandeo MP, Andria G, Sebastio G. Lysinuric protein intolerance:update and extended mutation analysis of the SLC7A7 gene[J]. Hum Mutat, 2008, 29(1): 14-21. DOI:10.1002/(ISSN)1098-1004 (  0) 0) |
| [5] |
Mauhin W, Habarou F, Gobin S, et al. Update on lysinuric protein intolerance, a multi-faceted disease retrospective cohort analysis from birth to adulthood[J]. Orphanet J Rare Dis, 2017, 12(1): 1-12. (  0) 0) |
| [6] |
Richards S, Aziz N, Bale S, et al. Standards and guidelines for the interpretation of sequence variants:a joint the interpretation of sequence variants:a joint consensus recommendation of the American College of Medical Genetics and Genomics and the Association for Molecular Pathology[J]. Genet Med, 2015, 17(5): 405-424. DOI:10.1038/gim.2015.30 (  0) 0) |
| [7] |
Torrents D, Mykkänen J, Pineda M, et al. Identification of SLC7A7, encoding y+LAT-1, as the lysinuric protein intolerance gene[J]. Nat Genet, 1999, 21(3): 293-296. DOI:10.1038/6809 (  0) 0) |
| [8] |
Shoji Y, Noguchi A, Shoji Y, et al. Five novel SLC7A7 variants and y+L gene-expression pattern in cultured lymphoblasts from Japanese patients with lysinuric protein intolerance[J]. Hum Mutat, 2002, 20(5): 375-381. DOI:10.1002/(ISSN)1098-1004 (  0) 0) |
| [9] |
Noguchi A, Nakamura K, Murayama K, et al. Clinical and genetic features of lysinuric protein intolerance in Japan[J]. Pediatr Int, 2016, 58(10): 979-983. DOI:10.1111/ped.12946 (  0) 0) |
| [10] |
DiRocco M, Garibotto G, Rossi GA, et al. Role of haematological, pulmonary and renal complications in the longterm prognosis of patients with lysinuric protein intolerance[J]. Eur J Pediatr, 1993, 152(5): 437-440. DOI:10.1007/BF01955906 (  0) 0) |
| [11] |
Parenti G, Sebastio G, Strisciuglio P, et al. Lysinuric protein intolerance characterized by bone marrow abnormalities and severe clinical course[J]. J Pediatr, 1995, 126(2): 246-251. DOI:10.1016/S0022-3476(95)70552-X (  0) 0) |
| [12] |
Parsons H, Snyder F, Bowen T, et al. Immune complex disease consistent with systemic lupus erythematosus in a patient with lysinuric protein intolerance[J]. J Inherit Metab Dis, 1996, 19(5): 627-634. DOI:10.1007/BF01799838 (  0) 0) |
| [13] |
Gürsel T, Koçak U, Tümer L, et al. Bone marrow hemophagocytosis and immunological abnormalities in a patient with lysinuric protein intolerance[J]. Acta Haematol, 1997, 98(3): 160-162. DOI:10.1159/000203612 (  0) 0) |
| [14] |
Santamaria F, Parenti G, Guidi G, et al. Early detection of lung involvement in lysinuric protein intolerance:role of highresolution computed tomography and radioisotopic methods[J]. Am J Respir Crit Care Med, 1996, 153(2): 731-735. DOI:10.1164/ajrccm.153.2.8564125 (  0) 0) |
| [15] |
Parto K, Svedström E, Majurin ML, et al. Pulmonary manifestations in lysinuric protein intolerance[J]. Chest, 1993, 104(4): 1176-1182. DOI:10.1378/chest.104.4.1176 (  0) 0) |
| [16] |
Valimahamed-Mitha S, Berteloot L, Ducoin H, et al. Lung involvement in children with lysinuric protein intolerance[J]. J Inherit Metab Dis, 2015, 38(2): 257-263. DOI:10.1007/s10545-014-9777-5 (  0) 0) |
| [17] |
Zhang G, Cao L. New mutations in the SLC7A7 gene of two chinese sisters with lysinuric protein intolerance[J]. Pediatr Pulmonol, 2017, 52(11): E94-E96. DOI:10.1002/ppul.23760 (  0) 0) |
| [18] |
Rotoli BM, Barilli A, Visigalli R, et al. Downregulation of SLC7A7 triggers an inflammatory phenotype in human macrophages and airway epithelial cells[J]. Front Immunol, 2018, 9: 508. DOI:10.3389/fimmu.2018.00508 (  0) 0) |
| [19] |
Douda DN, Farmakovski N, Dell S, et al. SP-D counteracts GM-CSF-mediated increase of granuloma formation by alveolar macrophages in lysinuric protein intolerance[J]. Orphanet J Rare Dis, 2009, 4: 29. DOI:10.1186/1750-1172-4-29 (  0) 0) |
| [20] |
Santamaria F, Brancaccio G, Parenti G, et al. Recurrent fatal pulmonary alveolar proteinosis after heart-lung transplantation in a child with lysinuric protein intolerance[J]. J Pediatr, 2004, 145(2): 268-272. DOI:10.1016/j.jpeds.2004.04.047 (  0) 0) |
 2019, Vol. 21
2019, Vol. 21


