朗格罕细胞组织细胞增生症(Langerhans cell histiocytosis, LCH)是一种少见的由骨髓源性的树突细胞单克隆性异常增殖及聚集所形成的疾病,属肿瘤样变,包括嗜酸性肉芽肿(eosinphilic granuloma)、Litterer-Siwe病和Hand-Schuller-Christian 病3种亚型[1]。LCH主要侵犯骨、皮肤、淋巴结、肝脾及血液系统等,在1~ 3岁的儿童中最常见[2],易累及头部和颈部,尤其是头骨和下颌骨[3]。LCH的临床表现复杂多样,累及口腔颌面部时易与其他口腔疾病相混淆,易造成漏诊及误诊,疼痛、活动牙齿、面部不对称、感觉障碍、颈部淋巴结肿大是常见的临床特征[4]。目前国内外对儿童伴口腔颌面部受累LCH的研究较少,大多为口腔科医生对LCH的个案报道[5-6],缺乏集中于这种疾病的口腔表现的病例总结。本研究对我院收治的12例伴口腔颌面部受累LCH患儿的临床资料进行回顾性分析,以提高临床医师对此类疾病的认识。
1 资料与方法 1.1 研究对象2012年9月至2017年9月郑州大学第一附属医院儿童血液病区收治LCH患儿103例,其中伴口腔颌面部受累的LCH患儿共12例。所有患儿均依据病理结果诊断,免疫组织化学表现为CDla、S-100和/或CD207阳性。
1.2 诊断及分组LCH的诊断与分组均参照国际组织细胞协会2002年制定的LCH-Ⅲ方案[7]。所有患儿均经临床、病理活检及免疫组化染色确诊,根据器官受累情况分为三组:(1)多器官高危组:多个器官受累伴有“危险器官”受累;(2)多器官低危组:多个器官受累不伴有“危险器官”受累;(3)单器官受累组:包括单系统多发骨损害或局限性损害。
1.3 治疗方案12例LCH患儿中,5例参照LCH-Ⅲ方案治疗[7],6例参照LCH-2009方案治疗[8],1例放弃治疗。多器官高危组疗程12个月;多器官低危组疗程12个月;单器官受累组疗程6个月。所使用的药物有长春花碱(VBL)、泼尼松(PDN)、甲氨蝶呤(MTX)和巯嘌呤(6-MP)。
1.4 疾病状态的评估患儿分别于化疗6周、25周,以及停药后1年、2年、5年进行疾病状态评估。评估结果分为4种状况:疾病治愈(症状及体征消退,无新损害出现)、疾病好转(症状、体征逐渐消退,无新损害出现)、疾病稳定(症状和体征持续存在,无新损害出现)和疾病进展(原有症状、体征进展和/或有新损害出现)[7]。
1.5 统计学分析采用SPSS 19.0软件进行统计学分析。非正态分布的计量资料用中位数(范围)表示,组间比较采用秩和检验;计数资料用百分率(%)表示,组间比较采用Fisher确切概率法。P < 0.05为差异有统计学意义。
2 结果 2.1 一般情况伴口腔颌面部受累LCH患儿共12例,占同期LCH患儿的11.7%(12/103)。男7例,女5例;发病年龄5个月至8岁,中位发病年龄1.5岁。无口腔颌面部受累LCH患儿共91例,男59例,女32例;中位发病年龄为2.1岁(2个月至13岁)。伴口腔颌面部受累LCH组的男女比例、发病年龄均略低于无口腔颌面部受累组,但差异均无统计学意义(分别χ2=0.015,P=0.904;t=1.045,P=0.299)。
12例口腔颌面部受累的LCH患儿中,10例行口腔颌面部肿物穿刺活检而确诊,1例行头部包块活检而确诊,1例行腮腺穿刺而确诊。其中多器官高危组7例,多器官低危组1例,单系统受累组4例。累及危险器官包括脾脏、肝脏、肺脏及血液系统。部分患儿还合并骨骼、淋巴结、皮肤、垂体及腮腺受累。
2.2 临床表现12例口腔颌面部受累的LCH患儿的临床资料见表 1。4例以面部肿胀起病(其中1例伴头部包块,1例伴张口受限),3例下颌骨肿块起病,其余5例分别以上颚部肿块、右侧腮腺肿大、右颊侧后牙区牙龈红肿、左侧眼球突出及尿崩症起病。
| 表 1 12例患儿的临床资料 |
|
|
面部肿物在磁共振上表现为病变在T1WI呈低或等信号,T2WI呈高信号,压脂系列呈混杂高信号,见图 1。11例(92%)合并骨内病变,其中主要发生在下颌骨(7例),且57%(4/7)的病例发生在下颌后区;另外4例发生在上颌骨(3例)或上颚骨(1例)。8例伴有多部位骨破坏,口腔外骨受累表现为颧骨5例,颅骨2例,肋骨2例,椎骨、胫骨、骶髂关节骨受累各1例。X片或CT扫描均表现为骨质溶骨性破坏、缺损。
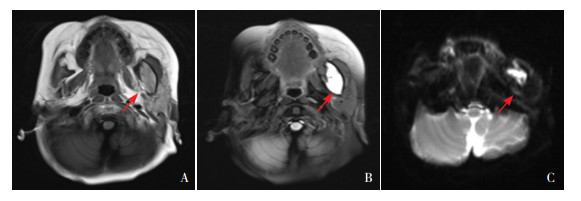
|
图 1 MRI表现 患儿男性,1岁。磁共振检查示左侧面颊部下颌骨区团块状异常信号影,在T1WI低信号改变(图A),T2WI呈高信号改变(图B),压脂系列呈混杂高信号改变(图C)。箭头所指为异常信号。 |
最常见的口腔内症状表现为牙齿、牙龈、口腔黏膜受累。病变累及牙齿导致牙槽骨不同数量的丢失,当牙槽骨严重破坏时引起牙齿松动。牙龈受累表现为牙龈炎2例,牙龈增生及萎缩各1例。7例发生在口腔软组织结构,并同时表现为口腔软组织和骨内侵犯。
4例为单系统受累,8例为多系统受累。病灶大小在0.3~4 cm之间。口腔颌面部外病变常累及内脏病变(肝脏4例、脾脏5例、肺脏1例及淋巴结2例)、血液系统(1例)、垂体(1例),以及皮肤病变(4例)。肝脏受累表现为丙氨酸氨基转移酶升高1例,低蛋白水肿1例,黄疸2例。脾脏肿大5例,肋下约2.5~6 cm,未出现脾功能亢进。血液系统受累表现为三系减少、轻度贫血。肺脏受累表现为咳嗽、咳痰,影像学表现为肺部广泛的磨玻璃影。垂体受累表现为典型的Hand-Schuller-Christian三联征(尿崩症、眼球突出、颅骨损害),并伴有生长发育落后。累及皮肤常表现为头皮、躯干及褶皱部位新旧不一的脂溢性皮疹、出血性皮疹或疱疹样皮疹,常伴色素脱失斑。
2.3 病理学特征12例口腔颌面部受累的LCH患儿的组织病理学特征见表 2。所有病例均显示为LCH的特征性组织细胞,其中CD207、S-100、CD68、LCA均阳性,见图 2;CD1a染色11例阳性,1例阴性;5例行CK染色均阴性。炎症反应不均匀,浆细胞、嗜酸性粒细胞和淋巴细胞数量差异较大。8例结缔组织致密,4例结缔组织疏松。出现坏死4例(33%),多核巨细胞5例(42%),非典型有丝分裂3例(25%),凋亡体2例(17%),见图 3。5例Ki-67指数≤20%,6例在21% ~40%之间,1例为50%。1例Epstein-Barr病毒(EBV)原位杂交为阳性,其他均为阴性。
| 表 2 12例患儿的免疫组化结果 |
|
|
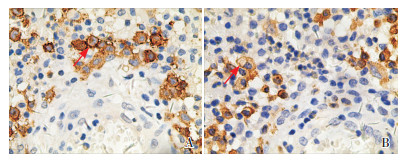
|
图 2 左颊面部肿物免疫组化表现(×400) A:可见灶状或散在分布、呈类圆形、细胞膜呈棕黄色的CD1a阳性细胞(箭头所示);B:可见灶状或散在分布、呈类圆形、细胞质呈棕黄色的CD68阳性细胞(箭头所示)。 |
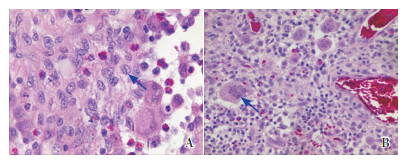
|
图 3 左下颌肿物苏木精-伊红染色 A(×400):可见较多核呈卵圆形或肾形、有不规则核切迹或核沟的朗格汉斯细胞(箭头所示);B(×200):可见坏死灶周围较多胞体较大、胞浆丰富、胞核较多的多核巨细胞(箭头所示)。 |
12例口腔颌面部受累的LCH患儿中,6例采取手术联合化疗,4例采取单纯化疗,1例孤立的下颌骨局限性病灶患儿行单纯手术切除,1例放弃治疗。于化疗6周、25周评估治疗有效(治愈+好转)率分别为91%(10/11)、82%(9/11)。随访至今,中位随访时间为28个月(12~60个月),11例患儿均处于疾病无活动状态,疾病无复发,无死亡病例, 见表 1。
无口腔颌面部受累的LCH 91例患儿中,48例行手术联合化疗,24例行单纯化疗,13例行单纯手术切除,6例放弃治疗。于化疗6周、25周评估治疗有效率分别为64%(54/85)、76%(65/85),均低于伴口腔颌面部受累LCH组患儿,但差异均无统计学意义(分别P=0.098、0.728)。随访至今,91例患儿中,好转61例,稳定11例,死亡8例(中位年龄为1.4岁),复发11例(中位复发时间为12.6个月)。
3 讨论LCH是儿童最常见的组织细胞增多症,主要侵犯骨、皮肤、下丘脑、肝、肺、骨髓、淋巴结、中枢神经系统等[9],而主要累及口腔颌面部的病例较少。该病发病年龄范围在1~3岁之间,男性多于女性[10]。在本研究中,口腔颌面部受累LCH患儿的发病中位年龄为1.5岁,其男女比例、发病年龄均略低于无口腔颌面受累组,但差异均无统计学意义。Stålemark等[11]研究显示,累及头颈颌面部的LCH患儿中,单病灶约占50%,多病灶单系统和多病灶多系统受累约占50%,而本研究多病灶多系统受累病例(8例)明显多于单系统受累病例(4例)。
LCH以骨质病变为主,对下颌骨的影响大于上颌骨及口腔软组织。颌骨病变多表现为多发穿孔性病变,73%的病例累及下颌骨,下颌后区是主要部位[12]。牙龈和口腔黏膜是受LCH影响的常见口腔软组织,如牙龈增生、炎症溃疡、萎缩或坏死。在牙槽病灶中,牙板硬膜、周围骨以及牙周组织被破坏,导致牙痛、牙齿活动过度、牙齿发育异常和过早脱落[13]。在本研究中,7例病变位于下颌骨,3例位于上颌骨,1例位于颚骨。口腔内病变亦表现为牙龈增生或溃疡、牙齿活动过度或脱落、口腔黏膜受累等。当病变累及下颌骨时,易合并口腔软组织受累,且57%(4/7)的病例发生在下颌后区,与既往研究相符[12]。LCH的皮肤受累可能是播散型疾病的早期表现[14]。本组病例中累及皮肤LCH患儿4例,均伴多病灶多系统受累。患儿常由面部肿胀、下颌骨肿块等原因来就诊,口腔颌面部病变可能是LCH的第一个表现,也可能是唯一与疾病相关的部位,应引起临床医生对该病的警惕。而某些牙源性囊肿及肿瘤、骨良恶性肿瘤、牙周病、多发性骨髓瘤及转移性疾病亦可引起面部肿胀、骨质缺失、牙髓炎症等,临床症状复杂,鉴别较困难。当牙槽骨严重破坏时,X线可表现为牙齿“浮于空中”现象,在本组病例中1例患儿出现了此现象。Neves-Silva等[6]的研究中亦有相同发现。口腔X线片可作为一个很好的检查方法。本研究中8例合并多部位骨损害,而是否进行多部位X线检查目前仍是一个具有争议性的问题,期待更广泛的研究。此外,MRI、CT对本病也有一定的诊断价值。必要时应行病灶处活检,以减少误诊及漏诊。
LCH的诊断依赖于对组织细胞的显微鉴定,本研究观察到,病变组织内炎症反应的异质性很大,T淋巴细胞(CD3)和B淋巴细胞(CD20)的比例没有差异、嗜酸性粒细胞比例不稳定、浆细胞数量少。病理组织中常见的坏死、凋亡体和非典型有丝分裂表现分别占33%、17%和25%。坏死主要发生在Ki-67增殖指数高的病例中。Ki-67增殖指数与有丝分裂计数和疾病侵袭性相关。本研究亦发现,全身性疾病患者Ki-67增殖指数多高于40%,在组织病理学分析中易表现为局部坏死。S-100、CD1a和CD207呈阳性的组织细胞常作为诊断LCH的免疫表型[15]。然而,CD1a的表达并不是LCH的特异性表达,因为它也可能在其他组织细胞增殖病中观察到,如幼黄肉芽肿、窦性组织细胞增生伴大量淋巴结病、组织细胞肉瘤等[13]。Langerin(CD207)是一种相对较新的免疫组化标记物,可作为LCH组织细胞中Birbeck颗粒存在的替代指标[16]。本研究显示,S-100、CD68、CD207、LCA在12例患儿中均呈阳性,11例CD1a阳性。CD207与CD1a对于LCH的诊断价值期待更大样本的研究。
LCH的治疗方法目前尚无统一方案,口腔颌面部受累LCH的治疗经验尤为不足,通常包括化疗、放疗、手术或联合治疗。在口腔,对于上颌孤立性骨性病灶,手术刮除是首选的治疗方法,刮除应尽可能彻底。对于手术无法切除的病灶,及合并多系统受累或危险器官受累的患儿,应考虑手术联合化疗。关于拔牙,应谨慎进行,对于严重的牙槽骨病变的患儿可考虑拔牙。无论使用LCH-Ⅲ、LCH-2009哪种方案治疗该疾病,预后均良好。伴口腔颌面部受累的LCH患儿6周、25周治疗有效率与无口腔颌面部受累组无明显差异,说明二者对于治疗的反应及效果无明显差别。
综上所述,儿童LCH累及口腔颌面部较为少见,主要表现为下颌骨单发或多发病灶,常伴有牙龈、口腔黏膜及牙齿受累。且常以面部肿胀、下颌骨肿块起病。本病易合并其他系统受累及危险器官受累,治疗以手术联合化疗为主,预后良好,不易复发。本研究缺点为样本量较少,期待大样本、多中心的研究,以进一步提高对累及口腔颌面部LCH的认识。
| [1] |
Ladisch S. Treating Langerhans cell histiocytosis globally[J]. Pediatr Blood Cancer, 2018, 65(8): e27079. DOI:10.1002/pbc.v65.8 (  0) 0) |
| [2] |
Berres ML, Merad M, Allen CE. Progress in understanding the pathogenesis of Langerhans cell histiocytosis:back to Histiocytosis X?[J]. Br J Haematol, 2015, 169(1): 3-13. DOI:10.1111/bjh.2015.169.issue-1 (  0) 0) |
| [3] |
Anastasilakis AD, Tsoli M, Kaltsas G, et al. Bone metabolism in Langerhans cell histiocytosis[J]. Endocr Connect, 2018, 7(7): R246-R253. DOI:10.1530/EC-18-0186 (  0) 0) |
| [4] |
Papadopoulou M, Panagopoulou P, Papadopoulou A, et al. The multiple faces of Langerhans cell histiocytosis in childhood:a gentle reminder[J]. Mol Clin Oncol, 2018, 8(3): 489-492. (  0) 0) |
| [5] |
Luz J, Zweifel D, Hüllner M, et al. Oral manifestation of Langerhans cell histiocytosis:a case report[J]. BMC Oral Health, 2018, 18(1): 106. DOI:10.1186/s12903-018-0568-5 (  0) 0) |
| [6] |
Neves-Silva R, Fernandes DT, Fonseca FP, et al. Oral manifestations of Langerhans cell histiocytosis:a case series[J]. Spec Care Dentist, 2018, 38(6): 426-433. DOI:10.1111/scd.2018.38.issue-6 (  0) 0) |
| [7] |
Abla O, Egeler RM, Weitzman S. Langerhans cell histiocytosis:current concepts and treatments[J]. Cancer Treat Rev, 2010, 36(4): 354-359. DOI:10.1016/j.ctrv.2010.02.012 (  0) 0) |
| [8] |
吴升华. 郎格罕细胞组织细胞增生症评估与治疗指南介绍[J]. 中华儿科杂志, 2012, 50(2): 155-158. DOI:10.3760/cma.j.issn.0578-1310.2012.02.016 (  0) 0) |
| [9] |
Erker C, Harker-Murray P, Talano JA. Usual and unusual manifestations of familial hemophagocytic lymphohistiocytosis and Langerhans cell histiocytosis[J]. Pediatr Clin North Am, 2017, 64(1): 91-109. DOI:10.1016/j.pcl.2016.08.006 (  0) 0) |
| [10] |
Saliba I, Sidani K, El Fata F, et al. Langerhans' cell histiocytosis of the temporal bone in children[J]. Int J Pediatr Otorhinolaryngol, 2008, 72(6): 775-786. DOI:10.1016/j.ijporl.2008.02.001 (  0) 0) |
| [11] |
Stålemark H, Laurencikas E, Karis J, et al. Incidence of Langerhans cell histiocytosis in children:a population-based study[J]. Pediatr Blood Cancer, 2008, 51(1): 76-81. DOI:10.1002/(ISSN)1545-5017 (  0) 0) |
| [12] |
Bedran NR, Carlos R, de Andrade BAB, et al. Clinicopathological and immunohistochemical study of head and neck Langerhans cell histiocytosis from Latin America[J]. Head Neck Pathol, 2018, 12(4): 431-439. DOI:10.1007/s12105-017-0867-1 (  0) 0) |
| [13] |
Halperson E, Weintraub M. Oral Langerhans cell histiocytosis in an infant[J]. J Dent Child (Chic), 2018, 85(2): 75-78. (  0) 0) |
| [14] |
Merglová V, Hrusák D, Boudová L, et al. Langerhans cell histiocytosis in childhood-review, symptoms in the oral cavity, differential diagnosis and report of two cases[J]. J Craniomaxillofac Surg, 2014, 42(2): 93-100. DOI:10.1016/j.jcms.2013.03.005 (  0) 0) |
| [15] |
Carrera Silva EA, Nowak W, Tessone L, et al. CD207+CD1a+ cells circulate in pediatric patients with active Langerhans cell histiocytosis[J]. Blood, 2017, 130(17): 1898-1902. DOI:10.1182/blood-2017-05-782730 (  0) 0) |
| [16] |
Lau SK, Chu PG, Weiss LM, et al. Immunohistochemical expression of Langerin in Langerhans cell histiocytosis and non-Langerhans cell histiocytic disorders[J]. Am J Surg Pathol, 2008, 32(4): 615-619. DOI:10.1097/PAS.0b013e31815b212b (  0) 0) |
 2019, Vol. 21
2019, Vol. 21

