2. 首都儿科研究所附属儿童医院放射科, 北京 100020;
3. 首都儿科研究所附属儿童医院普通外科, 北京 100020;
4. 首都儿科研究所附属儿童医院病理科, 北京 100020
Mowat-Wilson综合征(Mowat-Wilson syndrome, MWS, MIM: 235730)是由Mowat等[1]于1998年首次报道的一种常染色体显性遗传病,其发病率为1/50 000~1/70 000[2]。迄今为止,全世界已报道300多例MWS患儿[3],临床表现多样,主要为智力障碍/全面发育迟缓、癫痫、特殊面容(小头畸形、前额突出、眼眶深陷、眼距增宽、眉头增粗断裂、耳垂隆起、圆形鼻尖、鼻小柱突出、宽鼻梁、鹰钩鼻、小下颌等)、先天性巨结肠(Hirschsprung disease, HSCR)及其他先天畸形(胼胝体发育不全、先天性心脏病、泌尿生殖系统异常及眼睛异常等)。MWS的致病基因是E盒结合锌指蛋白2(zinc finger E box-binding homeobox 2, ZEB2)基因,定位于2q22.3 [4-5]。MWS患儿面容异常在新生儿时期往往不明显,典型面容随年龄增长逐步显现,这也是MWS患儿早期诊断困难的原因之一。本文分析3例诊断为MWS患儿的临床资料,总结其临床及基因突变特点,分析该病的诊疗经验,以期提高儿科医生对MWS的认识。
1 资料与方法 1.1 研究对象病例1:患儿女,17 d,因出生后腹胀便秘17 d来我院就诊。患儿生后即出现胎便排出延迟,伴明显腹胀,于外院行下消化道造影示HSCR。患儿系第1胎第1产,足月剖宫产,孕期定期产检无异常,出生史无特殊。父母均体健,否认近亲结婚,否认家族遗传病史,否认HSCR或其他先天畸形家族史。入院体查:T 37.5℃,R 52次/分,P 175次/分,精神反应可,追光追物灵敏,竖头不稳,咽反射存在,颈软。心率175次/分,律齐,心前区可闻及3/6级收缩期杂音,未闻及心包摩擦音。腹部明显膨隆,腹壁张力高,可见明显肠型;压痛不明显,未及包块,叩诊鼓音,肠鸣音亢进;肛门位置外形正常,肛诊小指可以进入,有明显裹指感,可触及狭窄环,拔出后排出少量气体。双侧Babinski征(+),拥抱反射、吸吮反射、握持反射正常引出。辅助检查:18 d时立位腹部X线可见肠腔内大量积气影,肠管略扩张,多发气液平面。27 d时心脏彩超示先天性心脏病(肺动脉瓣狭窄、房间隔缺损、室间隔缺损、动脉导管未闭)。患儿于4 m 10 d时死于重症心衰和肺炎。后作为HSCR相关基因筛查大样本之一行HSCR相关基因筛查。
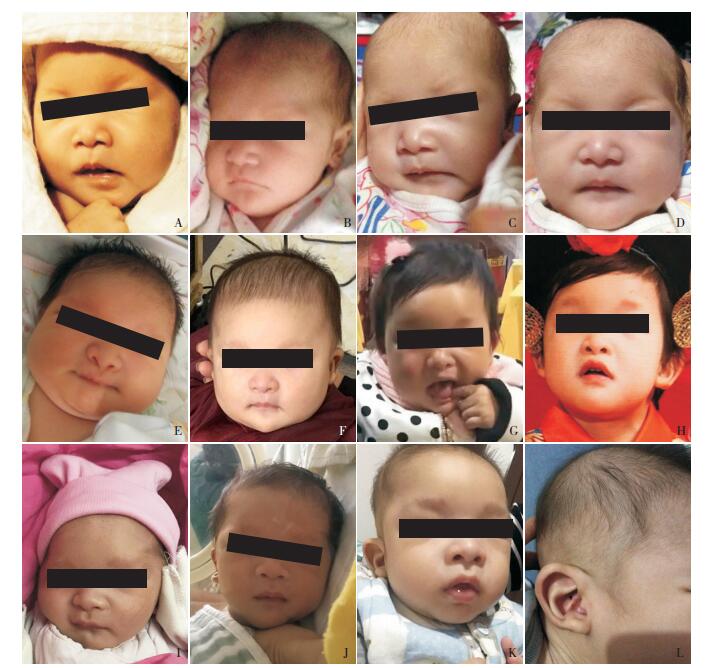
病例2:患儿女,6月龄,因HSCR术后3月,全面发育迟缓1月第二次就诊于我院。患儿生后胎便排出延迟,1月龄时因腹胀、呕吐在外院诊治,床旁心脏超声示动脉导管未闭、卵圆孔未闭、三尖瓣返流(具体不详)。3月龄时因出生后排便困难3月第一次就诊于我院普外科,行下消化道造影示HSCR,心脏超声无异常,予巨结肠根治术,术中行乙状结肠冰冻切片普通苏木精-伊红(HE)染色,未见神经节细胞。既往有2次热性惊厥史。患儿系第1胎第1产,足月剖宫产,孕期定期产检无异常,3月龄抬头,5月龄翻身。父母均体健,否认近亲结婚,否认家族遗传病史。入院体查:T 37.6℃,R 36次/分,P 120次/分,反应迟钝,追光追物差,不易逗笑,不可独坐。眼距宽、眼眶深陷、低鼻梁、鹰钩鼻、小下颌、眉头增粗断裂(图 1E~H),心肺检查无异常,腹软,于脐部和左右脐旁锁骨中线处各见1处腹腔镜打孔手术瘢痕,每处约0.5 cm。辅助检查:6月龄时颅脑MRI示胼胝体发育不良、白质髓鞘化延迟,侧脑室旁白质容积减少。结合其临床表现、面部特征及MRI结果高度怀疑MWS,为明确诊断拟进行HSCR相关基因筛查。
|
图 1 3例Mowat-Wilson综合征患儿的特殊面容对比 A~D:为病例1面部照片,图A、C示宽鼻梁、鹰钩鼻、眼距增宽,图B示耳垂异常,图D示鼻小柱突出、小下颌;E~H:分别为病例2生后1 d、1月、1岁及2岁时的面部照片,图E、F示眼距增宽、鹰钩鼻、宽鼻梁、小下颌,图G、H示眼眶深陷、前额突出、耳垂隆起、鼻梁塌陷、眉头增粗断裂,图E~H可观察到患儿随年龄增长其前额突出、眼眶深陷更加明显,眉头断裂增粗亦初步显现;I~L:分别为病例3生后1 d、1月、6月龄正面、6月龄侧面的照片,图I、J示眼距增宽、宽鼻梁、小下颌,图K示前额突出、眼眶深陷、鹰钩鼻、小下颌,图L示耳垂隆起,图I~L可观察到患儿随年龄增长其前额突出、眼眶深陷、耳垂隆起逐渐明显。 |
病例3:患儿男,3月19 d,因出生后排便困难3月余首次就诊于我院。患儿生后24 h内胎便少量排出,生后3 d胎便仍未排净,于当地医院行腹部X线示低位肠梗阻,行结肠灌洗治疗。患儿出院后10 d出现喷射样呕吐,1月25 d时心脏超声示先天性心脏病(卵圆孔未闭),腹部超声示幽门肌肥厚,于当地医院行腹腔镜下幽门肌切开术,术后呕吐缓解,腹胀仍明显,继续结肠灌洗保守治疗。1月前患儿再次出现纳差,于外院行肛门黏膜活检,可见个别神经节细胞;下消化道造影示直肠狭窄、乙状结肠扩张明显。患儿系第2胎第2产,足月顺产,孕期定期产检无异常,现抬头不稳,不会翻身。父母否认近亲结婚;患儿父亲、姑姑及患儿均存在染色体核型异常,患儿及父亲为45, XY, t(14;21),患儿姑姑为45, XX, t(14;21);母亲体健,有一哥哥,现6岁,体健。入院体查:T 36.5℃,R 20次/分,P 100次/分,反应迟钝,不能追光追物,抬头不稳,不易逗笑。眼距宽、低鼻梁、小下颌、耳垂隆起(图 1 I~L),尿道下裂,心肺检查无异常,腹胀明显,未触及包块,叩诊鼓音,肠鸣音亢进,肛诊小指可进入,有明显裹指感,可触及狭窄环,拔出后无喷射性排气排便。辅助检查:3月22 d时腹部超声示左侧肾盂积水;3月22 d时心脏超声无异常;3月28 d时听力筛查示左耳听力筛查未通过。患儿初诊时因面容异常合并多发先天畸形(先天性心脏病、尿道下裂、幽门狭窄、听力异常),高度怀疑MWS,为明确诊断拟进行HSCR相关基因筛查。
1.2 进一步检查本研究通过首都儿科研究所伦理委员会的批准(伦理审查编号:SHERLL2013039),经患儿监护人签署知情同意书后取患儿及其父母(病例1、2)、兄弟(病例3)外周血各5 mL,提取基因组DNA。使用Nanodrop 1000分光光度计进行质检,质检合格后送至北京迈基诺基因科技股份有限公司,针对172个HSCR及其综合征相关基因的外显子和侧翼序列进行高通量测序。利用Illumina NextSeq 500第二代测序仪进行测序。本实验中样品基因的平均测序深度约为96×,捕获区覆盖度达90%以上,为找出致病性点突变,参考dbSNP数据库(https://www.ncbi.nlm.nih.gov/snp)、HapMap数据库(ftp://ftp.ncbi.nlm.nih.gov/hapmap)、千人基因组数据库(http://www.internationalgenome.org/home)及ESP数据库(http://evs.gs.washington.edu/EVS)和内部正常对照人群数据库,将频率小于0.05的变异视为可疑,并进一步行Sanger测序验证。
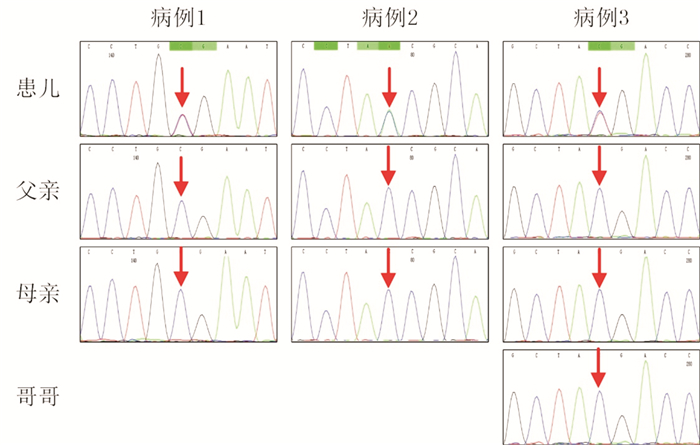
2 结果 2.1 ZEB2基因检测结果测序结果发现:3例患儿均携带ZEB2基因杂合无义突变,其中病例2携带c.756C > A(p.Y252X)变异,查询万方、知网、维普、ClinVar(https://www.ncbi.nlm.nih.gov/clinvar)、PubMed及HGMD(http://www.hgmd.cf.ac.uk/ac/index.php)数据库后发现该变异国内外均未见报道,为新发变异。进一步查询dbSNP、HapMap、千人基因组及ESP数据库,未发现相同位点变异,根据美国医学遗传学与基因组学学会(ACMG)指南[6]本变异可判定为致病性突变。病例1和病例3患儿分别携带已知致病性ZEB2基因突变:c.904C > T(p.R302X)[7]和c.2761C > T(p.R921X)[8]。3例患儿均为ZEB2基因新生突变,在父母中未发现相应突变,病例3的哥哥也无相应突变(图 2)。
|
图 2 3例患儿及其家庭成员ZEB2基因突变位点测序图 例1患儿ZEB2基因检出c.904C > T新生突变,突变位点如箭头所示,患儿父母该位点均正常;例2患儿ZEB2基因检出c.756C > A新生突变,突变位点如箭头所示,患儿父母该位点均正常;例3患儿ZEB2基因检出c.2761C > T新生突变,突变位点如箭头所示,患儿父母及其哥哥该位点均正常。 |
病例1患儿确诊HSCR后于23 d行经肛门直肠及乙状结肠切除术治疗。患儿于死亡后筛查出ZEB2基因突变,追溯患儿面部照片及相关信息,发现其存在轻度面部异常:小头畸形(1 d,头围31 cm,< -2 SD),宽鼻梁,鹰钩鼻,小下颌和耳垂隆起(图 1 A~D )。因其年龄小,家长未能发现其全面发育迟缓。根据基因检测结果及患儿临床表现确诊为MWS。病例2、3患儿经基因检测发现ZEB2基因突变,结合患儿临床表现、辅助检查结果及与MWS高度符合的特殊面容,确诊为MWS。
MWS无特异性治疗方法。病例2确诊后接受当地医院及家庭联合康复治疗,疗效欠佳。随访至患儿2岁11月龄,身高85 cm(< -3 SD),体重10.5 kg(< -2 SD),可独坐,但不会独站,不会爬。病例3确诊后患儿家长放弃主动治疗,随访至6月龄,曾数次出现意识清楚的局灶性运动性癫痫发作,身高62.5 cm(< -2 SD),体重5.2 kg(< -3 SD),头围39.2 cm(< -3 SD),不会翻身,不会爬,不会独坐。
3 讨论MWS目前国际上尚无具体诊断标准,导致临床诊断困难。本病临床表现多样,遗传异质性高,且与多种综合征存在表型交叉,合并多种先天异常(如HSCR、先天性心脏病、肺动脉吊索、先天性肾脏畸形、生殖器畸形、小头畸形、尿道下裂、隐睾、幽门狭窄、眼睛结构异常及腭裂等)。患儿的独特面容是识别本病最可靠的临床特征之一。既往文献报道的300多例患儿均有不同程度的特殊面容,最常见的是小头畸形(77.7%)[3],其余有前额突出、眼眶深陷、眼距增宽、耳垂隆起、圆形鼻尖、鼻小柱突出、宽鼻梁、鹰钩鼻、小下颌、眉毛增粗断裂。多数MWS患儿的特殊面容在新生儿时期并不明显,其面部特征会随年龄增加逐渐变化得以凸显[9]。MWS患儿均表现为智力障碍/全面发育迟缓,轻重不一[3]。96%的MWS患儿颅脑MRI可发现异常,以胼胝体发育不全最为常见(79.6%),其他常见异常包括海马异常(77.8%)、侧脑室扩大(68.5%)和白质异常(厚度减少40.7%,局部信号改变22.2%),另外脑室颞角增大、皮质畸形、后颅窝畸形、基底神经节变大及脑肿瘤等也可见于MWS患儿[10]。本文3例MWS患儿均有明显的面容异常及HSCR。病例2曾出现2次热性惊厥,病例3近期开始出现癫痫发作,表现为意识清楚的局灶性运动性发作,与既往文献报道一致[3],患儿排除了感染性、炎症免疫性、代谢性等因素的参与,结合先天性巨结肠、全面发育迟缓、特殊面容的特点,故高度怀疑遗传学因素致病的可能。MWS患儿面部特征婴幼儿期即存在,且随年龄增加逐步显现,故需临床首诊医生在进行体格检查时细致观察。综上,全面发育迟缓、小头畸形等表现在MWS患儿尤其是新生儿期常不明显,但MRI多可见胼胝体发育异常,故MRI检测异常与其他先天畸形合并存在时可为临床医生提供一定诊断思路。
MWS的发生是由ZEB2基因突变所致。ZEB2基因又被称为Smad交互蛋白1(Smad interacting protein 1, SIP1)或锌指同源框基因1B(zinc finger homeobox gene 1b, ZFHX1B),是一种神经系统发育过程中多功能调节因子[11-12],其编码蛋白的表达贯穿于神经元及神经胶质细胞的整个生长发育过程,调节神经系统发育[13]。ZEB2基因的杂合突变在动物模型及人类疾病中均表现出明显的神经系统异常。目前已报道的典型MWS患儿主要由于ZEB2基因的大片段缺失、移码突变或无义突变导致。已报道的无义突变大部分位于外显子8和外显子3上。MWS患儿的ZEB2基因突变约80%为点突变,但亦有20%为ZEB2基因大片段缺失或重排[14]。在既往报道的无义突变中有4个曾反复出现,分别是:c.2083C > T(p.R695X)、c.2761C > T(p.R921X)、c.1027C > T(p.R343X)以及c.904C > T(p.R302X)[15],但患者的临床表型不尽相同,提示该病遗传异质性较大。此外,ZEB2基因的错义突变[16]或重复[17-18]导致MWS者亦偶有报道。
由于目前我们对MWS仍知之甚少,孕期又缺乏特定产前标志物,导致大部分MWS患儿都是在出生后才被确诊。Wilson等[19]回顾了2例确诊MWS患儿的母亲孕期检查结果,发现除超声提示颈项透明层厚度(NT)增加外,其余均未有明显异常。迄今为止,只有3例患儿在产前被诊断为MWS [20],可见这一工作仍面临严峻挑战。本文报道的3例患儿均以HSCR作为首诊症状,但既往文献报道所有MWS患儿中的HSCR发生率只有48.8%[3],因此我们推断,由于对疾病的认识不足,中国尚有部分MWS患儿可能未被确诊或误诊为其他综合征。临床医生需提高对此病的认识,结合基因检测,做到早期诊断。
| [1] |
Mowat DR, Croaker GD, Cass DT, et al. Hirschsprung disease, microcephaly, mental retardation, and characteristic facial features:delineation of a new syndrome and identification of a locus at chromosome 2q22-q23[J]. J Med Genet, 1998, 35(8): 617-623. DOI:10.1136/jmg.35.8.617 (  0) 0) |
| [2] |
Ghoumid J, Drevillon L, Alavi-Naini SM, et al. ZEB2 zinc-finger missense mutations lead to hypomorphic alleles and a mild Mowat-Wilson syndrome[J]. Hum Mol Genet, 2013, 22(13): 2652-2661. DOI:10.1093/hmg/ddt114 (  0) 0) |
| [3] |
Ivanovski I, Djuric O, Caraffi SG, et al. Phenotype and genotype of 87 patients with Mowat-Wilson syndrome and recommendations for care[J]. Genet Med, 2018, 20(9): 965-975. DOI:10.1038/gim.2017.221 (  0) 0) |
| [4] |
Cacheux V, Dastot-Le Moal F, Kääriäinen H, et al. Loss-of-function mutations in SIP1 Smad interacting protein 1 result in a syndromic Hirschsprung disease[J]. Hum Mol Genet, 2001, 10(14): 1503-1510. DOI:10.1093/hmg/10.14.1503 (  0) 0) |
| [5] |
Wakamatsu N, Yamada Y, Yamada K, et al. Mutations in SIP1, encoding Smad interacting protein-1, cause a form of Hirschsprung disease[J]. Nat Genet, 2001, 27(4): 369-370. (  0) 0) |
| [6] |
Richards S, Aziz N, Bale S, et al. Standards and guidelines for the interpretation of sequence variants:a joint consensus recommendation of the American College of Medical Genetics and Genomics and the Association for Molecular Pathology[J]. Genet Med, 2015, 17(5): 405-424. DOI:10.1038/gim.2015.30 (  0) 0) |
| [7] |
Ishihara N, Yamada K, Yamada Y, et al. Clinical and molecular analysis of Mowat-Wilson syndrome associated with ZFHX1B mutations and deletions at 2q22-q24[J]. J Med Genet, 2004, 41(5): 387-393. DOI:10.1136/jmg.2003.016154 (  0) 0) |
| [8] |
Zweier C, Thiel CT, Dufke A, et al. Clinical and mutational spectrum of Mowat-Wilson syndrome[J]. Eur J Med Genet, 2005, 48(2): 97-111. (  0) 0) |
| [9] |
Garavelli L, Zollino M, Mainardi PC, et al. Mowat-Wilson syndrome:facial phenotype changing with age:study of 19 Italian patients and review of the literature[J]. Am J Med Genet A, 2009, 149A(3): 417-426. (  0) 0) |
| [10] |
Garavelli L, Ivanovski I, Caraffi SG, et al. Neuroimaging findings in Mowat-Wilson syndrome:a study of 54 patients[J]. Genet Med, 2017, 19(6): 691-700. DOI:10.1038/gim.2016.176 (  0) 0) |
| [11] |
Hegarty SV, Sullivan AM, O'Keeffe GW. Zeb2:a multifunctional regulator of nervous system development[J]. Prog Neurobiol, 2015, 132: 81-95. DOI:10.1016/j.pneurobio.2015.07.001 (  0) 0) |
| [12] |
Bar Yaacov R, Eshel R, Farhi E, et al. Functional characterization of the ZEB2 regulatory landscape[J]. Hum Mol Genet, 2019, 28(9): 1487-1497. (  0) 0) |
| [13] |
He L, Yu K, Lu F, et al. Transcriptional regulator ZEB2 is essential for bergmann glia development[J]. J Neurosci, 2018, 38(6): 1575-1587. DOI:10.1523/JNEUROSCI.2674-17.2018 (  0) 0) |
| [14] |
Garavelli L, Mainardi PC. Mowat-Wilson syndrome[J]. Orphanet J Rare Dis, 2007, 2: 42. DOI:10.1186/1750-1172-2-42 (  0) 0) |
| [15] |
Jiang Q, Zhang T, Wang S, et al. Mowat-Wilson syndrome:clinical and molecular report of the first case in mainland China[J]. Int J Clin Exp Pathol, 2016, 9(2): 1195-1203. (  0) 0) |
| [16] |
Heinritz W, Zweier C, Froster UG, et al. A missense mutation in the ZFHX1B gene associated with an atypical Mowat-Wilson syndrome phenotype[J]. Am J Med Genet A, 2006, 140(11): 1223-1227. (  0) 0) |
| [17] |
Yuan H, Zhang L, Chen M, et al. A de novo triplication on 2q22.3 including the entire ZEB2 gene associated with global developmental delay, multiple congenital anomalies and behavioral abnormalities[J]. Mol cytogenet, 2015, 8: 99. DOI:10.1186/s13039-015-0206-8 (  0) 0) |
| [18] |
Baxter AL, Vivian JL, Hagelstrom RT, et al. A novel partial duplication of ZEB2 and review of ZEB2 involvement in Mowat-Wilson syndrome[J]. Mol syndromol, 2017, 8(4): 211-218. DOI:10.1159/000473693 (  0) 0) |
| [19] |
Wilson M, Mowat D, Dastot-Le Moal F, et al. Further delineation of the phenotype associated with heterozygous mutations in ZFHX1B[J]. Am J Med Genet A, 2003, 119A(3): 257-265. DOI:10.1002/ajmg.a.20053 (  0) 0) |
| [20] |
Spaggiari E, Baumann C, Alison M, et al. Mowat-Wilson syndrome in a fetus with antenatal diagnosis of short corpus callosum:advocacy for standard autopsy[J]. Eur J Med Genet, 2013, 56(6): 297-300. DOI:10.1016/j.ejmg.2013.03.003 (  0) 0) |
 2019, Vol. 21
2019, Vol. 21


