Cornelia De Lange综合征(CdLS)是一种伴有严重认知障碍的遗传性疾病,主要表现有严重的宫内和生后生长迟缓、认知障碍、具有特征性的特殊面容和上肢缺陷[1-2]。目前已发现CdLS有常染色体显性和X-连锁两种遗传方式。Tonkin等[3]研究人员发现Nipped-B相似基因(Nipped-B-like, NIPBL)突变可导致常染色体显性遗传CdLS。Kawauchi等[4]于2009年利用NIPBL+/-小鼠模型来研究CdLS,观察小鼠肢体、颅面畸形和心脏解剖异常等特征,后续关于CdLS的研究报道多选用此模型,故本研究选取NIPBL+/-小鼠模型来研究CdLS。目前多认为NIPBL基因突变引起的CdLS是由于基因表达调节的异常造成的。有研究表明,NIPBL基因水平的高低与CdLS的严重程度密切相关。NIPBL基因对音刺猬(sonic hedgehog, Shh)基因进行调控,NIPBL基因的缺失,导致Shh基因表达的信号通路受到抑制,引起胚胎极化活性区染色体位点异常,从而导致CdLS的发生[5]。同时有大量研究证明在Wnt/PCP通路,Wnt5a与受体酪氨酸激酶孤独受体(ROR)蛋白结合调节肢体形态、软骨和成骨形成[6-7]。在Wnt5a转基因小鼠胚胎肺组织发育的早期上皮中Wnt5a的过渡表达导致上皮细胞中Shh基因的表达下降,提示Wnt5a可能是Shh的目标基因[8]。对于NIPBL基因的缺失是否可以影响Wnt5a基因转录,及其与Shh基因之间的具体机制鲜有报道,本课题组推测NIPBL基因突变可能对Shh、Wnt5a基因的表达,以及Wnt信号通路中关键因子功能的变化产生影响,从而改变了成骨细胞的分化及趋化方向,最终导致长骨发育畸形。故本研究以NIPBL+/-小鼠胚胎肢芽组织为研究对象,揭示Wnt信号通路中相关信号因子在CdLS综合征发病中的作用,从而为探对CdLS综合征的发病机制提供理论依据。
1 材料与方法 1.1 试剂与仪器TRIzol Reagent总RNA提取试剂购于美国Life公司,PrimeScript RT reagent Kit逆转录试剂盒、RevertAid First Strand cDNA Synthesis Kit逆转录试剂盒、SYBR Green PCR Kit荧光定量试剂盒购于美国Thermo公司。逆转录聚合酶链反应(RT-PCR)仪器购于日本TaKaRa公司,实时荧光定量聚合酶链反应(qRT-PCR)仪器购于美国Life公司。兔源Anti-Wnt5a多克隆抗体及兔源Anti-Shh多克隆抗体均购于英国Abcam公司,小鼠源β-actin单克隆抗体、辣根过氧化物酶标记的山羊抗小鼠二抗及山羊抗兔二抗均购于武汉博士德生物工程有限公司。
1.2 动物分组SPF级57BL/6J小鼠(NIPBL-Loxp小鼠与Cre小鼠构建的NIPBL+/-模型小鼠)购于浙江大学动物实验中心,饲养于平均温度25℃,湿度40%左右环境中。实验过程经石河子大学医学院第一附属医院实验动物伦理委员会审批。挑选NIPBL+/-雄性小鼠(体重35 g左右),雌性小鼠(体重30 g左右),晚上20 : 00将雌雄小鼠按2 : 1合笼,次日早晨8 : 00检查雌鼠的阴栓,阴栓阳性者将次日12 : 00作为妊娠0.5 d(E0.5 d)。分别于E10 d、E11 d、E12 d取胎鼠进行实验验证。实验组:利用RT-PCR逆转录试剂盒分别于上述3个时间点各鉴定得到12只NIPBL+/-胎鼠的肢芽;对照组:利用RT-PCR逆转录试剂盒分别于上述3个时间点各鉴定得到12只NIPBL+/+胎鼠的肢芽。取胎鼠肢芽放入液氮15~20 min后再放入-80℃冰箱保存,以备后期实验。
1.3 采用qRT-PCR检测Shh及Wnt5a mRNA水平按照TRIzol试剂盒说明书提取小鼠肢芽总RNA,使用逆转录试剂盒合成单链cDNA。Shh、Wnt5a基因及内参基因β-actin引物由生工生物工程(上海)有限公司设计与合成,引物序列见表 1。PCR反应体系(20 μL):cDNA(10倍稀释)4 μL,上下游引物(10 μmol/L)各0.4 μL,SYBR Green Master Mix 10 μL,50×ROX Reference Dye2 0.4 μL,ddH2O 4.8 μL。反应条件:50℃ 2 min,95℃ 10 min;95℃ 30 s,60℃ 30 s,40个循环。绘制溶解曲线,最终数据以2-△△Ct表示并进行分析。
| 表 1 Shh、Wnt5a及β-actin引物信息 |
|
|
将冻存于-80℃冰箱中的肢芽组织碾碎裂解,4℃下12 000 r/min离心5 min,取上清分装于0.5 mL离心管中并置于-20℃保存。BCA法测蛋白浓度。取蛋白样品行电泳、转膜,用含5%脱脂奶粉的TBST(封闭液)浸泡PVDF膜,室温摇床封闭2 h,分别加入β-actin(1 : 400)、Anti-Wnt5a(1 : 500)和Anti-Shh(1 : 1 000)一抗,4℃孵育过夜,TBST洗膜5次。加入辣根过氧化物酶标记二抗(1 : 50 000),37℃摇床孵育2 h,TBST洗膜5次。ECL显色,处理胶片后扫描,用BandScan软件分析胶片灰度值,结果以目的蛋白与内参蛋白β-actin灰度值的比值表示蛋白相对表达量。
1.5 统计学分析采用SPSS 13.0统计软件对数据进行统计学分析,呈正态分布计量资料用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,两组间比较采用t检验。P < 0.05为差异有统计学意义。
2 结果 2.1 qRT-PCR检测Wnt5a、Shh mRNA水平对照组的Wnt5a、Shh mRNA水平在各个时间点均高于实验组(P < 0.05)。对照组及实验组Wnt5a、Shh mRNA水平在不同时间点比较差异均有统计学意义(P < 0.05);两组Wnt5a及Shh mRNA水平均在E11 d时表达最高,E12 d时表达均下降,且均低于E10 d时水平(P < 0.05),见表 2。
| 表 2 Wnt5a及Shh mRNA在两组小鼠肢芽表达水平比较 (x±s) |
|
|
对照组的Wnt5a及Shh蛋白水平在各个时间点均高于实验组(P < 0.05)。对照组及实验组Wnt5a、Shh蛋白水平在不同时间点比较差异均有统计学意义(P < 0.05);两组Wnt5a及Shh蛋白水平均在E11 d时表达最高,E12 d时表达均下降,且均低于E10 d时水平(P < 0.05),见表 3,图 1~2。
| 表 3 Wnt5a及Shh蛋白在两组小鼠肢芽表达水平比较 (x±s) |
|
|
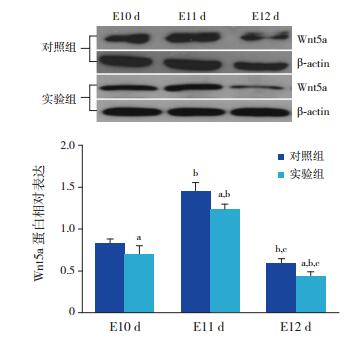
|
图 1 Wnt5a蛋白在两组小鼠肢芽的表达变化 上图为电泳条带图;下图为统计图(n=12),a示与对照组比较,P < 0.05;b示与同组E10 d时比较,P < 0.05;c示与同组E11 d时比较,P < 0.05。 |
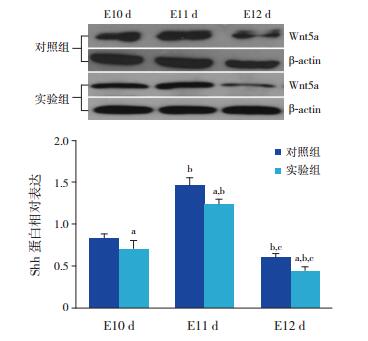
|
图 2 Shh蛋白在两组小鼠肢芽的表达变化 上图为电泳条带图;下图为统计图(n=12)a示与对照组比较,P < 0.05;b示与同组E10 d时比较,P < 0.05;c示与同组E11 d时比较,P < 0.05。 |
CdLS是一种伴有严重认知障碍的遗传性疾病,主要表现有严重的宫内和出生后生长迟缓、认知障碍、具有特征性的特殊面容和上肢缺陷[9-10]。目前已发现CdLS有常染色体显性和X-连锁两种遗传方式。新生儿期发病率为1/30 000~1/100 000。
NIPBL基因突变可导致常染色体显性遗传CdLS,少部分X-连锁患者由染色体结构维持蛋白1a(Smc1a)、Smc3等Cohesin复合物亚基的基因突变引起[11]。NIPBL基因在各个组织均有表达,人和老鼠胚胎期NIPBL基因表达非常广泛,尤其在前肢、鳃弓和颅面间质,这与其出生后主要畸形高度一致[12],其中胎鼠在E9.5 d时,相关部位就开始表达NIPBL [13]。然而,NIPBL调节Cohesin复合物在DNA上的附着和脱落,黏连蛋白复合物通过与多种因子相互作用调节DNA环形成和基因表达作用,包括促进或抑制基因的表达[14-15]。Kawauchi等[4]于2009年报道建立NIPBL+/-小鼠模型,主要观察了小鼠肢体和颅面畸形的特征。因此,目前认为NIPBL基因突变引起的CdLS是由于基因表达调节的异常造成的。前期实验发现NIPBL+/-小鼠胚胎在出生前即被检测到身长变短(E17.5 d~E18.5 d),要比野生型同胞小鼠胚胎缩短18%~19%,而这种发育滞后并不伴随胎盘尺寸的缩小;在早期的NIPBL+/-小鼠胚胎也比野生型同胞小鼠胚胎身长缩短;但NIPBL+/-小鼠胚胎并未表现出肢体或者指(趾)截断,或者其他骨组成的缺失。通过对E17.5 d时期的长骨及指骨测量,除了骨长度的短小,身长缩短,还会出现一定程度的骨化延迟。在NIPBL基因剔除小鼠胚胎的肢芽内软骨细胞区域受到明显破坏,这均提示NIPBL缺失是导致四肢骨发育落后,肢体发育异常的关键因素。
Shh在诱导早期软骨细胞分化中起着至关重要的作用[16]。在胚胎的底板和脊索及肢芽内Shh均有表达[17-18],并被认为通过诱导下游介质表达而控制骨骼的形态,这些介质包括骨形态发生蛋白(BMPs)和成纤维细胞生长因子(FGFs)[19]。在BMPs和FGFs的作用下,极化活动区的间充质干细胞向骨形成方向发育和分化。有研究报道,Shh基因通常在正常胎鼠肢芽的E9.5 d~E11.5 d进行表达,且在孕鼠的E10 d左右表达量逐渐增多,在E11 d大量表达,在E12 d左右表达量逐渐减少[20]。前期实验发现模型胎鼠E9.5 d时是个椭球形,难以分辨出器官,相关目的基因难以检测出;在胚胎E12.5 d时,肢芽中同样检测不到目的基因的表达。
Wnt家族是一个高度保守的基因,主要功能包括调节基因的表达、细胞黏附、细胞极性[21]。Wnt信号途径分为两个主要部分:经典途径和非经典途径。在Wnt/PCP通路,Wnt5a与ROR蛋白结合调节肢体形态,以及软骨和成骨的形成[22-23]。此外,Wnt/PCP信号通路也可调节破骨形成[24]。Wnt5a-ROR2信号能够激活位于编码排序基因RANK启动子上的核因子κB受体活化因子配体启动子上的c-Jun氨基末端激酶[25]。在NIPBL基因突变的CdLS患者成纤维细胞中,非经典型Wnt信号通路和细胞周期蛋白的表达均有明显下调[25]。通过前期研究发现,Wnt/PCP信号通路可能是介导CdLS肢骨发育不良的重要机制。从胚胎器官发育来看,Wnt5a在肢芽、肺、上下颌骨的远心端的形态发生方面起着一个形态发生素的作用[26]。
关于Wnt相关信号通路对胚胎发育影响的研究,已在很多方面取得进展。而这些研究目前的热点在FGF、BMP、Wnt、Shh等,他们既相互影响又相对独立。大量研究证明Wnt/PCP通路,Wnt5a与ROR蛋白结合调节肢体形态、软骨和成骨形成。Shh在四肢的发育中发挥重要作用,在发育的四肢中,Shh表达于间充质干细胞极化的活力区域,上皮细胞中的FGFs调节Shh的表达。有研究发现在Wnt5a转基因小鼠的胚胎肺组织发育的早期上皮细胞中Wnt5a的过渡表达导致间充质干细胞中FGF-10的表达增加和上皮细胞中Shh的表达下降[8]。
通过NIPBL基因敲除鼠模型发现目的基因的mRNA和蛋白水平在E10 d、E11 d、E12 d中均呈现出先升高后降低的趋势,Wnt5a与Shh基因调控目的蛋白表达存在一致性,实验组和对照组胎鼠肢芽内Shh、Wnt5a基因的表达趋势是E10 d时有表达,但表达量较少,随后表达量逐渐增多,在E11 d时达到顶峰,随后表达量逐渐减少,E12 d表达量较E11 d减少,且比E10 d表达量低,实验组小鼠中Wnt5a与Shh的表达量均较对照组降低,两者模式存在一致性,说明NIPBL基因的缺失对Wnt5a和Shh表达均有影响,Wnt5a与Shh可能是NIPBL基因的目的基因,Wnt5a可能是Shh的目标基因。此研究中信号通路可能具有交互作用,Wnt5a和Shh之间的交互作用是如何发挥的等问题还需要进一步的研究。
NIPBL基因缺陷引起CdLS的发病机制尚未完全明了,目前没有很好的治疗方法。因此,研究NIPBL基因在CdLS中的发病机制,尤其在发育中的作用,不仅对于CdLS,更是对于这一大类疾病的研究和治疗手段的探索都具有重要的意义。
| [1] |
Kayembe Kitenge T, Kasole Lubala T, Mbuyi-Musanzayi S, et al. Microtia in Cornelia de Lange syndrome:a case from Democratic Republic of the Congo[J]. Clin Dysmorphol, 2016, 25(4): 178-180. DOI:10.1097/MCD.0000000000000129 (  0) 0) |
| [2] |
Chong K, Keating S, Hurst S, et al. Cornelia de Lange syndrome (CdLS):prenatal and autopsy findings[J]. Prenat Diagn, 2009, 29(5): 489-494. DOI:10.1002/pd.v29:5 (  0) 0) |
| [3] |
Tonkin ET, Wang TJ, Lisgo S, et al. NIPBL, encoding a homolog of fungal Scc2-type sister chromatid cohesion proteins and fly Nipped-B, is mutated in Cornelia de Lange syndrome[J]. Nat Genet, 2004, 36(6): 636-341. DOI:10.1038/ng1363 (  0) 0) |
| [4] |
Kawauchi S, Calof AL, Santos R, et al. Multiple organ system defects and transcriptional dysregulation in the Nipbl(+/-) mouse, a model of Cornelia de Lange Syndrome[J]. PLoS Genet, 2009, 5(9): e1000650. DOI:10.1371/journal.pgen.1000650 (  0) 0) |
| [5] |
Muto A, Ikeda S, Lopez-Burks ME, et al. Nipbl and mediator cooperatively regulate gene expression to control limb development[J]. PLoS Genet, 2014, 10(9): e1004671. DOI:10.1371/journal.pgen.1004671 (  0) 0) |
| [6] |
Collins MM, Simard A, Ryan A. Asymmetric expression of Claudin-10 is required for correct left-right patterning[J]. Develop Biol, 2011, 356(1): 209-210. (  0) 0) |
| [7] |
Kikuchi A, Yamamoto H, Sato A, et al. Wnt5a:its signalling, functions and implication in diseases[J]. Acta Physiol (Oxf), 2012, 204(1): 17-33. DOI:10.1111/j.1748-1716.2011.02294.x (  0) 0) |
| [8] |
Kugler MC, Joyner AL, Loomis CA, et al. Sonic hedgehog signaling in the lung. From development to disease[J]. Am J Respir Cell Mol Biol, 2015, 52(1): 1-13. (  0) 0) |
| [9] |
Kayembe Kitenge T, Kasole Lubala T, Mbuyi-Musanzayi S, et al. Microtia in Cornelia de Lange syndrome:a case from Democratic Republic of the Congo[J]. Clin Dysmorphol, 2016, 25(4): 178-180. DOI:10.1097/MCD.0000000000000129 (  0) 0) |
| [10] |
祁建勤, 张红红, 凌昱, 等. Cornelia De Lange综合征三例[J]. 中华临床医师杂志(电子版), 2013, 7(11): 5187-5188. DOI:10.3877/cma.j.issn.1674-0785.2013.11.096 (  0) 0) |
| [11] |
Newkirk DA, Chen YY, Chien R, et al. The effect of Nipped-B-like (Nipbl) haploinsufficiency on genome-wide cohesin binding and target gene expression:modeling Cornelia de Lange syndrome[J]. Clin Epigenetics, 2017, 9: 89. DOI:10.1186/s13148-017-0391-x (  0) 0) |
| [12] |
Björkman A, Du L, van der Burg M, et al. Reduced immunoglobulin gene diversity in patients with Cornelia de Lange syndrome[J]. J Allergy Clin Immunol, 2018, 141(1): 408-411. DOI:10.1016/j.jaci.2017.06.043 (  0) 0) |
| [13] |
Bajaj S, Nampoothiri S, Yesodharan D, et al. Heterozygous complete NIPBL gene deletion in Cornelia de Lange syndrome:first case report from India[J]. Int J Human Genet, 2016, 16(1-2): 61-69. DOI:10.1080/09723757.2016.11886279 (  0) 0) |
| [14] |
Basel-Vanagaite L, Wolf L, Orin M, et al. Recognition of the Cornelia de Lange syndrome phenotype with facial dysmorphology novel analysis[J]. Clin Genet, 2016, 89(5): 557-563. DOI:10.1111/cge.2016.89.issue-5 (  0) 0) |
| [15] |
Yuan B, Pehlivan D, Karaca E, et al. Global transcriptional disturbances underlie Cornelia de Lange syndrome and related phenotypes[J]. J Clin Invest, 2015, 125(2): 636-651. DOI:10.1172/JCI77435 (  0) 0) |
| [16] |
Kawauchi S, Calof AL, Santos R, et al. Multiple organ system defects and transcriptional dysregulation in the Nipbl(+/-) mouse, a model of Cornelia de Lange Syndrome[J]. PLoS Genet, 2009, 5(9): e1000650. DOI:10.1371/journal.pgen.1000650 (  0) 0) |
| [17] |
Jia Y, Wu D, Zhang R, et al. Bone marrow-derived mesenchymal stem cells expressing the Shh transgene promotes functional recovery after spinal cord injury in rats[J]. Neurosci Lett, 2014, 573: 46-51. DOI:10.1016/j.neulet.2014.05.010 (  0) 0) |
| [18] |
Ramos FJ, Puisac B, Baquero-Montoya C, et al. Clinical utility gene card for:Cornelia de Lange syndrome[J]. Eur J Hum Genet, 2015, 23(10): e1-e4. (  0) 0) |
| [19] |
Jung J, Park S, Kim SH, et al. Ventilation tube insertion is not effective to the treatment of hearing impairment in pediatric patients with Cornelia de Lange syndrome[J]. Am J Otolaryngol, 2016, 37(3): 231-235. DOI:10.1016/j.amjoto.2015.12.010 (  0) 0) |
| [20] |
Tamma R, Zallone A. Osteoblast and osteoclast crosstalks:from OAF to Ephrin[J]. Inflamm Allergy Drug Targets, 2012, 11(3): 196-200. DOI:10.2174/187152812800392670 (  0) 0) |
| [21] |
Yokoyama S, Furukawa S, Kitada S, et al. Analysis of transcription factors expressed at the anterior mouse limb bud[J]. PLoS One, 2017, 12(5): e0175673. DOI:10.1371/journal.pone.0175673 (  0) 0) |
| [22] |
Mei L, Liang D, Huang Y, et al. Two novel NIPBL gene mutations in Chinese patients with Cornelia de Lange syndrome[J]. Gene, 2015, 555(2): 476-480. DOI:10.1016/j.gene.2014.11.033 (  0) 0) |
| [23] |
Vial Y, Lachenaud J, Verloes A, et al. Down syndrome-like acute megakaryoblastic leukemia in a patient with Cornelia de Lange syndrome[J]. Haematologica, 2018, 103(6): e274-e276. DOI:10.3324/haematol.2017.178590 (  0) 0) |
| [24] |
Chen CW, Lin NY, Zhang Y, et al. SAT0185 Wnt5a promotes fibroblast activation and tissue fibrosis by ROR2/RYK dependent activation of PCP-signaling[J]. Ann Rheum Dis, 2016, 75(Suppl 2): 735. (  0) 0) |
| [25] |
Yoshida CA, Komori H, Maruyama Z, et al. SP7 inhibits osteoblast differentiation at a late stage in mice[J]. PLoS One, 2012, 7(3): e32364. DOI:10.1371/journal.pone.0032364 (  0) 0) |
| [26] |
Santiago F, Oguma J, Brown AM, et al. Noncanonical Wnt signaling promotes osteoclast differentiation and is facilitated by the human immunodeficiency virus protease inhibitor ritonavir[J]. Biochem Biophys Res Commun, 2012, 417(1): 223-230. DOI:10.1016/j.bbrc.2011.11.089 (  0) 0) |
| [27] |
Ge X, Shi R, Ma X. The secreted protein WNT5A regulates condylar chondrocyte proliferation, hypertrophy and migration[J]. Arch Oral Biol, 2017, 82: 171-179. DOI:10.1016/j.archoralbio.2017.06.019 (  0) 0) |
 2019, Vol. 21
2019, Vol. 21


