白血病是小儿最常见的恶性肿瘤,目前仍采用以化疗为主的综合治疗。但反复化疗会导致机体重要脏器损伤和多药耐药的产生,限制了化疗在白血病治疗中的应用。自体造血干细胞移植(autologous hematopoietic stem cell transplantation, auto-HSCT)起初是作为治疗没有合适供者行异基因造血干细胞移植(allogeneic hematopoietic stem cell transplantation, allo-HSCT)的白血病患者的替代治疗方案,清髓性预处理后进行auto-HSCT,可以有比化疗更高的抗肿瘤效应,它不受供者的限制,不发生移植物抗宿主病,间质性肺炎等并发症也较轻,能减少移植相关死亡[1-3]。但由于微小残留病的存在及缺乏有效的移植物抗白血病效应,移植后复发率较allo-HSCT高。
紫外线照射已被证实可以诱导细胞的凋亡[4-5]。短期的中波紫外线(波长在280~320 nm)照射会引发细胞凋亡[6],而长时间暴露会在体外诱导各种细胞系(包括HL-60细胞系)的坏死[7]。紫外线诱导细胞凋亡主要是由于DNA损伤、死亡受体激活和活性氧(ROS)的产生导致。本研究中紫外线照射采用紫外发光二极管,其在很多应用中已可以替代传统的紫外灯,例如灭菌、水净化和医疗[8-9]。
骨髓中存在着低氧的微环境,研究证明低氧可以诱导细胞凋亡,影响细胞存活和分化[10-11]。在体外研究中,通常通过降低大气氧浓度或通过利用模拟化学试剂如氯化钴(CoCl2)和去铁胺(DFO)诱导缺氧[12]。本研究中,旨在观察280 nm波长紫外发光二极管照射在低氧条件下对HL-60细胞增殖的影响,以期为自体移植的体外净化提供理论支持,通过体外给予低氧及紫外线照射减少自体移植物中微小残留,降低auto-HSCT的复发率。
1 材料与方法 1.1 材料IMDM培养基、胎牛血清(以色列BI公司),CCK-8(日本MEC公司),CoCl2(美国Sigma公司),RNAiso Plus试剂盒、Prime-ScriptTM RT reagent Kit逆转录试剂盒、SYBRPremix Ex TaqTM试剂盒(日本Takara公司),Annexin-FITC/PI双染流式试剂盒(美国BD公司)。
1.2 细胞培养与分组本研究采用急性早幼粒白血病细胞标准细胞株(HL-60细胞)为本研究所自己保存。实验分为正常对照组(对照组)、低氧处理组(低氧组)、紫外线照射组(紫外线组)、低氧+紫外线共同处理组(低氧+紫外线组)。将HL-60细胞按常规方法复苏、传代培养,待细胞进入对数生长期后用于实验。取生长状态好的细胞,对照组行常规培养,低氧组给予CoCl2(终浓度150 μmol/L)[13]处理,紫外线组用30 J/m2能量的280 nm波长紫外发光二极管照射131 s [14],低氧+紫外线组在给予CoCl2处理基础上用30 J/m2能量的280 nm波长紫外发光二极管照射131 s。各组细胞均于37℃、5%CO2恒温培养箱培养,孵育48 h后收集细胞用于检测。倒置显微镜下观察各组细胞的形态并记录。
1.3 CCK-8法检测细胞增殖抑制率将各组待测细胞以4×104个细胞/孔的密度接种于无菌96孔培养板中,每孔加入10 μL CCK-8溶液,放入37℃、5%CO2恒温培养箱中孵育3 h,以加入无细胞的培养液为空白对照,在酶联免疫检测仪(美国Bio-Rad公司)上于450 nm波长处检测各孔吸光度值(OD),记录结果,实验独立重复3次。按照如下公式计算细胞增殖抑制率:
细胞增殖抑制率(%)=(对照组OD值-实验组OD值)/(对照组OD值-空白对照组OD值)×100%。
1.4 流式细胞术检测细胞凋亡将HL-60细胞以1×106个细胞/孔的密度接种在24孔板中,并按照分组分别进行相应处理。用PBS洗涤2次,以500 μL缓冲液悬浮细胞,分别加入AnnexinV-FITC 5 μL、PI 5 μL,避光孵育15 min,流式细胞仪(美国贝克曼库尔特公司)检测细胞凋亡率,结果以早期凋亡和晚期凋亡细胞比例之和表示。实验独立重复3次。
1.5 实时荧光定量PCR法检测Bcl-2基因mRNA的表达将HL-60细胞以1×106个细胞/孔的密度接种在24孔板中,并按照分组分别进行相应处理。按照RNAiso Plus试剂盒提供的方法提取各组待测细胞的RNA。在冰浴上按PrimeScriptTM RT reagent Kit逆转录试剂盒说明书配制RT反应液,并逆转录合成cDNA。特异性扩增引物由生工生物工程(上海)股份有限公司设计并合成(表 1)。实时荧光定量PCR(qRT-PCR)扩增反应体系(20 μL):SYBR Premix Ex TaqTM 10 μL,上、下游引物各0.8 μL,cDNA模板2.0 μL,dH2O 6.4 μL。反应条件:95℃预变性30 s;95℃ 5 s,60℃ 34 s,40个循环。根据测得的Ct值,计算Bcl-2 mRNA的相对表达量,结果以2-△△Ct表示,△△Ct=(实验组Bcl-2平均值-实验组GAPDH平均值)-(对照组Bcl-2平均值-对照组GAPDH平均值)。实验独立重复3次。
| 表 1 Bcl-2和GAPDH的引物序列表 |
|
|
釆用SPSS 20.0统计软件对所有数据进行统计学分析。计量资料以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验。P < 0.05为差异有统计学意义。
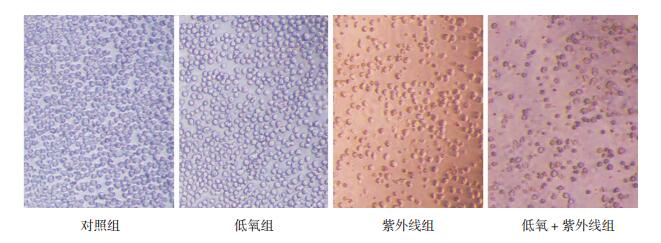
2 结果 2.1 各组细胞生长及形态改变倒置显微镜下观察可见,对照组细胞生长状况良好,随着培养时间的延长,细胞数量增多,细胞形态完整、圆形透亮、排列整齐;各实验组细胞皱缩、透亮度降低、排列紊乱,随着培养时间的延长,细胞数量减少,以低氧+紫外线组最为显著,可见死亡细胞及细胞分裂出的胞质小体。见图 1。
|
图 1 不同处理条件下细胞形态变化(×100) 对照组细胞形态完整、排列整齐、数量增多;各实验组细胞皱缩、排列紊乱、数量减少,以低氧+紫外线组最为显著。 |
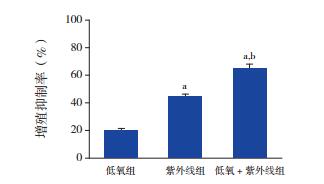
将对照组的增殖抑制率设为0。低氧组、紫外线组、低氧+紫外线组HL-60细胞增殖均产生明显抑制作用,抑制率分别为20.5%±1.0%、44.3%±2.1%、64.7%±3.3%,各组细胞增殖抑制率比较差异有统计学意义(F=267.326,P < 0.01)。紫外线组细胞增殖抑制率高于低氧组(P < 0.05),低氧+紫外线组细胞增殖抑制率明显高于紫外线组和低氧组(P < 0.05)。见图 2。
|
图 2 各实验组HL-60细胞的增殖抑制率比较(n=3) 将对照组的增殖抑制率设为0。a示与低氧组比较,P < 0.05;b示与紫外线组比较,P < 0.05。 |
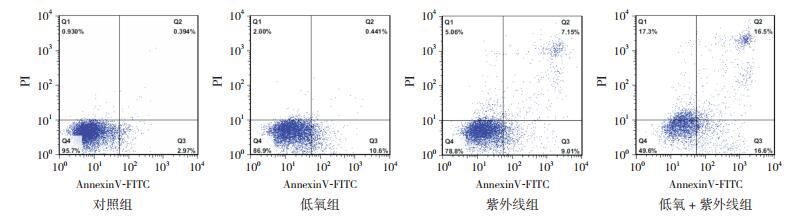
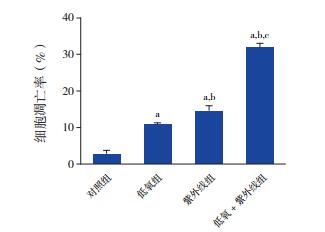
对照组、低氧组、紫外线组、低氧+紫外线组的细胞凋亡率分别为2.6%±1.2%、10.6%±0.7%、14.5%±1.5%、31.7%±1.3%,各组细胞凋亡率比较差异有统计学意义(F=319.507,P < 0.01)。低氧组、紫外线组和低氧+紫外线组细胞凋亡率均高于对照组(P < 0.05),紫外线组细胞凋亡率高于低氧组(P < 0.05),低氧+紫外线组细胞凋亡率明显高于低氧组和紫外线组(P < 0.05)。见图 3~4。
|
图 3 流式细胞术检测各组HL-60细胞凋亡情况 AnnexinV(-)PI(-)为活细胞(Q4),AnnexinV(-)PI(+)为机械损伤细胞(Q1),AnnexinV(+)PI(-)为早期凋亡细胞(Q3),AnnexinV(+)PI(+)为晚期凋亡细胞(Q2),以早期凋亡和晚期凋亡细胞比例之和(Q2+Q3)计算细胞凋亡率 |
|
图 4 各组HL-60细胞凋亡率比较(n=3) a示与对照组比较,P < 0.05;b示与低氧组比较,P < 0.05;c示与紫外线组比较,P < 0.05。 |
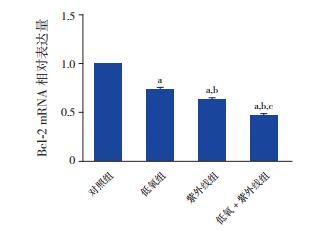
将对照组Bcl-2 mRNA相对表达量设为1,低氧组、紫外线组、低氧+紫外线组Bcl-2 mRNA的相对表达量分别为0.737±0.018、0.627±0.019、0.462±0.023,各组Bcl-2 mRNA的相对表达量比较差异有统计学意义(F=612.602,P < 0.01)。低氧组、紫外线组和低氧+紫外线组细胞Bcl-2 mRNA表达量均低于对照组(P < 0.05),紫外线组Bcl-2 mRNA表达量低于低氧组(P < 0.05),低氧+紫外线组Bcl-2 mRNA表达量低于低氧组和紫外线组(P < 0.05)。见图 5。
|
图 5 各组HL-60细胞Bcl-2 mRNA相对表达量比较(n=3) a示与对照组比较,P < 0.05;b示与低氧组比较,P < 0.05;c示与紫外线组比较,P < 0.05。 |
紫外线诱导细胞凋亡主要是由于DNA损伤、死亡受体激活和ROS的产生导致。紫外线照射诱导DNA损伤,产生2, 3-环丁烷嘧啶二聚体和嘧啶(6-4)嘧啶酮光产物,它可以有效地阻断复制和转录过程[15-16]。DNA损伤可导致p53激活,促进细胞周期阻滞蛋白p21WAF1/CIP1、DNA修复酶及抗凋亡基因的转录,为DNA修复提供时间,但当DNA损伤无法完全修复时,p53则触发细胞凋亡,防止受损DNA进入细胞导致肿瘤发生[17-18]。紫外线可以通过非配体依赖的方式诱导死亡受体肿瘤坏死因子(TNF)、Fas的聚集,作为凋亡的始动信号参与凋亡。已经证实紫外线照射诱导哺乳动物细胞的凋亡与Fas和TNF受体的活化相关[19]。紫外线还可以刺激ROS、活性氮和自由基的产生,造成生物大分子的损伤,诱导细胞凋亡[20-21],紫外线诱导的ROS产生与线粒体电位下降有关[22],ROS使得线粒体外膜发生脂质过氧化损伤,诱导线粒体膜电位下降,引起早期细胞色素C释放,从而促进细胞凋亡的诱导[23]。
低氧是肿瘤发展过程中所必须经历的环境条件之一,肿瘤细胞增殖迅速导致耗氧量增加,致使肿瘤微环境的一个显著特点就是局部低氧。在肿瘤细胞应对低氧的过程中,低氧诱导因子-1(HIF-1)介导的低氧信号转导通路的激活起着重要的作用。HIF-1是异二聚体转录因子,在常氧条件下通过蛋白酶体降解迅速被破坏,但在缺氧情况下,其降解缓慢,最终导致靶基因的表达增加[24]。HIF-1与线粒体通路中的某些蛋白存在着一定的关系[25],如将促凋亡基因Bax等带到肿瘤低氧部位,诱导细胞的凋亡。低氧环境下,线粒体产生过量ROS,这可能导致大分子损伤,如脂质过氧化、蛋白质氧化、DNA氧化等,可能导致细胞损伤和死亡。除ROS外,线粒体还通过Ca2+螯合作用及存储和释放抗/促凋亡蛋白诱导细胞凋亡,如细胞色素C,凋亡诱导因子(AIF),Bcl-2基因等[26]。这与紫外线诱导细胞凋亡的途径类似。CoCl2可以阻断HIF-1降解来模拟缺氧情况[27],在不同类型的细胞实验结果表明,CoCl2可以诱导细胞凋亡[28-30]。
本实验课题组已经证实280 nm波长紫外发光二极管照射可以抑制HL-60细胞的增殖并诱导细胞的凋亡及坏死[14],且在低剂量30 J/m2的紫外发光二极管照射时诱导细胞凋亡最明显。但在骨髓造血微环境的低氧条件下,紫外线照射对HL-60细胞的影响仍有待阐明。在本研究中,发现280 nm波长紫外发光二极管照射在体外低氧条件下抑制HL-60细胞的增殖并诱导细胞凋亡,且在低氧条件下的紫外线照射诱导HL-60细胞凋亡能力比正常条件下照射诱导凋亡能力更强。
Bcl-2家族基因是线粒体介导的细胞凋亡的重要调节因子,可分为抗凋亡基因和促凋亡基因,Bcl-2可通过直接抗氧化、抑制Bax和Bak的活化、维持Ca2+稳态、抑制线粒体促凋亡蛋白质的释放等途径抑制凋亡[31-32]。在本研究中,低氧条件下30 J/m2的紫外线照射诱导细胞凋亡并抑制Bcl-2 mRNA表达,且诱导凋亡的能力比正常条件下更强,这表明低氧条件下280 nm波长紫外发光二极管照射对HL-60细胞的促凋亡作用与Bcl-2 mRNA表达的下调有关。
综上所述,280 nm波长紫外发光二极管照射可抑制HL-60细胞增殖并诱导细胞凋亡和坏死,且在低氧条件下抑制细胞增殖及诱导细胞凋亡的能力更强。Bcl-2 mRNA表达的下调是导致细胞凋亡的部分原因,提示可能与线粒体介导的细胞凋亡有关,具体通路还需要进一步研究。
| [1] |
Vellenga E, van Putten W, Ossenkoppele GJ, et al. Autologous peripheral blood stem cell transplantation for acute myeloid leukemia[J]. Blood, 2011, 118(23): 6037-6042. DOI:10.1182/blood-2011-07-370247 (  0) 0) |
| [2] |
Wetzel D, Mueller BU, Mansouri TB, et al. Delayed Haematological recovery after autologous stem cell transplantation is associated with favourable outcome in acute myeloid leukaemia[J]. Br J Haematol, 2015, 168(2): 268-273. DOI:10.1111/bjh.13118 (  0) 0) |
| [3] |
曹易耕, 姜尔烈, 何祎, 等. 自体外周血造血干细胞移植治疗55例急性髓系白血病患者的疗效及预后分析[J]. 中华血液学杂志, 2016, 37(6): 464-468. (  0) 0) |
| [4] |
Azzouz D, Khan MA, Sweezey N, et al. Two-in-one:UV radiation simultaneously induces apoptosis and NETosis[J]. Cell Death Discov, 2018, 4: 51. (  0) 0) |
| [5] |
Harberts E, Fishelevich R, Liu J, et al. MyD88 mediates the decision to die by apoptosis or necroptosis after UV irradiation[J]. Innate Immun, 2014, 20(5): 529-539. DOI:10.1177/1753425913501706 (  0) 0) |
| [6] |
Salucci S, Burattini S, Battistelli M, et al. Ultraviolet B (UVB) irradiation-induced apoptosis in various cell lineages in vitro[J]. Int J Mol Sci, 2012, 14(1): 532-546. DOI:10.3390/ijms14010532 (  0) 0) |
| [7] |
Artiukhov VG, Zemchenkova OV, Basharina OV, et al. Apoptosis and necrosis of lymphocytes induced by UV-radiation in the presence of autological plasma[J]. Tsitologiia, 2014, 56(1): 77-83. (  0) 0) |
| [8] |
Song K, Mohseni M, Taghipour F. Application of ultraviolet light-emitting diodes (UV-LEDs) for water disinfection:a review[J]. Water Res, 2016, 94: 341-349. DOI:10.1016/j.watres.2016.03.003 (  0) 0) |
| [9] |
Kemeny L, Csoma Z, Bagdi E, et al. Targeted phototherapy of plaque-type psoriasis using ultraviolet B-light-emitting diodes[J]. Br J Dermatol, 2010, 163(1): 167-173. (  0) 0) |
| [10] |
Hu Z, Wang F, Wu Z, et al. FOXO3a-dependent up-regulation of Mxi1-0 promotes hypoxia-induced apoptosis in endothelial cells[J]. Cell Signal, 2018, 51: 233-242. DOI:10.1016/j.cellsig.2018.08.009 (  0) 0) |
| [11] |
Zhou J, Qian CY, Tong RQ, et al. Hypoxia induces apoptosis of mouse spermatocyte GC-2 cells through activation of autophagy[J]. Cell Biol Int, 2018. doi: 10.1002/cbin.10971.[Epub ahead of print]
(  0) 0) |
| [12] |
Teti G, Focaroli S, Salvatore V, et al. The hypoxia-mimetic agent cobalt chloride differently affects human mesenchymal stem cells in their chondrogenic potential[J]. Stem Cells Int, 2018, 2018: 3237253. (  0) 0) |
| [13] |
石旭.低氧模拟物CoCl2对人急性髓系白血病细胞HL60中ROS及钙离子的调控及其意义[D].北京: 中国协和医科大学, 2008.
(  0) 0) |
| [14] |
Xie D, Sun Y, Wang L, et al. Ultraviolet light-emitting diode irradiation-induced cell death in HL-60 human leukemia cells in vitro[J]. Mol Med Rep, 2016, 13(3): 2506-2510. DOI:10.3892/mmr.2016.4812 (  0) 0) |
| [15] |
Reichrath J, Rass K. Ultraviolet damage, DNA repair and vitamin D in nonmelanoma skin cancer and in malignant melanoma:an update[J]. Adv Exp Med Biol, 2014, 810: 208-233. (  0) 0) |
| [16] |
Synowiec E, Hoser G, Wojcik K, et al. UV differentially induces oxidative stress, DNA damage and apoptosis in BCR-ABL1-positive cells sensitive and resistant to imatinib[J]. Int J Mol Sci, 2015, 16(8): 18111-18128. DOI:10.3390/ijms160818111 (  0) 0) |
| [17] |
de Pedro I, Alonso-Lecue P, Sanz-Gómez N, et al. Sublethal UV irradiation induces squamous differentiation via a p53-independent, DNA damage-mitosis checkpoint[J]. Cell Death Dis, 2018, 9(11): 1094. DOI:10.1038/s41419-018-1130-8 (  0) 0) |
| [18] |
Yogosawa S, Yoshida K. Tumor suppressive role for kinases phosphorylating p53 in DNA damage-induced apoptosis[J]. Cancer Sci, 2018, 109(11): 3376-3382. DOI:10.1111/cas.2018.109.issue-11 (  0) 0) |
| [19] |
Shokrollahi BM, Hasanzadeh H, Barati M, et al. Apoptosis/necrosis induction by ultraviolet, in ER positive and ER negative breast cancer cell lines[J]. Iran J Cancer Prev, 2015, 8(6): e4193. (  0) 0) |
| [20] |
Kong L, Wang S, Wu X, et al. Paeoniflorin attenuates ultraviolet B-induced apoptosis in human keratinocytes by inhibiting the ROS-p38-p53 pathway[J]. Mol Med Rep, 2016, 13(4): 3553-3558. DOI:10.3892/mmr.2016.4953 (  0) 0) |
| [21] |
Srinivas US, Tan BWQ, Vellayappan BA, et al. ROS and the DNA damage response in cancer[J]. Redox Biol, 2018. doi: 10.1016/j.redox.2018.101084.[Epub ahead of print]
(  0) 0) |
| [22] |
Widel M, Krzywon A, Gajda K, et al. Induction of bystander effects by UVA, UVB, and UVC radiation in human fibroblasts and the implication of reactive oxygen species[J]. Free Radic Biol Med, 2014, 68: 278-287. DOI:10.1016/j.freeradbiomed.2013.12.021 (  0) 0) |
| [23] |
Ali D, Verma A, Mujtaba F, et al. UVB-induced apoptosis and DNA damaging potential of chrysene via reactive oxygen species in human keratinocytes[J]. Toxicol Lett, 2011, 204(2-3): 199-207. DOI:10.1016/j.toxlet.2011.04.033 (  0) 0) |
| [24] |
Baharaghdam S, Yousefi M, Movasaghpour A, et al. Effects of hypoxia on biology of human leukemia T-cell line (MOLT-4 cells) co-cultured with bone marrow mesenchymal stem cells[J]. Avicenna J Med Biotechnol, 2018, 10(2): 62-68. (  0) 0) |
| [25] |
张博, 翁勤洁, 陈中婷, 等. Q39在缺氧条件下诱导人白血病K562细胞凋亡[J]. 浙江大学学报(医学版), 2007, 36(3): 261-266. DOI:10.3785/j.issn.1008-9292.2007.03.009 (  0) 0) |
| [26] |
Peng C, Rao W, Zhang L, et al. Mitofusin 2 ameliorates hypoxia-induced apoptosis via mitochondrial function and signaling pathways[J]. Int J Biochem Cell Biol, 2015, 69: 29-40. DOI:10.1016/j.biocel.2015.09.011 (  0) 0) |
| [27] |
Muñoz-Sánchez J, Chánez-Cárdenas ME. The use of cobalt chloride as a chemical hypoxia model[J]. J Appl Toxicol, 2018. doi: 10.1002/jat.3749.[Epub ahead of print]
(  0) 0) |
| [28] |
Lee M, Kang H, Jang SW. CoCl2 induces PC12 cells apoptosis through p53 stability and regulating UNC5B[J]. Brain Res Bull, 2013, 96: 19-27. DOI:10.1016/j.brainresbull.2013.04.007 (  0) 0) |
| [29] |
Yang Z, Yang C, Xiao L, et al. Novel insights into the role of HSP90 in cytoprotection of H2S against chemical hypoxia-induced injury in H9c2 cardiac myocytes[J]. Int J Mol Med, 2011, 28(3): 397-403. (  0) 0) |
| [30] |
Dai ZJ, Gao J, Ma XB, et al. Up-regulation of hypoxia inducible factor-1alpha by cobalt chloride correlates with proliferation and apoptosis in PC-2 cells[J]. J Exp Clin Cancer Res, 2012, 31: 28. DOI:10.1186/1756-9966-31-28 (  0) 0) |
| [31] |
Si H, Zhang Y, Song Y, et al. Overexpression of adrenomedullin protects mesenchymal stem cells against hypoxia and serum deprivation-induced apoptosis via the Akt/GSK3β and Bcl-2 signaling pathways[J]. Int J Mol Med, 2018, 41(6): 3342-3352. (  0) 0) |
| [32] |
Birkinshaw RW, Czabotar PE. The BCL-2 family of proteins and mitochondrial outer membrane permeabilisation[J]. Semin Cell Dev Biol, 2017, 72: 152-162. DOI:10.1016/j.semcdb.2017.04.001 (  0) 0) |
 2019, Vol. 21
2019, Vol. 21


