婴儿痉挛症(infantile spasms, IS)是婴幼儿期最常见的癫痫性脑病,发病率为0.2‰~0.5‰[1],超过90%在出生后1年内发病[2],主要特点包括频繁的痉挛发作和高峰失律脑电图(EEG),并有极大的风险发生精神运动发育迟缓。激素疗法是IS最有效的初始治疗方法,常用药物为天然促肾上腺皮质激素(ACTH)、人工ACTH(替可克肽)和泼尼松龙[3]。迄今全球范围内对上述药物治疗IS的效果仍有争论。目前在美国用ACTH治疗IS 1个月疗程的花费至少为80 000到120 000美元,而同样疗程使用泼尼松龙的花费却不到40美元[4]。另外,相比于ACTH只能静脉注射或肌肉注射给药,泼尼松龙的口服给药方式更加简单易行。如果泼尼松龙被证明与ACTH同等有效或更好,那么在中国等发展中国家推广使用泼尼松龙治疗IS将具有重大意义。本研究对相关文献进行Meta分析,比较泼尼松龙和ACTH对IS的疗效和安全性。
1 资料与方法 1.1 文献纳入标准纳入标准:(1)比较泼尼松龙与ACTH治疗IS的临床研究;(2)研究类型:随机对照试验和非随机对照试验;(3)研究对象:依据痉挛发作的临床表现和EEG高度失律波形诊断的IS患儿,不限性别、年龄、病因;(4)干预措施:试验组使用泼尼松龙,对照组使用ACTH。
1.2 文献排除标准排除标准:(1)非中、英文文献;(2)重复发表的文献;(3)未报道Meta分析设定的结局指标文献。
1.3 结局指标结局指标包括:痉挛缓解率、EEG高峰节律紊乱消失率、达到痉挛缓解时间、感染发生率以及易激惹发生率。
1.4 文献检索策略通过计算机检索1990年至2018年12月国内外已发表的比较泼尼松龙与ACTH治疗IS的临床研究文献。检索数据库包括Cochrane Library、Embase、PubMed、中国生物医学文献数据库、中国知网和万方数据库等中英文数据库,手动检索作为补充,检索语种为中文及英文。英文检索式为:infantile spasms/West syndrome AND treatment/therapy/management/prednisolone/ACTH/adrenocor-ticotropic hormone。中文检索式为:婴儿痉挛症/泼尼松龙/促肾上腺糖皮质激素。通过检索电子期刊全文数据库或直接与作者联系获取原文及相关数据。
1.5 资料提取及文献质量评价由2名研究人员分别独立检索、阅读文题、摘要及全文,参照文献纳入及排除标准,确定研究是否被纳入,独立提取文献并交叉核对,出现分歧或不一致时通过讨论或由第三位研究人员协助解决。采用Cochrane系统评价员手册5.1.0版(Review Manager 5.3中自带)提供的标准对随机对照研究从以下方面进行质量评价:随机方法、分配方案、盲法、对失访的报告、选择性偏倚及其他偏倚。若所有标准均为低风险,则为低偏倚风险研究(low risk of bias),其质量最高;一类或多类风险未知为未知偏倚风险研究(unclear risk of bias),质量为中等;一类或多类高风险,则为高偏倚风险研究(high risk of bias),其质量较低。采用NOS量表对非随机对照研究进行质量评价。NOS量表分为3个模块8个条目,共9分,≥ 6分的研究可认为质量较高。
1.6 统计学分析采用Review Manager 5.3软件进行Meta分析。二分类变量资料采用优势比(OR)及其95%CI表示,P < 0.05为差异有统计学意义。连续性变量资料采用均数差(MD)及其95%CI表示,P < 0.05为差异有统计学意义。异质性检验采用Q检验和I2统计量,若P < 0.1,I2 > 50%,则认为纳入研究之间异质性较大,采用随机效应模型分析;反之,则采用固定效应模型分析。采用Cochrane风险偏倚评估工具判断是否存在偏倚。利用Review Manager 5.3软件逐一排除文献进行敏感性分析。
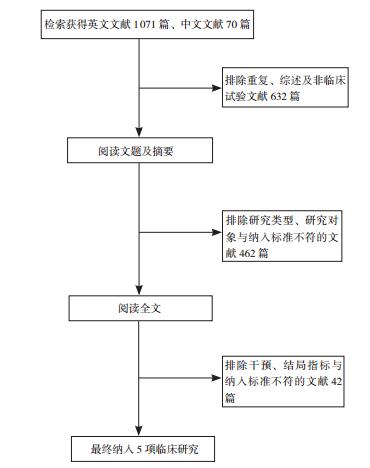
2 结果 2.1 文献筛选结果根据检索策略,最初共检出文献1 141篇,其中Cochrane Library 228篇,Embase 378篇,PubMed 465篇,中国生物医学文献数据库10篇,中国知网35篇,万方数据库25篇。通过阅读文题、摘要以及对照纳入、排除标准进一步阅读全文,最终纳入5篇文献[5-9]。文献筛选流程见图 1。共计受试者406名,其中试验组239名,对照组167名。纳入文献的基本情况见表 1。
|
图 1 文献筛选流程图 |
| 表 1 纳入5篇临床研究的基本情况 |
|
|
据Cochrane协作网风险偏倚评估工具对所有文献进行评价。纳入的4篇文献[5, 7-9]采用随机方法,且报道了随机序列产生的方法,并实现了分配隐藏,故选择性偏倚较小;没有文献对研究者和受试者实施盲法,故实施偏倚较大;仅有1篇文献[9]实现了研究结局盲法评价,故测量偏倚较大;4篇文献[5, 7-9]结局数据完整及不存在选择性报告研究结果,故随访及报告的偏倚均较小;没有文献报道了其他偏倚情况(图 2)。Kossoff等[6]的研究NOS评分7分,质量较高。

|
图 2 偏倚风险图 |
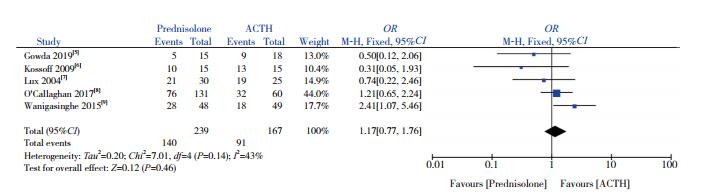
5篇文献[5-9]比较了试验组与对照组的痉挛缓解情况。异质性检验显示存在较小异质性(I2=43%,P=0.14),采用固定效应模型分析,显示两组痉挛缓解率差异无统计学意义(OR=1.17,95%CI:0.77~1.76,P=0.46),见图 3。
|
图 3 两组痉挛缓解率比较的Meta分析 |
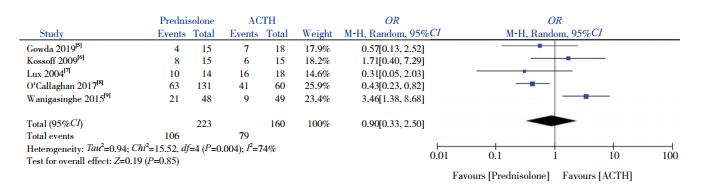
5篇文献[5-9]比较了试验组与对照组的EEG高峰节律紊乱消失率差异。异质性检验显示存在较大的异质性(I2=74%,P=0.004),采用随机效应模型分析,显示两组EEG高峰节律紊乱消失率差异无统计学意义(OR=0.90,95%CI:0.33~2.50,P=0.85),见图 4。
|
图 4 两组EEG高峰节律紊乱消失率比较的Meta分析 |
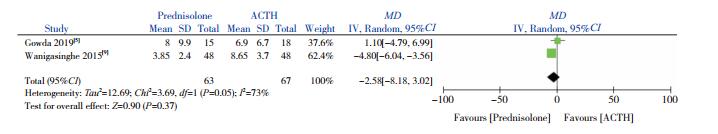
2篇文献[5, 9]比较了试验组与对照组达到痉挛缓解时间(单位:d)的差异。异质性检验显示存在较大的异质性(I2=73%,P=0.05),采用随机效应模型分析,显示两组达到痉挛缓解时间差异无统计学意义(MD=-2.58,95%CI:-8.18~3.02,P=0.37),见图 5。
|
图 5 两组达到痉挛缓解时间比较的Meta分析 |
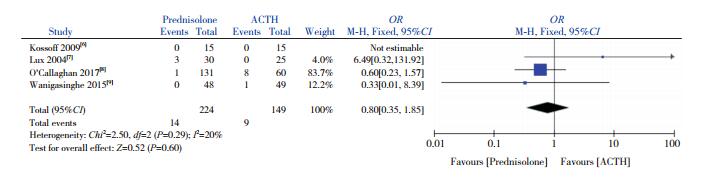
4篇文献[6-9]比较了试验组与对照组感染发生率的差异。异质性检验显示存在较小的异质性(I2=20%,P=0.29),采用固定效应模型分析,显示两组感染发生率差异无统计学意义(OR=0.80,95%CI:0.35~1.85,P=0.60),见图 6。
|
图 6 两组感染发生率比较的Meta分析 |
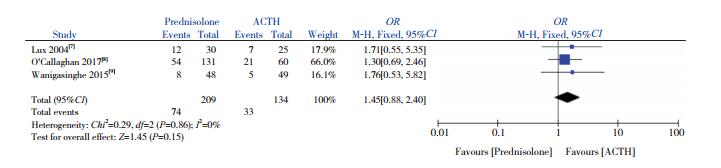
3篇文献[7-9]比较了试验组与对照组易激惹发生率的差异。异质性检验显示无异质性(I2=0%,P=0.86),采用固定效应模型分析,显示两组易激惹发生率差异无统计学意义(OR=1.45,95%CI:0.88~2.40,P=0.15),见图 7。
|
图 7 两组易激惹发生率比较的Meta分析 |
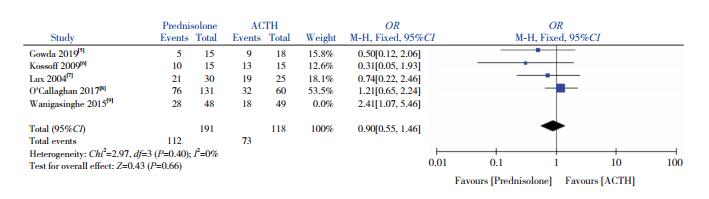
采用逐一剔除文献法发现痉挛缓解率和EEG高峰节律紊乱消失率比较的异质性主要来源于Wanigasinghe等[9]这篇文献。去除此文献后,试验组与对照组的痉挛缓解率和EEG高峰节律紊乱消失率的比较结果如图 8、9。痉挛缓解率的异质性检验显示无异质性(I2=0%,P=0.40),采用固定效应模型分析,显示两组痉挛缓解率差异无统计学意义(OR=0.90,95%CI:0.55~1.46,P=0.66)。EEG高峰节律紊乱消失率的异质性检验显示存在较小的异质性(I2=8%,P=0.35),采用固定效应模型分析,显示试验组比对照组EEG高峰节律紊乱消失率低,差异有统计学意义(OR=0.52,95%CI:0.31~0.88,P=0.01)。
|
图 8 去除主要异质性来源文献后两组痉挛缓解率比较的Meta分析 |

|
图 9 去除主要异质性来源文献后两组EEG高峰节律紊乱消失率比较的Meta分析 |
本Meta分析结果尚没有证据显示泼尼松龙和ACTH治疗IS在痉挛缓解率和痉挛缓解时间上哪种效果更佳,以及并发感染和易激惹的几率哪种更低,但ACTH治疗组的EEG高峰节律紊乱消失率高于泼尼松龙治疗组。
目前,治疗IS的一线用药包括ACTH、糖皮质激素和氨己烯酸[10],国内常用ACTH和糖皮质激素治疗IS。ACTH分为天然制剂和人工制剂(替可克肽),肌肉注射给药;糖皮质激素包括泼尼松龙和泼尼松,口服给药。泼尼松需经体内Ⅰ型羟基类固醇脱氢酶(HSD11B)转化为有活性的泼尼松龙才能发挥作用[11]。婴儿体内将泼尼松转化为泼尼松龙的能力是有差异的,所以本研究并未将泼尼松龙和泼尼松等同为一种治疗方法,而选择比较更具优势的泼尼松龙。
本Meta分析的异质性主要来源于Wanigasinghe等[9]的文献。该研究纳入患儿的僧伽罗族(斯里兰卡主要民族)占比在试验组和对照组中均达到87.5%[9],其研究对象在人种上与Kossoff等[6]、Lux等[7]和O'Callaghan等[8] 3项研究存在明显差异。目前尚未有关于ACTH或泼尼松龙治疗IS效果与人种关系的研究,但同一种治疗IS的药物在不同人种上的疗效差异仍值得关注。一篇针对日本境内IS治疗现状的文献报道,吡哆醇治疗IS的不良反应在频率和严重性上均低于ACTH,所以与欧美国家不同的是,在日本优先使用吡哆醇治疗IS [12]。除此之外,Wanigasinghe等[9]的研究使用人工合成ACTH,不同于Gowda等[5]和Kossoff等[6]的研究使用天然ACTH。天然ACTH为包含39个氨基酸的多肽链,人工ACTH为缩短的仅包含前者氨基端的二十四肽[12]。另外,不同厂家不同制备方法生产的ACTH在化学成分上也可能存在差异。然而天然ACTH和人工ACTH治疗IS效果是否不同,有待进行相关临床研究。
ACTH刺激肾上腺皮质产生内源性皮质醇,皮质醇和具有类似结构的泼尼松龙都具有类似的皮质类固醇效应[12]。ACTH治疗IS的机制仍未详细阐明,但包括对痉挛相关的促肾上腺皮质激素释放激素(CRH)的抑制作用。ACTH既能通过促进皮质醇的释放而间接抑制CRH的分泌,也能在中枢黑皮质素受体的介导下直接抑制CRH的产生[13]。与之相比,虽然泼尼松龙也能通过负反馈调节抑制CRH分泌,但同时ACTH的分泌也受到抑制,后者将导致对CRH分泌的抑制作用减弱[14]。这种解释提示ACTH治疗IS的效果优于泼尼松龙。本Meta分析中,虽然没有证据显示哪种疗法在痉挛缓解率上更具优势,但肯定了ACTH稳定EEG的效果优于泼尼松龙。
本Meta分析所纳入文献中有3篇[5-7]报道两种疗法不良反应发生率差异无统计学意义,Wanigasinghe等[9]的研究比较了各种不良反应的发生率,发现只有腹胀的发生率差异显著(P=0.001),其中泼尼松龙组(21.1%)高于ACTH组(0%)。对于激素疗法的各种不良反应,首先应该关注的是免疫抑制。本Meta分析结果提示泼尼松龙组的感染发生率略低于ACTH组,但差异无统计学意义。过去认为大剂量的激素治疗会削弱婴儿抵抗感染的能力,使他们更容易患上严重的败血症。本Meta分析所纳入文献中只有O'Callaghan等[8]的研究感染发生率较高(泼尼松龙组:11/131;ACTH组:8/60),但其中严重感染的占比不大(泼尼松龙组:4/131,ACTH组:1/60)。临床上还应重视激素治疗引起的高血压,这可能导致充血性心力衰竭。Lux等[7]的研究详细报道了泼尼松龙和ACTH治疗IS两组的血压升高情况,其中泼尼松龙组23%的患儿血压超过110/80 mm Hg,13%的患儿血压超过120/90 mm Hg,ACTH组血压超过110/80 mm Hg和120/90 mm Hg者均为16%。临床上避免感染性接触和筛查无症状高血压是任何激素治疗过程中都应采取的关键措施,但是否应针对潜在的感染如肺孢子菌肺炎等预防性使用抗生素仍然存在争议[12]。易激惹是激素治疗的常见不良反应。O'Callaghan等[8] 2017的研究报道易激惹在泼尼松龙组和ACTH组的发生率分别高达41%和35%。本Meta分析结果提示泼尼松龙组的易激惹发生率高于ACTH组,但差异无统计学意义。
本Meta分析具有以下局限:(1)纳入研究数量较少,样本数有限;(2)纳入研究使用的ACTH有天然制剂和人工制剂的区别;(3)激素使用方法不一致;(4)缺少对远期随访的评价。
综上,现有证据未显示采用泼尼松龙和ACTH治疗IS的临床疗效有差异,但ACTH在稳定EEG上更具优势;感染、易激惹等不良反应的发生率在两种疗法中也未见明显差异。临床上有待进行多中心大样本的随机对照研究以进一步确定两者之间的疗效与安全性的差异。
| [1] |
Knupp KG, Coryell J, Nickels KC, et al. Response to treatment in a prospective national infantile spasms cohort[J]. Ann Neurol, 2016, 79(3): 475-484. DOI:10.1002/ana.24594 (  0) 0) |
| [2] |
Taghdiri MM, Nemati H. Infantile spasm:a review article[J]. Iran J Child Neurol, 2014, 8(3): 1-5. (  0) 0) |
| [3] |
Kelley SA, Knupp KG. Infantile spasms -have we made progress?[J]. Curr Neurol Neurosci Rep, 2018, 18(5): 27. DOI:10.1007/s11910-018-0832-8 (  0) 0) |
| [4] |
Mytinger JR. High-dose prednisolone as a first-line treatment for infantile spasms[J]. Pediatr Neurol, 2018, 87: 3-4. DOI:10.1016/j.pediatrneurol.2018.08.011 (  0) 0) |
| [5] |
Gowda VK, Narayanaswamy V, Shivappa SK, et al. Corticotrophin-ACTH in comparison to prednisolone in West syndrome -a randomized study[J]. Indian J Pediatr, 2019, 86(2): 165-170. DOI:10.1007/s12098-018-2782-1 (  0) 0) |
| [6] |
Kossoff EH, Hartman AL, Rubenstein JE, et al. High-dose oral prednisolone for infantile spasms:an effective and less expensive alternative to ACTH[J]. Epilepsy Behav, 2009, 14(4): 674-676. DOI:10.1016/j.yebeh.2009.01.023 (  0) 0) |
| [7] |
Lux AL, Edwards SW, Hancock E, et al. The United Kingdom Infantile Spasms Study comparing vigabatrin with prednisolone or tetracosactide at 14 days:a multicentre, randomised controlled trial[J]. Lancet, 2004, 364(9447): 1773-1778. DOI:10.1016/S0140-6736(04)17400-X (  0) 0) |
| [8] |
O'Callaghan FJ, Edwards SW, Alber FD, et al. Safety and effectiveness of hormonal treatment versus hormonal treatment with vigabatrin for infantile spasms (ICISS):a randomised, multicentre, open-label trial[J]. Lancet Neurol, 2017, 16(1): 33-42. (  0) 0) |
| [9] |
Wanigasinghe J, Arambepola C, Sri Ranganathan S, et al. Randomized, single-blind, parallel clinical trial on efficacy of oral prednisolone versus intramuscular corticotropin on immediate and continued spasm control in West syndrome[J]. Pediatr Neurol, 2015, 53(3): 193-199. DOI:10.1016/j.pediatrneurol.2015.05.004 (  0) 0) |
| [10] |
Tibussek D, Klepper J, Korinthenberg R, et al. Treatment of infantile spasms:report of the Interdisciplinary Guideline Committee Coordinated by the German-Speaking Society for Neuropediatrics[J]. Neuropediatrics, 2016, 47(3): 139-150. DOI:10.1055/s-00000041 (  0) 0) |
| [11] |
Green BB, Armstrong DA, Lesseur C, et al. The role of placental 11-beta hydroxysteroid dehydrogenase type 1 and type 2 methylation on gene expression and infant birth weight[J]. Biol Reprod, 2015, 92(6): 149. (  0) 0) |
| [12] |
Hussain SA. Treatment of infantile spasms[J]. Epilepsia Open, 2018, 3(Suppl 2): 143-154. (  0) 0) |
| [13] |
Brunson KL, Avishai-Eliner S, Baram TZ. ACTH treatment of infantile spasms:mechanisms of its effects in modulation of neuronal excitability[J]. Int Rev Neurobiol, 2002, 49: 185-197. DOI:10.1016/S0074-7742(02)49013-7 (  0) 0) |
| [14] |
Jaseja H. A plausible explanation for superiority of adreno-cortico-trophic hormone (ACTH) over oral corticosteroids in management of infantile spasms (West syndrome)[J]. Med Hypotheses, 2006, 67(4): 721-724. DOI:10.1016/j.mehy.2006.04.039 (  0) 0) |
 2019, Vol. 21
2019, Vol. 21


