2. 郑州大学第五附属医院儿童康复医学科, 河南 郑州 450052
孤独症谱系障碍(autism spectrum disorder, ASD)是一种影响沟通和行为的发育障碍性疾病,通常在儿童早期出现,其核心症状为:社会沟通和社交的缺陷,局限的重复的行为、兴趣或活动[1]。ASD男女患病比约为4 : 1[2],患病率为14.6/1 000 [3]。该病目前尚无高效的治疗方法,因此ASD患者及其家庭面临了沉重的精神和经济负担。ASD的病因尚不明确,多数研究者认为基因与环境因素的相互作用影响ASD的发生发展。研究报道过某些产前及新生儿危险因素可能与ASD相关,如产前抗生素使用、生产方式和新生儿早期抗生素使用等[4]。
近年来,大量研究发现肠道微生态在新生儿免疫系统和内分泌系统的发育成熟中发挥着重要作用[5]。肠道微生物稳态的打破与多种疾病的发生和发展密切相关,包括ASD,婴儿坏死性小肠结肠炎等[6]。肠道微生态通过神经、免疫、内分泌和代谢途径影响肠道和中枢神经系统,这种复杂的交互作用被称作微生态-肠-脑轴[7]。大量以西方国家人群为背景的研究发现微生态-肠-脑轴的紊乱可能与ASD的发病相关。然而西方国家儿童与我国儿童的种族,生活习惯和饮食习惯不同,国外的研究结果不能反映我国ASD儿童的肠道微生态结构。此外,ASD儿童肠道微生态的组成与产前危险因素和行为症状之间的关系仍未明确。
为了解我国ASD儿童肠道菌群的组成和分布,并筛选出与行为症状密切相关的菌群,本研究对ASD儿童细菌16S rRNA基因的V3-V4高变区进行测序,评估其行为症状的严重程度并进行相关分析。
1 资料与方法 1.1 研究对象于郑州大学第五附属医院招募30名(2.5~10岁)初治ASD儿童纳入ASD组;同时招募20名年龄和性别与之匹配的健康儿童纳入健康对照组。由具有资质的儿童神经精神病学医师依据孤独症诊断观察量表(autism diagnostic observation schedule-second edition, ADOS-2)[8]和孤独症诊断访谈量表修订版(autism diagnostic interview-revised, ADI-R)[9]联合应用进行ASD的诊断;依据孤独症治疗评估量表(autism treatment evaluation checklist, ATEC)对ASD儿童行为症状的严重程度进行评分,包括语言、社交、感觉知觉和健康/身体/行为[10]。健康对照组儿童需经儿童神经精神病学医师应用孤独症行为评定量表(autism behavior checklist, ABC)评估(< 31分)排除ASD [11],且无ASD直系亲属(父母或兄弟姐妹)。排除标准包括神经系统疾病或脑器质性疾病史,严重头部受伤及其他重大疾病史,特殊饮食(如麸质,酪蛋白)史,额外营养添加史,通过临床症状、体征、既往史,必要时采用辅助检查(如磁共振,脑电图等)进行诊断和鉴别诊断。研究对象在取样前至少3个月未使用抗生素、微生态调节剂或抗真菌药。本研究经郑州大学第五附属医院伦理委员会批准(批件号:2016-1001)。受试者监护人签署知情同意书。
1.2 基本信息所有受试儿童的母亲需完成关于基本情况的问卷:孕期抗生素使用、生产方式、喂养方式及儿童早期抗生素使用(6个月之内)。双盲下录入数据,进行后续分析。
1.3 粪便样品收集留取两组儿童新鲜粪便样本,迅速转运并进行分装。将200 mg粪便保存在粪便细菌DNA储存管中,-80℃储存留待16S rRNA测序。
1.4 DNA抽提和细菌16S rRNA基因扩增使用QIAamp Fast DNA Stool Mini试剂盒从200 mg粪便样品中提取微生物DNA。用NanoDrop 2000检测DNA的浓度和纯度。对16S rRNA基因的V3-V4区域(338F:5'-ACTCCTACGGGAGGCA-GCAG-3'和806R:5'-GGACTACHVGGGTWTCT-AAT-3')进行扩增。提取扩增子并使用AxyPrep DNA凝胶提取试剂盒进一步纯化和定量。
1.5 Illumina MiSeq测序根据Illumina MiSeq平台标准操作规程将纯化后的扩增片段构建PE 2×300的文库。原始序列经Trimmomatic质控过滤,用FLASH软件拼接。使用UPARSE(版本7.1,http://drive5.com/uparse/),根据97%的相似度对序列进行操作分类单元(operational taxonomic units, OTU)聚类;并用UCHIME软件鉴定剔除嵌合序列。使用RDP分类器算法(http://rdp.cme.msu.edu/)对序列进行物种分类注释,比对Silva(SSU123)数据库,设置比对阈值为70%。
1.6 生物信息学分析测序数据用美吉生物信息云平台进行分析。主坐标分析(principal co-ordinates analysis, PCoA)用Weight-UniFrac评估物种组成的差异性。LEfSe采用线性判别分析(LDA)估计差异丰富的分类群对差异效果的影响,并区分最具生物学特征的物种。
1.7 统计学分析使用SPSS 20.0统计软件对数据进行统计学分析。计量资料采用均数±标准差(x±s)表示,两组间比较采用了两样本t检验;不符合正态分布计量资料采用中位数(四分位间距)[M(P25,P75)]表示,两组间比较采用Wilcoxon检验。计数资料采用百分率(%)表示,两组间比较采用卡方检验。相关分析采用Spearman秩相关。P < 0.05为差异有统计学意义。
2 结果 2.1 两组儿童基本情况两组儿童在年龄和性别组成上比较差异无统计学意义(P > 0.05)。两组在母亲孕期抗生素使用及喂养方式上比较差异亦无统计学意义(P > 0.05)。在生产方式上,ASD组较健康对照组剖宫产率增高(P=0.035)。此外,ASD组儿童早期抗生素使用率高于健康对照组(P=0.015)。见表 1。
| 表 1 两组儿童基本情况比较 |
|
|
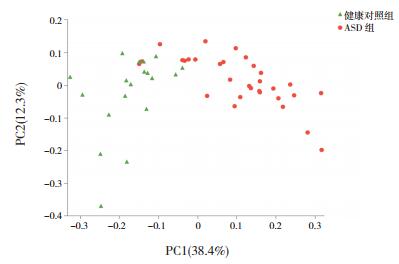
应用Wilcoxon's test对菌群进行α多样性分析显示:两组儿童在反映菌群丰富度指数(Sobs、Chao、Ace)上比较差异无统计学意义(P > 0.05)。在OTU水平,ASD儿童Shannon和Shannoneven指数较健康对照组显著降低(P < 0.05),提示ASD儿童粪便的物种多样性和均匀度降低(表 2)。此外,本研究在OTU水平应用Weighted-UniFrac距离算法进行PCoA分析(图 1),结果显示ASD组与健康对照组儿童肠道菌群的物种组成存在差异。
| 表 2 两组儿童α多样性指数比较[M(P25,P75)] |
|
|
|
图 1 两组儿童肠道菌群OTU水平PCoA分析 图中两组散点基本分离,提示ASD组与健康对照组儿童肠道菌群的物种组成存在差异。 |
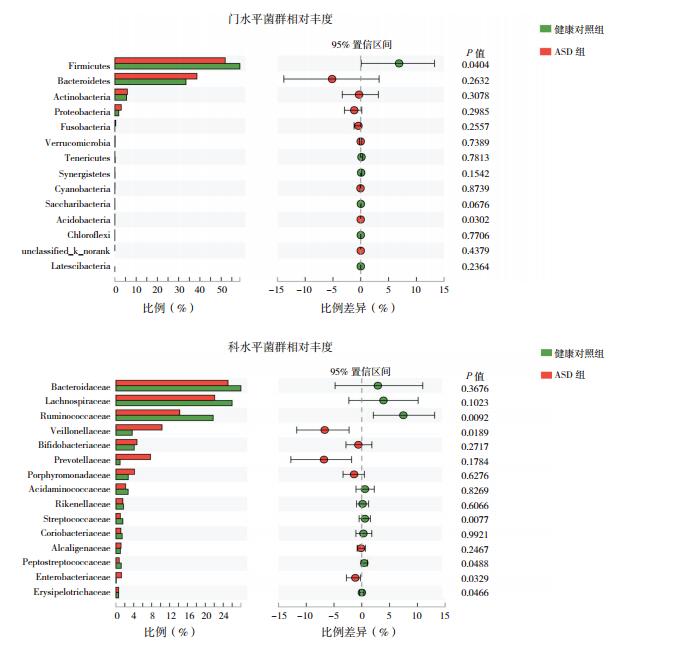
对两组儿童粪便菌群各分类群的平均相对丰度进行评估发现,在门水平,ASD组儿童粪便Firmicutes比例(51.91%)较健康对照组(58.82%)显著降低,而Acidobacteria比例(0.011%)较健康对照组(0.004%)显著增高(P < 0.05)。在科水平,两组儿童丰度最高的Bacteroidaceae比例相比较差异无统计学意义(P > 0.05)。与健康对照组相比,ASD儿童粪便Veillonellaceae、Enterobacteriaceae比例显著增高;而Ruminococcaceae、Streptococcaceae、Peptostre-ptococcaceae和Erysipelotrichaceae比例显著降低(P < 0.05)。见图 2。
|
图 2 两组儿童肠道菌群相对丰度 ASD组和健康对照组儿童肠道菌群在门水平(上)和科水平(下)的群落结构和相对丰度。 |
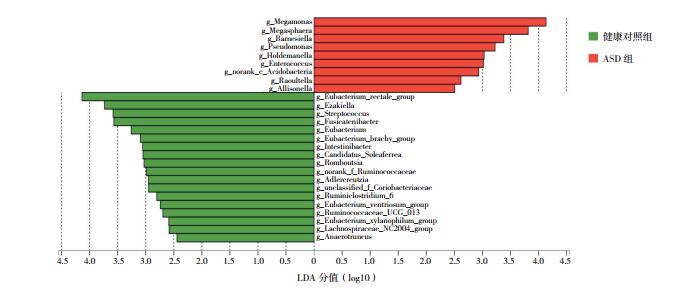
应用LEfSe分析两组菌群各成分的丰度差异并筛选优势菌群结果发现,在属水平,ASD儿童粪便的优势菌群为Megamonas、Megasphaera、Barnesiella、Pseudomonas等;而健康对照组儿童粪便的优势菌群为Eubacterium_rectale_group、Ezakiella、Streptococcus、Fusicatenibacter等。见图 3。
|
图 3 LEfSe分析两组儿童的优势菌群 LEfSe采用LDA分析物种丰度对差异效果的影响。ASD组的优势菌群为红色,健康对照组的优势菌群为绿色。LDA阈值为2.0。 |
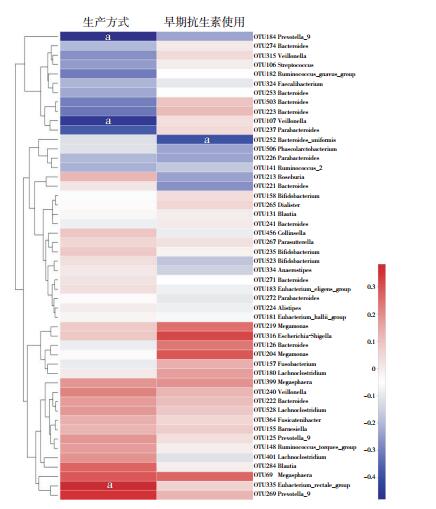
在OTU水平,将表 1中两组差异有统计学意义的分娩方式和早期抗生素使用与儿童肠道菌群进行Spearman相关分析发现,OTU252(Bacteroides_uniformis)与儿童早期抗生素使用呈负相关(rs=-0.393,P=0.039)。OTU184(Prevotella_9,rs=-0.480,P=0.010)和OTU107(Veillonella,rs=-0.452,P=0.016)与剖宫产相关,而OTU335(Eubacterium_rectale_group)与阴道分娩相关(rs=0.383,P=0.044)。见图 4。
|
图 4 两组儿童肠道菌群与分娩方式和早期抗生素使用的相关性分析 a示P < 0.05。 |
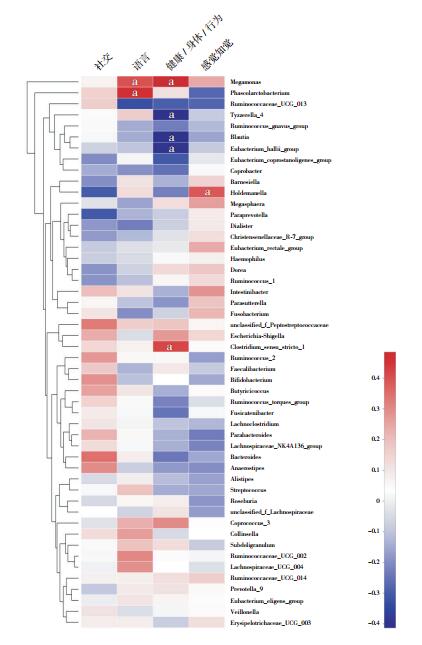
根据ATEC评估量表,ASD儿童行为症状的评分分别为:语言(18±4)、社交(28±4)、感觉知觉(23±4)和健康/身体/行为(31±6)。在属水平,用Spearman相关分析ASD儿童肠道细菌丰度与行为症状严重程度的相关性。结果显示:Clostridium_sensu_stricto_1(rs=0.419,P=0.030)、Megamonas(rs=0.485,P=0.010)与健康/身体/行为评分呈正相关;Tyzzerella_4(rs=-0.413,P=0.032)、Blautia(rs=-0.410,P=0.034)、Eubacterium_hallii_group(rs=-0.405,P=0.036)与健康/身体/行为评分呈负相关。Megamonas(rs=0.400,P=0.039)和Phascolarctobacterium(rs=0.463,P=0.015)与语言评分呈正相关。Holdemanella(rs=0.390,P=0.045)与感觉知觉评分呈正相关。暂未发现在属水平上与社交评分相关的肠道菌群。见图 5。
|
图 5 ASD组儿童肠道菌群与行为症状严重程度的相关性分析 a示P < 0.05。 |
越来越多的证据表明,肠道微生物菌群对新生儿及儿童阶段的生长发育起重要作用[12]。出生时儿童肠道是无菌的,之后开始出现微生物的定植,并受到分娩方式、喂养方式、饮食、抗生素使用和环境因素的影响[13]。本研究结果显示:ASD儿童剖宫产率和早期抗生素使用率较健康对照组增高,阴道分娩率较健康对照组降低,表明剖宫产和早期抗生素使用可能是ASD发病的危险因素。本研究中剖宫产儿童肠道Bacteroides_uniformis比例较阴道分娩儿童降低,Prevotella_9和Veillonella比例较阴道分娩儿童升高,结果与Hesla等[14]的结果相似,该研究表明剖宫产的儿童肠道Bacteroides和Bifidobacterium比例较阴道分娩儿童下降,而Veillonella比例较阴道分娩儿童升高。此外,Rigsbee等[15]发现肠易激综合征儿童肠道Veillonella和Prevotella水平较健康对照组升高。
在出生后1年中,婴儿的肠道微生物结构趋于稳定。本研究发现ASD儿童肠道菌群的物种均匀性和多样性较健康对照组儿童降低,且两组儿童肠道菌群在物种组成上存在显著差异。在门水平,肠道菌群以Fimicutes和Bacteroidetes为主,其次为Actinobacteria和Proteobacteria,与参考文献[16]结果一致;ASD儿童肠道菌群Fimicutes比例较健康对照组显著降低,而Acidobacteria比例较健康对照组显著升高。具体来说,隶属于Fimicutes的Peptostreptococcaceae、Streptococcaceae、Ruminococcaceae、Eubacterium和Lachnospiraceae_NC2004_group在ASD儿童的肠道菌群中比例降低。Barcenilla等[17]的研究发现Ruminococcaceae、Eubacterium_rectale_group和Lachnospiraceae为产丁酸菌群,属于Clostridium菌群IV和XIVa。其他Clostridium菌群也可以产生丁酸,相对于Clostridium菌群IV和XIVa的产丁酸效率低。此外,Estaki等[18]研究表明Erysipelotrichacea也是产丁酸的关键菌之一。综上所述,本研究表明ASD儿童产丁酸细菌比例较健康对照组降低。
丁酸属于短链脂肪酸,是肠道微生物厌氧发酵的重要代谢产物之一。大量研究表明丁酸与肠黏膜通透性[19]、血脑屏障功能、大脑功能及行为相关[20]。Adams等[21]发现ASD儿童粪便中短链脂肪酸水平较正常儿童降低。丁酸作为组蛋白脱乙酰酶-1(HDAC-1)抑制剂,可通过调节TWIK相关的钾通道-1(Trek-1)恢复肠上皮黏膜屏障功能[22]。Rose等[23]研究表明丁酸能够改善ASD细胞模型中的氧化应激反应,增强线粒体功能。此外,丁酸还可以调节ASD动物模型额叶皮质内抑制/兴奋基因的转录并改善其行为症状[24]。
本研究发现肠道菌群与ASD儿童行为症状的严重程度相关。Megamonas比例在ASD儿童中明显增高,且与健康/身体/行为和语言障碍的严重程度均呈正相关。本研究结果为应用菌群移植治疗ASD提供了一定的理论依据。目前关于Megamonas的研究仍较少,Geng等[25]表明Megamonas比例在Wilson病患者中较健康对照组明显升高;Kieler等[26]发现的肠道中Megamonas的丰度与肥胖犬减重的速度呈负相关。而关于Megamonas在微生态-脑-肠轴和ASD中的具体作用机制仍需进一步研究。
总之,本研究发现ASD儿童与健康对照组儿童肠道微生态结构存在显著差异。儿童肠道菌群与分娩方式、早期抗生素使用和ASD行为症状的严重程度均相关。应用微生态调节剂调整肠道菌群,可能是治疗ASD的有效方法。
| [1] |
Lai MC, Lombardo MV, Baron-Cohen S. Autism[J]. Lancet, 2014, 383(9920): 896-910. DOI:10.1016/S0140-6736(13)61539-1 (  0) 0) |
| [2] |
Fombonne E. Epidemiology of pervasive developmental disorders[J]. Pediatr Res, 2009, 65(6): 591-598. DOI:10.1203/PDR.0b013e31819e7203 (  0) 0) |
| [3] |
Baio J, Wiggins L, Christensen DL, et al. Prevalence of autism spectrum disorder among children aged 8 years-Autism and Developmental Disabilities Monitoring Network, 11 Sites, United States, 2014[J]. MMWR Surveill Summ, 2018, 67(6): 1-23. DOI:10.15585/mmwr.ss6706a1 (  0) 0) |
| [4] |
Hadjkacem I, Ayadi H, Turki M, et al. Prenatal, perinatal and postnatal factors associated with autism spectrum disorder[J]. J Pediatr (Rio J), 2016, 92(6): 595-601. DOI:10.1016/j.jped.2016.01.012 (  0) 0) |
| [5] |
Maynard CL, Elson CO, Hatton RD, et al. Reciprocal interactions of the intestinal microbiota and immune system[J]. Nature, 2012, 489(7415): 231-241. DOI:10.1038/nature11551 (  0) 0) |
| [6] |
de la Cochetiere MF, Piloquet H, des Robert C, et al. Early intestinal bacterial colonization and necrotizing enterocolitis in premature infants:the putative role of Clostridium[J]. Pediatr Res, 2004, 56(3): 366-370. DOI:10.1203/01.PDR.0000134251.45878.D5 (  0) 0) |
| [7] |
Kelly JR, Minuto C, Cryan JF, et al. Cross talk:the microbiota and neurodevelopmental disorders[J]. Front Neurosci, 2017, 11: 490. DOI:10.3389/fnins.2017.00490 (  0) 0) |
| [8] |
Kamp-Becker I, Albertowski K, Becker J, et al. Diagnostic accuracy of the ADOS and ADOS-2 in clinical practice[J]. Eur Child Adolesc Psychiatry, 2018, 27(9): 1193-1207. DOI:10.1007/s00787-018-1143-y (  0) 0) |
| [9] |
Fitzgerald M. The clinical utility of the ADI-R and ADOS in diagnosing autism[J]. Br J Psychiatry, 2017, 211(2): 117. (  0) 0) |
| [10] |
卢建平, 杨志伟, 舒明耀, 等. 儿童孤独症量表评定的信度、效度分析[J]. 中国现代医学杂志, 2004, 14(13): 119-121. DOI:10.3969/j.issn.1005-8982.2004.13.037 (  0) 0) |
| [11] |
李建华, 钟建民, 蔡兰云, 等. 三种儿童孤独症行为评定量表临床应用比较[J]. 中国当代儿科杂志, 2005, 7(1): 59-62. DOI:10.3969/j.issn.1008-8830.2005.01.016 (  0) 0) |
| [12] |
Slattery J, MacFabe DF, Frye RE. The significance of the enteric microbiome on the development of childhood disease:a review of prebiotic and probiotic therapies in disorders of childhood[J]. Clin Med Insights Pediatr, 2016, 10: 91-107. (  0) 0) |
| [13] |
Sekirov I, Russell SL, Antunes LC, et al. Gut microbiota in health and disease[J]. Physiol Rev, 2010, 90(3): 859-904. DOI:10.1152/physrev.00045.2009 (  0) 0) |
| [14] |
Hesla HM, Stenius F, Jaderlund L, et al. Impact of lifestyle on the gut microbiota of healthy infants and their mothers -the ALADDIN birth cohort[J]. FEMS Microbiol Ecol, 2014, 90(3): 791-801. DOI:10.1111/fem.2014.90.issue-3 (  0) 0) |
| [15] |
Rigsbee L, Agans R, Shankar V, et al. Quantitative profiling of gut microbiota of children with diarrhea-predominant irritable bowel syndrome[J]. Am J Gastroenterol, 2012, 107(11): 1740-1751. DOI:10.1038/ajg.2012.287 (  0) 0) |
| [16] |
Human Microbiome Project Consortium. Structure, function and diversity of the healthy human microbiome[J]. Nature, 2012, 486(7402): 207-214. DOI:10.1038/nature11234 (  0) 0) |
| [17] |
Barcenilla A, Pryde SE, Martin JC, et al. Phylogenetic relationships of butyrate-producing bacteria from the human gut[J]. Appl Environ Microbiol, 2000, 66(4): 1654-1661. DOI:10.1128/AEM.66.4.1654-1661.2000 (  0) 0) |
| [18] |
Estaki M, Pither J, Baumeister P, et al. Cardiorespiratory fitness as a predictor of intestinal microbial diversity and distinct metagenomic functions[J]. Microbiome, 2016, 4(1): 42. DOI:10.1186/s40168-016-0189-7 (  0) 0) |
| [19] |
Wang HB, Wang PY, Wang X, et al. Butyrate enhances intestinal epithelial barrier function via up-regulation of tight junction protein Claudin-1 transcription[J]. Dig Dis Sci, 2012, 57(12): 3126-3135. DOI:10.1007/s10620-012-2259-4 (  0) 0) |
| [20] |
Sherry CL, Kim SS, Dilger RN, et al. Sickness behavior induced by endotoxin can be mitigated by the dietary soluble fiber, pectin, through up-regulation of IL-4 and Th2 polarization[J]. Brain Behav Immun, 2010, 24(4): 631-640. DOI:10.1016/j.bbi.2010.01.015 (  0) 0) |
| [21] |
Adams JB, Johansen LJ, Powell LD, et al. Gastrointestinal flora and gastrointestinal status in children with autism -comparisons to typical children and correlation with autism severity[J]. BMC Gastroenterol, 2011, 11: 22. DOI:10.1186/1471-230X-11-22 (  0) 0) |
| [22] |
Huang H, Liu JQ, Yu Y, et al. Regulation of TWIK-related potassium channel-1(Trek1) restitutes intestinal epithelial barrier function[J]. Cell Mol Immunol, 2016, 13(1): 110-118. DOI:10.1038/cmi.2014.137 (  0) 0) |
| [23] |
Rose S, Bennuri SC, Davis JE, et al. Butyrate enhances mitochondrial function during oxidative stress in cell lines from boys with autism[J]. Transl Psychiatry, 2018, 8(1): 42. DOI:10.1038/s41398-017-0089-z (  0) 0) |
| [24] |
Kratsman N, Getselter D, Elliott E. Sodium butyrate attenuates social behavior deficits and modifies the transcription of inhibitory/excitatory genes in the frontal cortex of an autism model[J]. Neuropharmacology, 2016, 102: 136-145. DOI:10.1016/j.neuropharm.2015.11.003 (  0) 0) |
| [25] |
Geng H, Shu S, Dong J, et al. Association study of gut flora in Wilson's disease through high-throughput sequencing[J]. Medicine (Baltimore), 2018, 97(31): e11743. DOI:10.1097/MD.0000000000011743 (  0) 0) |
| [26] |
Kieler IN, Shamzir Kamal S, Vitger AD, et al. Gut microbiota composition may relate to weight loss rate in obese pet dogs[J]. Vet Med Sci, 2017, 3(4): 252-262. DOI:10.1002/vms3.2017.3.issue-4 (  0) 0) |
 2019, Vol. 21
2019, Vol. 21


