联合垂体激素缺乏症(combined pituitary hormone deficiency, CPHD)是一类以生长激素缺乏伴随一种至多种垂体前叶激素缺乏为特征的疾病。CPHD可由下丘脑-垂体区获得性病变如肿瘤、创伤等引起,也可以是原发性的[1]。联合垂体激素缺乏Ⅰ型(CPHD1,OMIM 613038)是由位于3p11.2的Ⅰ级POU结构域转录因子1(POU1F1,亦称PIT-1基因,OMIM 713110)基因变异引起的疾病,为常染色体隐性或显性遗传,是遗传性CPHD中的一种,其临床表现缺乏特异性,主要表现为生长激素(growth hormone, GH)、催乳素(prolactin, PRL)、促甲状腺激素(thyroid-stimulating hormone, TSH)的多效性缺陷[2],可表现为身材矮小、婴儿期严重全面发育迟缓、前额突出、面中线发育不良、眼球内陷、短鼻、巨舌、前囟未闭、新生儿黄疸、垂体前叶或全垂体发育不良、智力障碍等。尽管POU1F1基因突变导致的CPHD1早已被报道,但其遗传方式、流行病学特点、治疗方案、长期预后尚不完全明确,现报道1例确诊CPHD1患儿的临床资料及遗传学特点,为该病的诊治提供参考。
1 资料与方法 1.1 研究对象患儿女,2岁3个月,因身高增长缓慢2年余入院。生后3月时身长明显落后于同龄儿童,身长增长极缓慢,生后第1年增长约12 cm,生后第2年增长5 cm,语言及智力发育可,无呕吐、便秘等不适症状。此后近2年就诊于多家医院,查头颅及垂体MRI平扫增强示垂体前叶小,垂体柄细,位置略左偏,枕骨斜坡短小;甲状腺彩超示甲状腺体积偏小,血彩稀少;心脏彩超示肺动脉狭窄,卵圆孔未闭;染色体核型检查无异常。患儿出生后1周查甲状腺功能示TSH 0.005 μIU/mL(参考值:0.43~16.1 μIU/mL)、游离三碘甲状腺原氨酸(FT3)1.42 pmol/L(参考值:3.0~8.1 pmol/L)、游离甲状腺素(FT4)3.4 pmol/L(参考值:10.6~39.8 pmol/L),外院诊断考虑“先天性甲状腺功能减退症”,予口服左甲状腺素钠片治疗,1月后复查TSH 0.01 μIU/mL,FT3 5.2 pmol/L,FT4 12.24 pmol/L,此后继续口服左甲状腺素钠片治疗,定期随访TSH低于正常参考值,FT3、FT4正常。患儿系第1胎第1产,孕40周因胎位不正剖宫产娩出,出生时无窒息史,出生体重3.2 kg,身长50 cm,3月龄会抬头,5~6月龄会翻身,8月龄会坐,1岁会喊爸爸妈妈,1岁3个月会走路。父母非近亲结婚,父亲身高168 cm,母亲身高155 cm,否认家族中有类似病史。
入院查体:身长68 cm(-5.8 SD),体重6.5 kg(-4.16 SD),头围48 cm(-1.7 SD),发育迟缓,身体比例匀称,皮肤松弛,前囟未闭(0.5 cm×0.5 cm),前额突出,眼球内陷,下颌短小,心前区无隆起,心尖搏动点位于第4肋间左锁骨中线外0.5 cm处,心前区及各瓣膜区未触及震颤,心界无扩大,心率110次/分,律齐,胸骨左缘第2~3肋间可闻及3/6级收缩期吹风样杂音,肺腹部检查未见异常,病理征阴性。
辅助检查:血糖3.60 mmol/L(参考值:3.9~6.1 mmol/L)。甲状腺功能:TSH 0.02 μIU/mL(参考值:0.54~4.53 μIU/mL),FT3、FT4正常。精氨酸及左旋多巴两药GH激发试验示GH激发峰值为0.12 μg/L(参考值:< 5 μg/L为完全缺乏),为完全性GH缺乏。PRL 0.48 μg/L(参考值:4~21.30 μg/L),胰岛素样生长因子-1(IGF-1) < 25 μg/L(参考值:51~303 μg/L),胰岛素样生长因子结合蛋白-3(IGFBP-3) < 0.5 mg/L(参考值:0.8~3.9 mg/L)。血常规、大小便常规、肝功能、肾功能、乙肝全套、促肾上腺皮质激素、皮质醇、微量元素、骨碱性磷酸酶、糖化血红蛋白均正常。左手腕X线示骨龄约1岁。
1.2 致病基因检测取得患儿父母知情同意后,采集患儿及其父母外周静脉血各2 mL,送智因东方转化医学研究中心行家系全外显子组测序分析。提取基因组DNA,应用Illumina公司NovaSeq 6000系列测序仪进行全外显子高通量测序,采用软件Bcl To Fastq进行基本处理和碱基信息读取,得到原始数据,使用GATK软件分析得到SNP、Indel,行SNP、Indel分析,获得高质量的突变位点信息。在人类在线孟德尔遗传数据库(OMIM, http://omim.org)、人类基因突变数据库(HGMD, http://www.hgmd.cf.ac.uk)、ClinVar数据库(https://www.ncbi.nlm.nih.gov/clinvar)中查找变异位点导致疾病相关性收录情况,采用PROVEAN、PolyPhen-2、MutationTaster和SIFT软件预测变异对蛋白结构的影响及致病性,在单核苷酸多态性数据库(dbSNP, http://www.ncbi.nlm.nih.gov/SNP)、千人基因组(http://www.internationalgenome.org)、ExAC数据库(http://exac.broadinstitute.org)等人群数据库查找变异位点分布频率。参考美国医学遗传学与基因组学学会(American College of Medical Genetics and Genomics, ACMG)序列变异解读标准和指南[3]对变异位点进行致病性综合评估。
根据高通量测序检测到的POU1F1基因致病变异位点序列,采用Oligo 7软件对目标位点的上下游区域设计引物,第6外显子突变位点扩增引物序列为chr3:F: 5'-CCCTACTTAATGCTTTCCG-TGAC-3',R: 5'-AAAGTGGAAAAGTAAAGCTTCTG-T-3',引物由上海捷瑞生物公司合成,以基因组DNA为模板,使用Taq DNA聚合酶扩增。PCR产物经纯化后,用ABI 3730XL测序仪双向测序,测序结果用Chromas(version2.23)软件进行分析,并与正常序列(NM_001122757)比对。
2 结果 2.1 基因检测结果及致病性分析全外显子组测序发现患儿的POU1F1基因存在第6外显子区的c.889C > T杂合变异,经Sanger测序验证,父母该位点为野生型,符合常染色体显性遗传(图 1)。此变异在dbSNP、千人基因组、ExAC正常人群数据库中未见收录,c.889C > T变异导致第297位密码子发生CGG > TGG改变,编码的氨基酸由精氨酸变为色氨酸,PROVEAN、PolyPhen-2、SIFT、MutationTaster等软件预测均为可能有害,在OMIM、HGMD、ClinVar数据库中均无报道。经ACMG指南综合评估:c.889C > T为可能致病性变异。结合患儿GH及TSH完全缺乏及PRL降低等临床表现,确诊为POU1F1基因变异所致CPHD1。
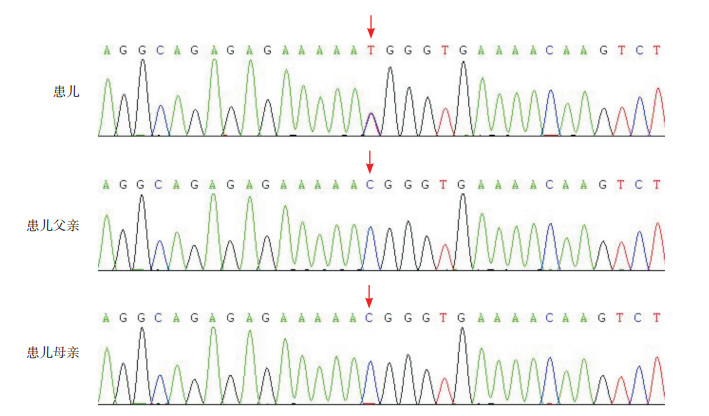
|
图 1 患儿及其父母POU1F1基因Sanger测序图 患儿存在POU1F1基因c.889C>T杂合突变,父母均无携带突变。突变位点如箭头所示。 |
根据患儿临床表现、实验室检查及基因测序结果,诊断为CPHD1。明确诊断后予聚乙二醇化重组人生长激素(polyethylene glycol recombinant human growth hormone, PEG-rhGH)(每次0.14 mg/kg,皮下注射,每周1次)及左甲状腺素钠片联合治疗。出院后每3个月随诊1次(相关指标动态监测见表 1),治疗1年身高增长19.8 cm。治疗过程中监测血糖、胰岛素、甲状腺激素、IGF-1、IGFBP-3均正常。目前仍继续予PEG-rhGH(每次0.1~0.2 mg/kg)及左甲状腺素钠片(每次2.5~3.5 μg/kg)治疗,治疗剂量均根据体重、疗效及监测指标调整,远期疗效及PEG-rhGH治疗安全性有待进一步追踪。
| 表 1 应用PEG-rhGH治疗前后患儿各指标及药物剂量变化 |
|
|
CPHD病因包括遗传性和非遗传性两类。据统计CPHD在全世界发病率约为1/8 000(https://ghr.nlm.nih.gov/condition/combined-pituitary-hormone-deficiency),大多数病例为散发,家族遗传约占5%~30%。遗传性CPHD与调控胚胎垂体前叶细胞增殖、分化的转录因子以及信号分子的复杂级联有关,任一环节病变都可能导致孤立垂体激素缺乏症或者CPHD[4]。Tatsumi等[5]在1992年首次报道了1例人类PIT-1基因变异(R172X)导致的CPHD,该患儿因呆小症就诊,其父母非近亲结婚,被发现有TSH、GH、PRL缺乏。迄今为止,近30个与CPHD相关的基因被发现[6],其中研究较多的有POU1F1、PROP1、GLI2、LHX3、LHX4、HESX1、PITX2、SOX2、SOX3、OTX2、TBX19等基因[7-9],以及近来发现的SLC20A1和SLC15A4基因也存在关联[10],其中POU1F1和PROP1基因变异所致的CPHD约占目前已知基因的50%。然而这些编码垂体转录因子的基因突变频率在不同人群中有很大差异[11-12],国内未见相关报道,据统计,在全球范围内POU1F1、PROP1、LHX3、LHX4、HESX1的突变率为12.4%,从散发病例中的11.2%到家族性病例中的63%不等[13],并且明确的遗传机制尚不清楚,这表明与CPHD病因相关的潜在基因仍需被识别[6],国内在人群中研究CPHD遗传因素的报道极少。
POU1F1基因是POU家族(一类与垂体相关转录因子的总称)的成员之一,是重要的组织特异性垂体转录因子[14-15],包含6个外显子和5个内含子,编码POU1F1蛋白。POU1F1蛋白包含3个功能区:氨基端转录激活区(TAD)、羧基端POU同源区(POU-HD)和POU特异结构区(POU-S),TAD负责转录激活,可划分为R1和R2两个亚区,分别由外显子1和2编码,后两者是识别并结合特异性DNA序列的区域[16-18],其主要调控生长激素细胞、促甲状腺素细胞、催乳素细胞的细胞特异性基因表达,从而影响GH、PRL、TSH的表达,而垂体可表现为正常或发育不良[15]。目前在哺乳动物(包括人类)中已经发现3个POU1F1蛋白异构体,主要异构体POU1F1-α(291个氨基酸),由于外显子2的选择性剪切作用,致使在R1和R2亚区之间插入额外的氨基酸残基,产生2个次要异构体POU1F1-β(317个氨基酸)和PIT-1T(305个氨基酸),其余编码结构无差别[17, 19],且不同变异位点可出现不同程度垂体激素缺乏[20]。迄今为止,在全球CPHD患者中已发现超过30种POU1F1突变(http://www.hgmd.cf.ac.uk),其中大多数为隐性遗传,少数为显性遗传(P14L、P24L、Q167K、K216E和R271W),且R271W一直是高频突变位点,男性发病率高于女性[21]。本例c.889C > T(p.R297W)为新杂合变异,位于第6外显子上,导致第297位氨基酸改变,从而影响POU1F1蛋白的功能表达,为可能致病性变异,既往未见报道。结合患儿GH、TSH、PRL的完全缺乏,并伴有前额突出、眼球内陷、下颌短小、皮肤松弛、前囟未闭、垂体发育不良等临床特征,从而确诊为CPHD1。但患儿胸骨左缘第2~3肋间可闻及3/6级收缩期吹风样杂音,心脏彩超示肺动脉狭窄、卵圆孔未闭,并不包括在CPHD常见特征内,既往报道POU1F1基因与听力损害有关,具体机制尚不明确[22],因此POU1F1基因变异是否与心脏发育有关,其机制也有待进一步明确。
对于CPHD目前尚无统一的治疗标准,内科治疗主要采用激素替代治疗,治疗前需排除禁忌症,如补充生长激素前需除外肿瘤、糖尿病合并视网膜病变、骨骺闭合等情况。本例患儿出生后一直予口服左甲状腺素钠片,定期复查血清甲状腺素维持在正常范围内,2岁3个月开始规律皮下注射PEG-rhGH,目前身高呈追赶性增长趋势,智力发育正常,远期预后有待进一步随访观察。
综上所述,本文报道1例POU1F1基因新变异导致CPHD1患儿,临床主要表现为身材矮小,GH、TSH、PRL缺乏,垂体MRI提示垂体发育不良,临床诊断为CPHD。新变异c.889C > T(p.R297W)的发现为确诊和家系遗传咨询提供了遗传学依据。本研究进一步丰富了POU1F1基因的突变谱,也对联合垂体激素缺乏的诊断与分型有重要意义,对于CPHD的诊断与治疗有一定的参考价值。
| [1] |
Otto AP, França MM, Correa FA, et al. Frequent development of combined pituitary hormone deficiency in patients initially diagnosed as isolated growth hormone deficiency:a long term follow-up of patients from a single center[J]. Pituitary, 2015, 18(4): 561-567. DOI:10.1007/s11102-014-0610-9 (  0) 0) |
| [2] |
Turton JP, Strom M, Langham S, et al. Two novel mutations in the POU1F1 gene generate null alleles through different mechanisms leading to combined pituitary hormone deficiency[J]. Clin Endocrinol (Oxf), 2012, 76(3): 387-393. DOI:10.1111/j.1365-2265.2011.04236.x (  0) 0) |
| [3] |
Richards S, Aziz N, Bale S, et al. Standards and guidelines for the interpretation of sequence variants:a joint consensus recommendation of the American College of Medical Genetics and Genomics and the Association for Molecular Pathology[J]. Genet Med, 2015, 17(5): 405-424. DOI:10.1038/gim.2015.30 (  0) 0) |
| [4] |
Bertko E, Klammt J, Dusatkova P, et al. Combined pituitary hormone deficiency due to gross deletions in the POU1F1(PIT-1) and PROP1 genes[J]. J Hum Genet, 2017, 62(8): 755-762. DOI:10.1038/jhg.2017.34 (  0) 0) |
| [5] |
Tatsumi K, Miyai K, Notomi T, et al. Cretinism with combined hormone deficiency caused by a mutation in the PIT1 gene[J]. Nat Genet, 1992, 1(1): 56-58. DOI:10.1038/ng0492-56 (  0) 0) |
| [6] |
Fang Q, George AS, Brinkmeier ML, et al. Genetics of combined pituitary hormone deficiency:roadmap into the genome era[J]. Endocr Rev, 2016, 37(6): 636-675. DOI:10.1210/er.2016-1101 (  0) 0) |
| [7] |
Bancalari RE, Gregory LC, McCabe MJ, et al. Pituitary gland development:an update[J]. Endocr Dev, 2012, 23: 1-15. DOI:10.1159/000341733 (  0) 0) |
| [8] |
Davis SW, Ellsworth BS, Peréz Millan MI, et al. Pituitary gland development and disease:from stem cell to hormone production[J]. Curr Top Dev Biol, 2013, 106: 1-47. DOI:10.1016/B978-0-12-416021-7.00001-8 (  0) 0) |
| [9] |
Pfäffle R, Klammt J. Pituitary transcription factors in the aetiology of combined pituitary hormone deficiency[J]. Best Prac Res Clin Endocrinol Metab, 2011, 25(1): 43-60. DOI:10.1016/j.beem.2010.10.014 (  0) 0) |
| [10] |
Simm F, Griesbeck A, Choukair D, et al. Identification of SLC20A1 and SLC15A4 among other genes as potential risk factors for combined pituitary hormone deficiency[J]. Genet Med, 2018, 20(7): 728-736. DOI:10.1038/gim.2017.165 (  0) 0) |
| [11] |
Elizabeth M, Hokken-Koelega ACS, Schuilwerve J, et al. Genetic screening of regulatory regions of pituitary transcription factors in patients with idiopathic pituitary hormone deficiencies[J]. Pituitary, 2018, 21(1): 76-83. (  0) 0) |
| [12] |
Birla S, Khadgawat R, Jyotsna VP, et al. Identification of novel PROP1 and POU1F1 mutations in patients with combined pituitary hormone deficiency[J]. Horm Metab Res, 2016, 48(12): 822-827. DOI:10.1055/s-0042-117112 (  0) 0) |
| [13] |
De Rienzo F, Mellone S, Bellone S, et al. Frequency of genetic defects in combined pituitary hormone deficiency:a systematic review and analysis of a multicentre Italian cohort[J]. Clin Endocrinol (Oxf), 2015, 83(6): 849-860. DOI:10.1111/cen.12849 (  0) 0) |
| [14] |
Kelberman D, Dattani MT. Hypopituitarism oddities:congenital causes[J]. Horm Res, 2007, 68(Suppl 5): 138-144. (  0) 0) |
| [15] |
Andersen B, Rosenfeld MG. POU domain factors in the neuroendocrine system:lessons from developmental biology provide insights into human disease[J]. Endocr Rev, 2001, 22(1): 2-35. (  0) 0) |
| [16] |
Theill LE, Hattori K, Lazzaro D, et al. Differential splicing of the GHF1 primary transcript gives rise to two functionally distinct homeodomain proteins[J]. EMBO J, 1992, 11(6): 2261-2269. DOI:10.1002/embj.1992.11.issue-6 (  0) 0) |
| [17] |
Jonsen MD, Duval DL, Gutierrez-Hartmann A. The 26-amino acid β-motif of the Pit-1β transcription factor is a dominant and independent repressor domain[J]. Mol Endocrinol, 2009, 23(9): 1371-1384. DOI:10.1210/me.2008-0137 (  0) 0) |
| [18] |
Konzak KE, Moore DD. Functional isoforms of Pit-1 generated by alternative messenger RNA splicing[J]. Mol Endocrinol, 1992, 6(2): 241-247. (  0) 0) |
| [19] |
Haugen BR, Gordon DF, Nelson AR, et al. The combination of Pit-1 and Pit-1T have a synergistic stimulatory effect on the thyrotropin β-subunit promoter but not the growth hormone or prolactin promoters[J]. Mol Endocrinol, 1994, 8(11): 1574-1582. (  0) 0) |
| [20] |
Inoue H, Mukai T, Sakamoto Y, et al. Identification of a novel mutation in the exon 2 splice donor site of the POU1F1/PIT-1 gene in Japanese identical twins with mild combined pituitary hormone deficiency[J]. Clin Endocrinol (Oxf), 2012, 76(1): 78-87. DOI:10.1111/cen.2011.76.issue-1 (  0) 0) |
| [21] |
Cohen LE, Wondisford FE, Salvatoni A, et al. A "hot spot" in the the Pit-1 gene responsible for combined pituitary hormone deficiency:clinical and molecular correlates[J]. J Clin Endocrinol Metab, 1995, 80(2): 679-684. (  0) 0) |
| [22] |
Mortensen AH, Fang Q, Fleming MT, et al. Genetic variation in thyroid folliculogenesis influences susceptibility to hypothyroidism-induced hearing impairment[J]. Mamm Genome, 2019, 30(1-2): 5-22. DOI:10.1007/s00335-019-09792-6 (  0) 0) |
 2019, Vol. 21
2019, Vol. 21


