2. 湖南中医药大学, 湖南 长沙 410007
炎症性肠病(inflammatory bowel disease, IBD)主要包括溃疡性结肠炎(ulcerative colitis, UC)、克罗恩病(Crohn's disease, CD),病因未明,发病机制复杂。近年来随着人们生活水平、检查手段及诊断水平的不断提高,IBD在我国的发病率呈上升趋势,其中确诊IBD的学龄前及学龄儿童日益增多。鉴于其发病机制尚不明确,病情易反复发作,传统治疗疗效一般,探究IBD的发病机制并进一步寻找新的治疗手段成为IBD研究的热点。
IL-10是一种多功能细胞因子,它是由多种活化的免疫细胞产生,包括Th2细胞、调节性T细胞、自然杀伤细胞、B细胞、单核细胞和巨噬细胞。IL-10被认为是一种免疫调节细胞因子,能有效抑制多种促炎因子及其他炎症介质,并已证实其直接参与了IBD的发病[1]。IL-10基因编码抗炎细胞因子,IL-10/STAT3信号通路在控制炎症和保护肠组织免受损伤方面发挥重要作用。在IL-10信号转导期间,IL-10与受体IL10RA和IL10RB结合,并激活Jak1和Tyk2,导致STAT3的磷酸化。激活的STAT3易位到细胞核中并调节靶基因转录以促进抗炎反应[2]。极早发IBD与IL-10、IL-10受体IL10RA和IL10RB的突变有关[3-4]。Lin等[5]研究发现除了IL-10基因本身,IL-10/STAT3信号传导途径中基因间上位相互作用,均可增加IBD的发生风险。敲除IL-10基因的小鼠最终可发展为IBD[6]。IL-10已被鉴定为儿童和成人IBD相关基因[7-8]。
骨髓间充质干细胞(mesenchymal stem cells, MSCs)具有较强的免疫抑制特性,目前MSCs移植被成功应用于循环系统、消化系统、骨关节等严重自身免疫相关疾病的治疗中[9]。MSCs可通过其分泌的多种细胞因子(转化生长因子、肝细胞生长因子)、NO、前列腺素、吲哚胺2, 3加双氧酶等,以及细胞间的直接接触作用抑制T细胞的增殖[10]。此外,MSCs也可以通过影响树突细胞的分化、成熟过程间接地发挥对T细胞的抑制作用。抑制Th1细胞反应可能直接作用于效应性T细胞,MSCs优先局限于损伤或炎症肠段,基于一系列特定的细胞因子受体的表达,参与炎症组织的细胞转移,并通过产生各种再生因子修复损伤组织。MSCs全身输注后,损伤的结肠组织中Ki67和Lgr5显著增加,说明MSCs可促进肠上皮细胞的分化和增殖[11]。在小鼠结肠炎模型中,MSCs显示出直接抑制树突细胞和巨噬细胞的抗原呈递功能,使其趋向于致耐受性表型,IL-10分泌增加,并有利于调节性T细胞诱导。另外静脉注射MSCs显著降低了结肠损伤和NF-κB活性,伴随着促炎细胞因子的减少和IL-10的增加[12-15]。总之,这些研究发现表明MSCs在结肠炎中发挥干细胞性和免疫抑制功能,以及其与IL-10之间密不可分的联系。
综上所述,本课题组拟使用IL-10基因转化的MSCs对大鼠结肠炎模型进行移植治疗,探讨IL-10基因转化的MSCs的疗效及其安全性和可靠性,为此本研究首先构建了携带大鼠IL-10(rIL-10)基因的腺病毒载体,并检测其在大鼠MSCs中的表达情况,以备下一步的研究。
1 材料与方法 1.1 质粒及病毒载体大鼠质粒IL-10、腺病毒载体购自美国BD公司。人胚肾细胞系HEK293细胞由本实验室保存。
1.2 大鼠MCSs的分离与培养取成年Sprague-Dawley(SD)大鼠,颈椎脱臼处死,无菌条件下分离并截取双侧胫骨和股骨,抽取骨髓细胞,骨髓冲洗液用Percoll分离液进行分离,并收集骨髓细胞。将骨髓细胞接种于含有10%胎牛血清的DMEM低糖培养液培养瓶中,置于37℃、饱和湿度、5%CO2的培养箱中培养,定时换液,待细胞克隆完全形成后,胰蛋白酶消化传代。
1.3 rIL-10引物上游:5'-GGCAGATCTATGCTTGGCTCAGCAC-TG-3',含Bgl Ⅱ酶切位点;下游:5'-GCGATATCC-CTGCAGTCCAGTAGACG-3',含EcoR V酶切位点,扩增片断长度为656 bp。引物自行设计,合成由上海吉凯基因化学技术有限公司完成。
1.4 含rIL-10基因重组腺病毒载体的构建rIL-10质粒上IL-10序列两端带有Bgl Ⅱ和EcoR V酶切位点,用rIL-10引物行聚合酶链式反应(polymerase chain reaction, PCR)扩增rIL-10 cDNA序列。反应体系:10×Buffer 2 μL,dNTP 1.6 μL,上、下游引物各1.6 μL,Tag酶1 μL,模板DNA 2 μL,ddH2O补足至20 μL。反应条件:96℃预变性3 min;96℃变性30 s,65℃退火3 min,72℃延伸1 min,35个循环;72℃延伸7 min。扩增产物用1%琼脂糖凝胶电泳鉴定后,用Omega胶回收试剂盒(OMEGA公司,美国)回收约656 bp的rIL-10 DNA片段。该片段克隆入pcDNA3.1载体(上海吉凯基因化学技术有限公司)中,构建pcDNA3.1-IL-10,并测序鉴定。将无血清培养液与pcDNA3.1-IL-10、腺病毒载体及lipofectamine 2000(Invitrogen公司,美国)混合后共转染HEK293细胞,进行细胞内同源重组,转染2周后挑取2个病毒噬斑,并提取腺病毒DNA,经PCR鉴定重组是否成功。基因测序由上海吉凯基因化学技术有限公司完成。
1.5 rIL-10重组腺病毒载体的扩增与滴度检测确定重组载体成功构建,50%~70%丰度的HEK293细胞铺6孔板,并在共转染后7~10 d收集HEK293细胞,-80℃和37℃反复冻融4次裂解细胞,1 500 r/min×5 min,收集上清获得病毒颗粒。将病毒上清再次感染HEK293细胞以扩增病毒,氯化铯梯度离心法纯化。蚀斑形成单位法检测病毒的滴度,以HEK293为靶细胞,每孔以细胞数1.5×106铺6孔板,病毒液以1 mL开始行10倍稀释至1×10-9 mL,每孔加入0.1 mL;感染第3天覆盖2%琼脂糖和DMEM的混合液;第5天附加1次;第9天溴化二苯基四氮唑(MTT)染色判定结果。
1.6 Western blot法检测rIL-10重组腺病毒载体在鼠MSCs中的表达对数生长期的大鼠MSCs,细胞数6×106,加入滴度4×109 PFU/mL的rIL-10重组腺病毒载体100 μL,24 h后弃病毒液,加入正常的培养液,3 d后收集细胞,以PBS洗2次做蛋白抽提,10%的SDS-PAGE凝胶电泳。PBST洗涤4次,将膜放入密封塑料袋,加入5 mL封闭液旋转摇动60 min,倒去封闭液,加入兔抗鼠IL-10抗体(Invitrogen公司,美国),室温下旋转摇动60 min,取出膜,200 mL PBST洗4次,每次15 min,将膜放入新的密封塑料袋中,加入稀释的羊抗兔二抗(Invitrogen公司,美国),室温持续摇动60 min,200 mL PBST洗膜4次,每次15 min,用碱性磷酸酶显色。
2 结果 2.1 含rIL-10基因重组腺病毒载体的构建pcDNA3.1-IL-10质粒送测序公司测序,结果与GenBank中的rIL-10基因cDNA序列完全一致。共转染HEK293细胞进行细胞内同源重组后,提取重组腺病毒DNA经PCR扩增,电泳条带(656 bp)位于500~750 bp之间,见图 1。
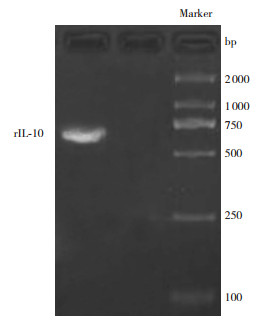
|
图 1 rIL-10重组腺病毒载体PCR结果 |
转染HEK293细胞后收集细胞,反复冻融离心后收集上清液,扩增病毒,经蚀斑形成单位法检测滴度为4×109 PFU/mL。
2.3 rIL-10重组腺病毒载体在鼠MSCs中的表达用rIL-10重组腺病毒载体感染大鼠MSCs,提取蛋白做Western blot,感染rIL-10重组腺病毒的细胞有rIL-10阳性表达,未感染的细胞无条带。见图 2。
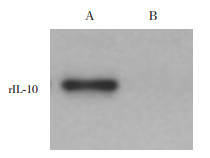
|
图 2 rIL-10重组腺病毒载体感染大鼠MSCs的表达情况 A:rIL-10阳性表达;B:未感染腺病毒无rIL-10阳性表达。 |
传统药物治疗CD与UC的缓解率分别为70%和80%,临床疗效欠佳,长期应用不良反应多,难以维持长期缓解,不能有效缩短IBD的自然病程,对危重病例疗效有限,存在停药后复发等问题。尽管特异性单克隆抗体的出现给许多患者带来了福音,但目前仍存在约三分之一的CD患者对抗TNF-α治疗无应答[16],并且10%的CD患者对所有药物均不能耐受或者是无应答。
体外研究发现,将分离于CD患者肠道固有黏膜层的单个核细胞进行体外培养,加入IL-10后可明显抑制其炎症因子的释放[17];每天给予静脉注射IL-10可以明显减轻结肠炎模型小鼠的肠道炎症反应[18]。尽管这种以细胞因子为基础的治疗方式在那些对传统药物没有良好反应的疾病中应用受到大家的关注,但是利用循环系统给予细胞因子有很多缺点:如在体内的半衰期短、全身毒副作用及成本高等。单纯增加用药的浓度并不能有效提高疗效,Tilg等[19]的研究表明CD患者在静脉应用大剂量IL-10,效果反而不佳,且会引发全身的副作用,如头痛、贫血、发热、血小板减少、周身不适等。为了解决这个难题,Steidler等[20]首次构建了可产生IL-10的基因工程细菌,采用灌胃治疗葡聚糖硫酸钠致鼠结肠炎和基因缺陷小鼠结肠炎,利用肠道共栖菌乳酸杆菌作为药物传送的载体进行基因治疗,能避免胃酸的分解,并以具有生物活性的形态到达肠道黏膜,使黏膜炎症减轻,但其缓解率不高(50%)。因此为了提高疾病的缓解率及减少药物副作用,探索IL-10新的治疗方式为大势所趋。
MSCs治疗自身免疫相关疾病的机制为:(1)可分化为具有功能的细胞以修复受损组织,基础研究结果显示骨髓来源的细胞参与炎症肠黏膜的修复过程,并能替代黏膜的构成成分:如肌纤维母细胞、内皮细胞及上皮细胞;(2)具有免疫抑制作用,可抑制T细胞、B细胞、淋巴细胞的活化和功能,降低树突状细胞的抗原呈递作用和功能[9]。这为干细胞治疗IBD提供了理论依据。一项荟萃分析指出MSCs具有良好的治疗潜力,对IBD患者的不良事件风险较低,特别是对于合并肛周病变并接受局部治疗的患者。MSCs的主要优点是其不需要高剂量化疗及像骨髓造血干细胞移植的预放射治疗,因此,不良反应相对较少。由于MSCs的免疫调节特性,健康供体(而不是IBD患者)也可以用作MSCs的来源而不增加宿主排斥的风险[21]。IBD常伴随许多肠外表现,如肝胆疾病、皮肤病变、关节炎、骨代谢疾病等,最新研究发现MSCs移植可通过LPS/TLR4通路抑制肠源性内毒素血症和肝脏炎症,改善葡聚糖硫酸钠诱导鼠慢性结肠炎模型相关肝胆并发症,提示MSCs可能成为慢性结肠炎相关肝胆并发症的新型治疗方法[22]。
腺病毒载体是临床基因治疗研究中应用最为广泛的载体之一,能进行有效的增殖,产生较高的病毒滴度,对人致病性低,可广泛用于人类及非人类蛋白的表达,非常适用于基因治疗。
本研究成功构建了携带rIL-10的腺病毒载体,病毒滴度高,且可高效率体外感染rMSCs并表达外源基因rIL-10。这为本课题组的进一步基因移植治疗研究提供了坚实的基础。下一步本课题组将rIL-10的腺病毒载体转染的MSCs通过静脉注射治疗三硝基苯磺酸诱导的结肠炎小鼠,观察是否可抑制其肠道炎症细胞因子的释放、缓解肠道炎症损伤,并评估该方法的安全性和可靠性。
| [1] |
Miheller P, Lakatos PL, Horváth G, et al. Efficacy and safety of infliximab induction therapy in Crohn's Disease in Central Europe-a Hungarian nationwide observational study[J]. BMC Gastroenterol, 2009, 9: 66. DOI:10.1186/1471-230X-9-66 (  0) 0) |
| [2] |
Shouval DS, Biswas A, Goettel JA, et al. Interleukin-10 receptor signaling in innate immune cells regulates mucosal immune tolerance and anti-inflammatory macrophage function[J]. Immunity, 2014, 40(5): 706-719. DOI:10.1016/j.immuni.2014.03.011 (  0) 0) |
| [3] |
Christodoulou K, Wiskin AE, Gibson J, et al. Next generation exome sequencing of paediatric inflammatory bowel disease patients identifies rare and novel variants in candidate genes[J]. Gut, 2013, 62(7): 977-984. DOI:10.1136/gutjnl-2011-301833 (  0) 0) |
| [4] |
Shim JO, Seo JK. Very early-onset inflammatory bowel disease (IBD) in infancy is a different disease entity from adult-onset IBD; one form of interleukin-10 receptor mutations[J]. J Hum Genet, 2014, 59(6): 337-341. DOI:10.1038/jhg.2014.32 (  0) 0) |
| [5] |
Lin Z, Wang Z, Hegarty JP, et al. Genetic association and epistatic interaction of the interleukin-10 signaling pathway in pediatric inflammatory bowel disease[J]. World J Gastroenterol, 2017, 23(27): 4897-4909. DOI:10.3748/wjg.v23.i27.4897 (  0) 0) |
| [6] |
Kühn R, Löhler J, Rennick D, et al. Interleukin-10-deficient mice develop chronic enterocolitis[J]. Cell, 1993, 75(2): 263-274. DOI:10.1016/0092-8674(93)80068-P (  0) 0) |
| [7] |
Shim JO, Hwang S, Yang HR, et al. Interleukin-10 receptor mutations in children with neonatal-onset Crohn's disease and intractable ulcerating enterocolitis[J]. Eur J Gastroenterol Hepatol, 2013, 25(10): 1235-1240. (  0) 0) |
| [8] |
Doecke JD, Simms LA, Zhao ZZ, et al. Genetic susceptibility in IBD:overlap between ulcerative colitis and Crohn's disease[J]. Inflamm Bowel Dis, 2013, 19(2): 240-245. DOI:10.1097/MIB.0b013e3182810041 (  0) 0) |
| [9] |
Arthur A, Zannettino A, Gronthos S. The therapeutic applications of multipotential mesenchymal/stromal stem cells in skeletal tissue repair[J]. J Cell Physiol, 2009, 218(2): 237-245. DOI:10.1002/jcp.v218:2 (  0) 0) |
| [10] |
Sémont A, Mouiseddine M, François A, et al. Mesenchymal stem cells improve small intestinal integrity through regulation of endogenous epithelial cell homeostasis[J]. Cell Death Differ, 2010, 17(6): 952-961. DOI:10.1038/cdd.2009.187 (  0) 0) |
| [11] |
Chen QQ, Yan L, Wang CZ, et al. Mesenchymal stem cells alleviate TNBS-induced colitis by modulating inflammatory and autoimmune responses[J]. World J Gastroenterol, 2013, 19(29): 4702-4717. DOI:10.3748/wjg.v19.i29.4702 (  0) 0) |
| [12] |
He XW, He XS, Lian L, et al. Systemic infusion of bone marrow-derived mesenchymal stem cells for treatment of experimental colitis in mice[J]. Dig Dis Sci, 2012, 57(12): 3136-3144. DOI:10.1007/s10620-012-2290-5 (  0) 0) |
| [13] |
Qi Y, Jiang D, Sindrilaru A, et al. TSG-6 released from intradermally injected mesenchymal stem cells accelerates wound healing and reduces tissue fibrosis in murine full-thickness skin wounds[J]. J Invest Dermatol, 2014, 134(2): 526-537. (  0) 0) |
| [14] |
Yang J, Liu XX, Fan H, et al. Extracellular vesicles derived from bone marrow mesenchymal stem cells protect against experimental colitis via attenuating colon inflammation, oxidative stress and apoptosis[J]. PLoS One, 2015, 10(10): e0140551. DOI:10.1371/journal.pone.0140551 (  0) 0) |
| [15] |
Anderson P, Souza-Moreira L, Morell M, et al. Adipose-derived mesenchymal stromal cells induce immunomodulatory macrophages which protect from experimental colitis and sepsis[J]. Gut, 2013, 62(8): 1131-1141. DOI:10.1136/gutjnl-2012-302152 (  0) 0) |
| [16] |
Yanai H, Hanauer SB. Assessing response and loss of response to biological therapies in IBD[J]. Am J Gastroenterol, 2011, 106(4): 685-698. DOI:10.1038/ajg.2011.103 (  0) 0) |
| [17] |
Schreiber S, Heinig T, Thiele HG, et al. Immunoregulatory role of interleukin 10 in patients with inflammatory bowel disease[J]. Gastroenterology, 1995, 108(5): 1434-1444. DOI:10.1016/0016-5085(95)90692-4 (  0) 0) |
| [18] |
Moore KW, de Waal Malefyt R, Coffman RL, et al. Interleukin-10 and the interleukin-10 receptor[J]. Annu Rev Immunol, 2001, 19: 683-765. DOI:10.1146/annurev.immunol.19.1.683 (  0) 0) |
| [19] |
Tilg H, van Montfrans C, van den Ende A, et al. Treatment of Crohn's disease with recombinant human interleukin 10 induces the proinflammatory cytokine interferon gamma[J]. Gut, 2002, 50(2): 191-195. DOI:10.1136/gut.50.2.191 (  0) 0) |
| [20] |
Steidler L, Hans W, Schotte L, et al. Treatment of murine colitis by Lactococcus lactis secreting interleukin-10[J]. Science, 2000, 289(5483): 1352-1355. DOI:10.1126/science.289.5483.1352 (  0) 0) |
| [21] |
Dave M, Mehta K, Luther J, et al. Mesenchymal stem cell therapy for inflammatory bowel disease:a systematic review and meta-analysis[J]. Inflamm Bowel Dis, 2015, 21(11): 2696-2707. DOI:10.1097/MIB.0000000000000543 (  0) 0) |
| [22] |
Niu GC, Liu L, Zheng L, et al. Mesenchymal stem cell transplantation improves chronic colitis-associated complications through inhibiting the activity of toll-like receptor-4 in mice[J]. BMC Gastroenterol, 2018, 18(1): 127. DOI:10.1186/s12876-018-0850-7 (  0) 0) |
 2019, Vol. 21
2019, Vol. 21


