结节性硬化症(tuberous sclerosis complex, TSC)是一种常染色体显性遗传性多器官受累疾病[1-2],发病率1/6 000~10 000,致病基因是TSC-1和TSC-2基因[2-3]。TSC基因突变引起TSC-1/TSC-2复合体结构与功能异常,对哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)去抑制,从而导致蛋白合成、细胞生长和血管生成增加,葡萄糖摄取与代谢异常,同时出现细胞定位和移行障碍[1, 3]。脑部主要病理改变包括皮质结节、白质放射状移行线、室管膜下钙化灶和室管膜下巨细胞星形细胞瘤(subependymal giant-cell astrocytomas, SEGA),神经系统症状主要有癫痫、发育迟滞、精神异常和局灶性神经功能缺失,以TSC相关性癫痫(TSC-related epilepsy, TRE)最为常见,发病率占70%~90%,其中70%为药物难治性癫痫[2, 4]。外科手术是药物难治性癫痫的重要治疗手段,但我国在TRE外科治疗方面尚缺乏操作性规范,为此特制定本专家共识。
1 TSC的临床表现与诊断标准根据受累部位、患者年龄不同,TSC可有不同表现,心脏横纹肌瘤多见于胎儿,面部纤维血管瘤和肾血管平滑肌脂肪瘤在学龄期后逐步出现[2]。99%的大脑皮质结节在出生时已形成,约30%患者在1岁以内以癫痫性痉挛发作起病,其他患者以局灶性发作、强直、阵挛、全面强直-阵挛发作或其他癫痫发作形式起病[3-4]。突变基因不同对癫痫发作也有影响,TSC-2基因突变患者多较TSC-1基因突变者症状严重。TSC-2基因突变患者中,散发病例比家系病例症状严重;TSC家系病例中,子代较亲代症状重[2, 5-6]。
TRE的诊断需要明确癫痫诊断和TSC诊断。根据国际TSC共识小组诊断标准,包括11项主要表现:色素脱失斑(≥3处,直径≥5 mm)、面部血管纤维瘤(≥3处)或头部纤维斑块、指(趾)甲下纤维瘤(≥2处)、鲨鱼皮样斑、多发性视网膜错构瘤、脑皮质结节或白质放射状移行线、室管膜下钙化灶、SEGA、心脏横纹肌瘤、淋巴血管肌瘤病(如血管平滑肌脂肪瘤同时存在,则合并为1项主要表现)和血管平滑肌脂肪瘤(≥2处);6项次要表现有:“斑斓”皮损、牙釉质点状凹陷(>3处)、口内纤维瘤(≥2处)、视网膜色素脱失斑、多发性肾囊肿和非肾性错构瘤等。TSC确定诊断:至少2项主要表现,或1项主要表现+2项次要表现;可能诊断:1项主要表现,或2项次要表现[7]。致病性TSC基因突变(已报道致病突变或证实影响TSC-1/TSC-2复合体功能的突变)可作为独立诊断标准。
2 TRE的药物与饮食治疗 2.1 mTOR抑制剂mTOR抑制剂是对TRE的病因治疗[3, 8-9]。依维莫司已批准用于临床,对40%~80%的TRE有效[10-11]。雷帕霉素对TRE有效率达70%[12-13]。此类药物对合并SEGA或肾血管平滑肌脂肪瘤者应当优先应用,但应用时机与时程尚不明确。
2.2 抗癫痫药物TRE中婴儿痉挛症首选氨己烯酸治疗[4, 14-15],其他类型癫痫发作的抗癫痫药物(anti-epilepsy drugs, AEDs)治疗根据癫痫发作类型和癫痫综合征类型选用[4, 16]。
2.3 生酮饮食有少量临床应用和文献报道显示其可以减少癫痫发作、改善认识[17],尚缺乏高等级证据证实其长期有效性。
3 TRE的术前无创评估TRE相关的颅内病变是幕上皮质结节,所以TRE的癫痫灶定位主要是确定致痫结节[15, 18]。致痫结节的术前定位主要依靠症状学分析、无创检查(体查、EEG、结构影像与功能影像学和神经心理评估等)和有创的颅内电极EEG检查[19-20]。
3.1 症状学与神经科体征癫痫发作的症状学分析是定位致痫结节的基础,症状学分析要参考家属及患者的描述,特别是要仔细分析术前长程视频脑电图监测的临床发作,重点强调先兆、首发症状和症状的演变过程;最终的致痫结节定位要很好解释发作症状学,特别是“4”字征等具有定侧定位体征的症状学[16]。全面详细的神经科体查,发现有意义的临床体征,推断脑功能缺失区,对致痫结节的定位也有重要意义。
3.2 结构影像学头颅计算机断层扫描(computer tomography, CT)应常规检查,在显示室管膜下钙化灶、皮质结节钙化方面有优势[21]。头颅磁共振(magnetic resonance imaging, MRI)是必须的检查项目,MRI设备场强应为1.5 T以上,应包括常规的T1W、T2W、DWI扫描和层厚2~3 mm无间距T2W液体衰减反转恢复成像(fluid-attenuated inversion recovery imaging, FLAIR)轴位、冠状位及矢状位扫描,合并SEGA和脑积水者应行T1W增强扫描[22]。皮质结节在T1W为等或略低信号,T2WI表现为边界不清楚的略高信号;合并钙化时在T1W和T2W均为低信号,囊变时局部为T1WI低信号和T2WI高信号;T2W-FLAIR是TRE最重要的MRI成像方式,皮质结节表现为与脑组织明显差异的高信号,边界较清晰,部分患者可见白质放射状移行线、白灰质界线不清等影像表现;在婴儿期,由于白质髓鞘化不全,皮质结节表现为T1W高信号和T2W低信号[22];7T-MRI灰白质界线增强序列可以更清晰显示皮质结节边界和微小皮质结节[23]。TRE的皮质结节周围如有脑皮质发育不良样表现、CT/MRI显示体积明显大于普通结节且边界清楚的钙化或明显囊变的皮质结节,提示为致痫结节可能性大的显著结节[22, 24]。在DWI中致痫结节较非致痫结节有更高的平均扩散系数和更低的各向异性[25]。
3.3 功能影像学发作间期单光子发射计算机断层扫描(single photon emission computed tomography, SPECT)显示皮质结节多为低灌注,发作期SPECT中致痫结节表现为中心低灌注周围弧状高灌注[23],发作期与发作间期SPECT减影MRI融合技术可提高SPECT对致痫结节定位的准确性[26]。正电子发射计算机断层扫描(positron emission tomography, PET)是TRE术前评估中的重要检查,发作间期FDG-PET中致痫结节上皮质低代谢范围明显较MRI显示结节范围大,PET-MRI融合在TRE术前评估中应常规应用,以定位伴有皮质发育不良改变的显著结节[27];11C-甲基-左旋色氨酸-PET对TSC致痫结节定位更有特异性,如果出现明显摄取增高的结节,提示为致痫结节[28]。
3.4 电(磁)生理技术头皮EEG是必须检查项目,EEG提示致痫区与MRI提示的致痫结节的一致性是TRE术后无发作的主要相关因素[29]。TRE中典型局灶性发作EEG是局灶棘波和多棘波起始,进而出现全面不规则的一过性慢波和背景突然、弥漫的去同步化;发作间期EEG中,35%的患者存在局灶性棘尖波发放。脑电信号后处理会对TRE的定位有进一步帮助[30]。脑磁图对致痫结节定位的敏感性和特异性优于头皮EEG和发作间期SPECT [31],但目前国内外临床应用经验较少。
3.5 神经心理检查应根据年龄完成智商、记忆商(>6岁)或发育商(≤6岁)测评,并利用QOLIE-31或QOLIE-10量表行生活质量(quality of life, QOL)评分[32]。
TRE致痫结节无创检查结果分析及定位结果分类总结见表 1。
| 表 1 TRE致痫结节无创检查结果分析及定位结果分类 |
|
|
切除性手术是病灶相关性癫痫最重要的治疗方案[16],也是TRE外科治疗中最有效的治疗方法。
4.1 切除性手术的必要性和可行性TRE可行手术治疗已经成为共识[14, 29, 33],主要是基于以下原因:手术目的是控制癫痫,并不是治疗TSC疾病本身,而TRE与幕上致痫结节(和周围皮质)相关[32];药物难治性TRE常出现进行性认知损害[20, 34];幕上皮质结节在患者12月龄时达到稳定状态,除个别患者外无明显生长性,且并非所有皮质结节均有致痫性[21, 35];TRE以儿童多见,尤其是低龄儿童,处于脑发育的关键时期,术后持续无发作或一段时间无发作会明显改善患儿长期认知发育[20, 32, 36],另外术后AEDs使用减少也会减轻AEDs对认知的影响[37];切除性手术治疗TRE术后癫痫控制和认知改善良好[4, 19-20, 32-33],荟萃分析显示切除性手术后56%~59%的患者无发作,术后10年的无发作率达到47.8%[2, 19, 38-39]。
4.2 手术适应证药物难治性TRE是指应用2种或以上(联合或单独)种类剂量合理的AEDs治疗后仍未达到持续无癫痫发作的患者。TRE切除性手术治疗的适应证包括:药物难治性TRE,且有局灶性发作症状、局灶性发作期或发作间期EEG表现或MRI提示致痫结节可能性大的皮质结节,并经过无创评估及二期颅内电极脑电图检查可以确定致痫结节者[15, 40]。优先考虑手术的TRE包括:起病年龄晚(≥1岁)、无婴儿痉挛症病史、智商≥70、病程短(<10年)、头皮EEG提示单侧或1~2个致痫结节以及EEG/MRI结果一致的患者[19, 29, 35, 38-39, 41]。由于幕上皮质结节在12个月龄时才达到相对稳定状态,1岁以上患者在判断为药物难治性TRE,并经过合理药物调整仍有频繁癫痫发作者,应早期行术前评估与手术治疗,减少不可逆性脑损害[42]。对于大型SEGA或巨大且明确钙化的皮质结节,应用mTOR抑制剂等也难以完全消除,同时存在脑积水、占位效应或反复癫痫发作的风险,应当考虑手术切除[35, 43]。药物控制良好的TRE和全身情况无法耐受全麻手术的患者是TRE切除性手术的禁忌证;无局灶的症状学、EEG和MRI定位特征不能确定致痫结节,1岁以内患者是切除性癫痫手术的相对禁忌证,对于1岁以内药物治疗中出现明显认识水平下降或频繁的可导致引起缺氧的癫痫发作时亦应早期手术治疗。患者结节数量、双侧皮质结节、智商水平、婴儿痉挛症病史等并不是排除癫痫外科手术的因素[15, 44-45]。由于TSC患者常存在多器官病变,术前要进行多学科讨论,综合考虑手术的获益/风险比[46]。
4.3 颅内电极EEG检查常用的方法为硬膜下电极结合深部电极EEG或立体EEG,目前基于安全性、准确性和脑研究等多方面的优势,临床应用以立体EEG为主。颅内电极置入的适应证包括[19, 47]:药物难治性TRE并且拟行切除性手术治疗,无创的术前评估无法确定致痫区,但认为通过颅内电极可确定致痫区的位置和范围。颅内电极覆盖范围包括:局部性症状产生区、体积大且有钙化的皮质结节、具有皮质发育不良表现的皮质结节、头皮EEG提示发作期放电起始皮质结节、发作间期癫痫放电明显的皮质结节、其他影像学提示可疑致痫结节;海马硬化、皮质发育不良等其他并存的可疑病理灶;可疑致痫结节累及的功能区。目前文献报道的TRE颅内电极应用比例差异较大,从0%~100%不等,三期开颅手术(电极埋藏-结节切除并保留电极-再次切除)和双侧颅内电极埋藏均有报道[20, 41, 44]。EEG须有同步录像记录,采样频率不低于2 000 Hz,记录不少于5次的惯常性癫痫发作。高频放电区域的分析有助于提高术后癫痫无发作率[48-49]。皮质电刺激可对累及功能区皮质结节进行功能评估[20]。
4.4 切除方法目前常用的方法有(多)脑叶切除术、(多)致痫结节切除术及联合手术(图 1)。皮质结节本身引起癫痫还是结节周围异常皮质引起癫痫存在不同的认识[38],总体认为致痫结节与周围皮质共同引起癫痫可能性大,所以手术应当在保护功能的前提下对结节连同周围异常皮质进行扩大切除[18, 22-23, 27, 50]。同时切除致痫结节和颅内电极EEG确定的皮质结节外致痫区也是术后无发作的重要因素[41, 49, 51]。研究发现TSC在皮质结节外的皮质和白质内存在病理改变[52],荟萃分析显示脑叶切除术优于单纯病灶切除术[38],所以对于结节较大累及一个脑叶的大部分、单脑叶或邻近脑叶内多个毗邻结节、颅内电极EEG确定致痫区域较为广泛者,在不影响主要功能前提下,应行脑叶或多脑叶切除术。术前三维影像重建、术中影像导航、术中皮质EEG、体漫反射光谱法观察可以帮助结节全切除,提高手术效果[18, 53-54]。
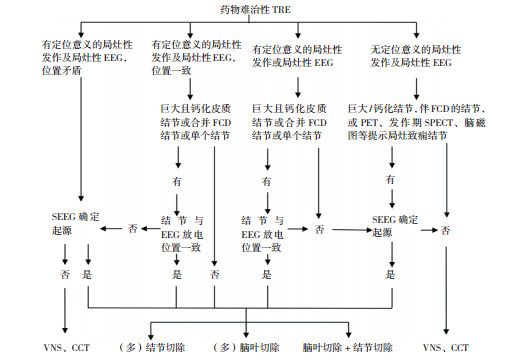
|
图 1 TRE术前评估及手术治疗流程图 [TRE]结节性硬化相关性癫痫;[VNS]迷走神经刺激术;[CCT]胼胝体切除术;[FCD]局灶性皮质发育不良;[SEEG]立体脑电图;[PET]正电子发射计算机断层扫描;[SPECT]单光子发射计算机断层扫描。 |
神经调控手术适用于经综合术前评估无法定位致痫结节或患者和家属不同意切除性手术的药物难治性TRE患者。迷走神经刺激术(vagus nerve stimulation, VNS)被批准治疗药物难治性癫痫,且已用于TRE的治疗。文献报道VNS治疗48例TRE患者(2~44岁),有效率为73%,无发作率4%[55]。病例组长期随访和荟萃分析均显示TRE的VNS术后癫痫控制良好,优于非外伤引起的其他药物难治性癫痫[55-56]。VNS术后超过30%的患者出现认知行为改善,儿童改善更为明显[55-56]。但VNS治疗TRE术后无发作率低,需要与家属术前充分说明[57]。
目前报道治疗TRE的姑息性癫痫外科方法为胼胝体切开术(corpus callosotomy, CCT),适用于经过综合术前评估无法定位致痫结节的药物难治性TRE,特别是合并Lennox-Gastaut综合征或婴儿痉挛症的TSC患儿。CCT手术效果明显低于切除性手术[38],部分伴有精神症状和明显智力低下的TRE患者,CCT联合致痫结节(或脑叶)的切除性手术,术后认知和行为问题改善优于单纯切除性手术[32, 45]。
毁损治疗也是TRE的外科治疗方法,MRI引导下的激光热毁损治疗已有报道,可以分期或一期行多个致痫结节毁损,报道的7例患者癫痫均有效(平均随访19个月),而且4例术前存在认知行为问题的患者中3例得到功能改善[58]。我国近期统计的386例TRE手术患者中,有19例在主要致痫结节切除基础上,利用立体脑电图进行射频毁损远隔部位致痫结节,还有4例仅进行了基于立体EEG的多结节射频毁损治疗,短期观察对癫痫控制均有效[59]。目前两种方法均未见明显并发症,但毁损治疗的效果还需要更多研究和更长时间观察来验证。
6 围手术期处理及术后长期AEDs治疗与随访患者术前2周和术后4周内不宜服用mTOR抑制剂,术前评估中发作频繁者不停用AEDs,癫痫发作较少的患者应当快速逐步减停AEDs,以获得发作期EEG结果。TRE术后早期癫痫发作是最常见的术后并发症,发生率达到12.2%[59],手术后0.5~48 h内应用静脉AEDs,24 h内开始口服AEDs,以减少术后早期癫痫发作。术后AEDs可在术前应用的AEDs中选择2~3种应用,术后至少连续5年以上无癫痫发作,且头皮EEG无明确癫痫样放电才可逐步减停AEDs,期间出现癫痫发作应当恢复AEDs应用[60]。
颅内出血与感染是所有TRE手术(包括颅内电极脑电图检查)术后常见的并发症,特别是行颅内电极脑电图检查并二期行切除性手术者。出血量超过30 mL或者明显颅内高压者进行血肿清除或穿刺引流治疗,考虑出现颅内感染者应当进行腰椎穿刺和脑脊液细菌培养,早期根据经验选择抗生素,后期根据药物敏感试验选择抗生素。
神经功能缺失与脑出血、脑梗死、传导束或功能区皮质的切除相关,主要见于切除性手术和CCT,单纯功能区结节切除多不引起永久功能缺失。术后考虑有血管损伤或血管痉挛者还应当行扩张脑血管治疗。考虑脑梗死患者应当行MRI检查,如果出现大面积脑梗死并有脑疝风险者需要进行去骨瓣减压术。神经功能缺失患者术后24 h开始行改善微循环、神经营养、脱水和清除脑自由基药物治疗,并进行早期功能康复训练、高压氧、针灸等综合治疗。VNS术后可能出现声音嘶哑和咳嗽等并发症,多为一过性,症状明显者,如为术后早期出现者可以推迟开机时间,参数调整过程中者可以降低刺激参数以缓解症状[54-55]。
记忆与认知损害可见于脑叶切除、半球切除或CCT术后,特别是术后癫痫发作控制不良的患者。切除性手术术后患者IQ及QOL下降率为3.9%[19, 32],CCT术后下降率为4.3%~8.7%[61-62]。术前需要进行脑叶切除或CCT的患者要认真评估记忆与认识损害与癫痫发作的利弊关系,尽可能减少优势侧海马结构切除和IQ>70成人TRE患者的CCT [62]。术后出现认知损害时,要进行早期康复训练。
术后早期仍有明显癫痫发作者,应当进行EEG检查,分析原因,调整AEDs和mTOR抑制剂的种类、用法和用量,VNS术后患者同时调整刺激参数,减少癫痫发作。VNS、毁损手术、CCT 1年以后癫痫控制不良患者,可行进一步术前评估,确定致痫结节,进行切除性手术治疗[56]。切除性手术后癫痫控制不良者也可再行VNS治疗。
术后每12个月随访癫痫控制情况及认知心理变化,癫痫发作减少按ILAE分类法分为Ⅰ~Ⅵ级。同时,需要对患者全身情况进行长期随访。
7 主要推荐意见TSC是一种TSC基因突变引起的常染色体显性遗传疾病,多器官受累,根据临床表现和致病基因突变均可诊断。TRE是TSC的常见临床表现,外科治疗是其重要方法,基于现有证据和专家意见,下列5点作为本共识的主要推荐意见:
(1)AEDs和mTOR抑制剂均可用于TRE治疗,对于药物难治性TRE应当积极考虑术前评估。
(2)TRE癫痫灶定位主要是确定幕上致痫皮质结节,头颅CT、MRI和头皮EEG是必须检查项目,其中MRI-T2W-FLAIR是显示皮质结节最重要的检查,PET-MRI融合对致痫结节定位有重要作用;局灶性发作的症状学、局灶性头皮EEG放电对应的皮质结节以及较大且钙化的结节或伴有皮质发育不良样表现的结节等提示可能为致痫结节。
(3)切除性手术是TRE治疗的有效方法,颅内电极EEG可帮助一些无创检查无法定位的患者确定致痫结节;手术应当在保护功能前提下全切除致痫结节及相关皮质。
(4)神经调控及姑息性手术是针对于不能进行切除性手术的TRE患者的治疗方法,可以减少癫痫发作,但无发作率低,部分术后患者有认知改善。激光毁损和射频毁损已小范围开始应用。
(5)术后需要长期药物治疗与随访,关注癫痫控制与认知心理变化。术后存在并发症风险,要早期防治。术后癫痫控制不良者应行药物调整或VNS刺激参数调整,必要时再次术前评估,以明确是否再次手术和手术方案。
8 不足与展望本共识基于国内386例患者回顾性资料以及国内外发表相关文献和专家意见编写,存在缺乏多中心大宗的前瞻性对照研究等高等级资料和临床经验不充分等问题。下一步,本专业委员会将组织多中心前瞻性对照研究,并积累手术病例,不断修订和充实本专家共识。
编写专家(按姓氏拼音排序):
执笔人员:丁平(解放军总医院神经外科)、关宇光(首都医科大学三博脑科医院神经外科)、梁树立(首都医科大学附属北京儿童医院功能神经外科)、刘庆祝(北京大学第一医院儿童癫痫外科)、刘仕勇(陆军军医大学新桥医院神经外科)、彭镜(中南大学湘雅医院儿科)、田宏(国家卫健委中日友好医院神经外科)、姚一(厦门弘爱医院神经外科)、遇涛(首都医科大学宣武医院功能神经外科)、张凯(首都医科大学附属北京天坛医院神经外科)
审校专家:邓艳春(空军军医大学西京医院神经内科)、姜玉武(北京大学第一医院儿科)、林卫红(吉林大学第一医院神经内科)、栾国明(首都医科大学三博脑科医院神经外科)、秦炯(北京大学人民医院儿科)、王学峰(重庆医科大学第一附属医院神经内科)、王玉平(首都医科大学宣武医院神经内科)、张国君(首都医科大学宣武医院功能神经外科)、张建国(首都医科大学附属北京天坛医院神经外科)、邹丽萍(解放军总医院儿科)
讨论人员:陈蕾(四川大学华西医院神经内科)、陈燕惠(福建医科大学附属协和医院儿科)、崔志强(解放军总医院神经外科)、方方(首都医科大学附属北京儿童医院神经内科)、郭强(广东三九脑科医院癫痫中心)、姜涛(首都医科大学附属北京天坛医院神经外科)、雷町(四川大学华西医院神经外科)、李文玲(河北医科大学第二医院神经外科)、李云林(首都儿科研究所附属医院神经外科)、林元相(福建医科大学第一附属医院神经外科)、欧绍武(中国医科大学第一附属医院神经外科)、单永治(首都医科大学宣武医院神经外科)、石秀玉(解放军总医院儿科)、王华(中国医科大学附属盛京医院儿科)、王旭(首都医科大学附属北京儿童医院神经内科)、翟锋(首都医科大学三博脑科医院神经外科)、张光明(北京航空总医院癫痫外科)、张宏伟(北京协和医院影像科)、张华(空军军医大学唐都医院神经外科)、张军臣(济宁医学院附属医院神经外科)、张绍辉(解放军总医院第四医学中心神经外科)、赵霞(深圳市儿童医院神经内科)、周水珍(复旦大学附属儿科医院神经内科)、颜因(重庆市第九人民医院神经内科)、杨卫东(天津医科大学总医院神经外科)、杨小枫(首都医科大学宣武医院神经电生理研究室)、杨志仙(北京大学第一医院儿科)、尹剑(大连医科大学第二医院神经外科)、虞雄鹰(江西省儿童医院神经内科)
特邀专家:Ashley Fasciola和Michael Wong (Department of Neurology, Pediatrics, and Neuroscience, Washington University School of Medicine)
| [1] |
Curatolo P, Moavero R, de Vries PJ. Neurological and neuropsychiatric aspects of tuberous sclerosis complex[J]. Lancet Neurol, 2015, 14(7): 733-745. DOI:10.1016/S1474-4422(15)00069-1 (  0) 0) |
| [2] |
Yang G, Shi ZN, Meng Y, et al. Phenotypic and genotypic characterization of Chinese children diagnosed with tuberous sclerosis complex[J]. Clin Genet, 2017, 91(5): 764-768. DOI:10.1111/cge.12920 (  0) 0) |
| [3] |
Wong M. Mammalian target of rapamycin (mTOR) pathways in neurological diseases[J]. Biomed J, 2013, 36(2): 40-50. (  0) 0) |
| [4] |
Overwater IE, Bindels-de Heus K, Rietman AB, et al. Epilepsy in children with tuberous sclerosis complex:chance of remission and response to antiepileptic drugs[J]. Epilepsia, 2015, 56(8): 1239-1245. DOI:10.1111/epi.13050 (  0) 0) |
| [5] |
Cui J, Yu X, Liang S, et al. First five generations Chinese family of tuberous scleroses complex due to a new mutation of the TSC1 gene[J]. J Clin Neurosci, 2018, 54: 39-44. DOI:10.1016/j.jocn.2018.05.007 (  0) 0) |
| [6] |
Kothare SV, Singh K, Chalifoux JR, et al. Severity of manifestations in tuberous sclerosis complex in relation to genotype[J]. Epilepsia, 2014, 55(7): 1025-1029. DOI:10.1111/epi.12680 (  0) 0) |
| [7] |
Northrup H, Krueger DA, International Tuberous Sclerosis Complex Consensus Group. Tuberous sclerosis complex diagnostic criteria update:recommendations of the 2012 International Tuberous Sclerosis Complex Consensus Conference[J]. Pediatr Neurol, 2013, 49(4): 243-254. DOI:10.1016/j.pediatrneurol.2013.08.001 (  0) 0) |
| [8] |
Wong M. A critical review of mTOR inhibitors and epilepsy:from basic science to clinical trials[J]. Expert Rev Neurother, 2013, 13(6): 657-669. DOI:10.1586/ern.13.48 (  0) 0) |
| [9] |
Yang G, Yang L, Yang X, et al. Efficacy and safety of a mammalian target of rapamycin inhibitor in pediatric patients with tuberous sclerosis complex:a systematic review and meta-analysis[J]. Exp Ther Med, 2015, 9(2): 626-630. DOI:10.3892/etm.2014.2093 (  0) 0) |
| [10] |
Samueli S, Abraham K, Dressler A, et al. Efficacy and safety of Everolimus in children with TSC-associated epilepsy-pilot data from an open single-center prospective study[J]. Orphanet J Rare Dis, 2016, 11(1): 145. DOI:10.1186/s13023-016-0530-z (  0) 0) |
| [11] |
Krueger DA, Wilfong AA, Mays M, et al. Long-term treatment of epilepsy with everolimus in tuberous sclerosis[J]. Neurology, 2016, 87(23): 2408-2415. DOI:10.1212/WNL.0000000000003400 (  0) 0) |
| [12] |
邹丽萍, 刘玉洁, 庞领玉, 等. 雷帕霉素治疗儿童结节性硬化症合并癫痫的临床效果及安全性观察[J]. 中华儿科杂志, 2014, 52(11): 812-816. DOI:10.3760/cma.j.issn.0578-1310.2014.11.004 (  0) 0) |
| [13] |
Canpolat M, Per H, Gumus H, et al. Rapamycin has a beneficial effect on controlling epilepsy in children with tuberous sclerosis complex:results of 7 children from a cohort of 86[J]. Childs Nerv Syst, 2014, 30(2): 227-240. DOI:10.1007/s00381-013-2185-6 (  0) 0) |
| [14] |
Zou LP, Liu YT. Letter re:Sirolimus for epilepsy in children with tuberous sclerosis complex:A randomized controlled trial[J]. Neurology, 2017, 88(10): 1008. (  0) 0) |
| [15] |
Curatolo P, Nabbout R, Lagae L, et al. Management of epilepsy associated with tuberous sclerosis complex:updated clinical recommendations[J]. Eur J Paediatr Neurol, 2018, 22(5): 738-748. DOI:10.1016/j.ejpn.2018.05.006 (  0) 0) |
| [16] |
中国抗癫痫协会. 临床诊疗指南-癫痫分册(修订版)[M]. 北京: 人民卫生出版社, 2015: 64-75.
(  0) 0) |
| [17] |
Park S, Lee EJ, Eom S, et al. Ketogenic diet for the management of epilepsy associated with tuberous sclerosis complex in children[J]. J Epilepsy Res, 2017, 7(1): 45-49. DOI:10.14581/jer.17008 (  0) 0) |
| [18] |
Ruppe V, Dilsiz P, Reiss CS, et al. Developmental brain abnormalities in tuberous sclerosis complex:a comparative tissue analysis of cortical tubers and perituberal cortex[J]. Epilepsia, 2014, 55(4): 539-550. DOI:10.1111/epi.12545 (  0) 0) |
| [19] |
Liang S, Zhang J, Yang Z, et al. Long-term outcomes of epilepsy surgery in tuberous sclerosis complex[J]. J Neurol, 2017, 264(6): 1146-1154. DOI:10.1007/s00415-017-8507-y (  0) 0) |
| [20] |
Arya R, Tenney JR, Horn PS, et al. Long-term outcomes of resective epilepsy surgery after invasive presurgical evaluation in children with tuberous sclerosis complex and bilateral multiple lesions[J]. J Neurosurg Pediatr, 2015, 15(1): 26-33. (  0) 0) |
| [21] |
Rovira À, Ruiz-Falcó ML, García-Esparza E, et al. Recommendations for the radiological diagnosis and follow-up of neuropathological abnormalities associated with tuberous sclerosis complex[J]. J Neurooncol, 2014, 118(2): 205-223. DOI:10.1007/s11060-014-1429-y (  0) 0) |
| [22] |
Jahodova A, Krsek P, Kyncl M, et al. Distinctive MRI features of the epileptogenic zone in children with tuberous sclerosis[J]. Eur J Radiol, 2014, 83(4): 703-709. DOI:10.1016/j.ejrad.2013.12.024 (  0) 0) |
| [23] |
Sun K, Cui J, Wang B, et al. Magnetic resonance imaging of tuberous sclerosis complex with or without epilepsy at 7T[J]. Neuroradiology, 2018, 60(8): 785-794. DOI:10.1007/s00234-018-2040-2 (  0) 0) |
| [24] |
Zhang MN, Zou LP, Wang YY, et al. Calcification in cerebral parenchyma affects pharmacoresistant epilepsy in tuberous sclerosis[J]. Seizure, 2018, 60: 86-90. DOI:10.1016/j.seizure.2018.06.011 (  0) 0) |
| [25] |
Yogi A, Hirata Y, Karavaeva E, et al. DTI of tuber and perituberal tissue can predict epileptogenicity in tuberous sclerosis complex[J]. Neurology, 2015, 85(23): 2011-2015. DOI:10.1212/WNL.0000000000002202 (  0) 0) |
| [26] |
Song P, Joo EY, Seo DW, et al. Seizure localization in patients with multiple tubers:presurgical evaluation in tuberous sclerosis[J]. J Epilepsy Res, 2012, 2(1): 16-20. (  0) 0) |
| [27] |
Chandra PS, Salamon N, Huang J, et al. FDG-PET/MRI coregistration and diffusion-tensor imaging distinguish epileptogenic tubers and cortex in patients with tuberous sclerosis complex:a preliminary report[J]. Epilepsia, 2006, 47(9): 1543-1549. DOI:10.1111/j.1528-1167.2006.00627.x (  0) 0) |
| [28] |
Chugani HT, Luat AF, Kumar A, et al. α-[11C]-Methyl-L-tryptophan-PET in 191 patients with tuberous sclerosis complex[J]. Neurology, 2013, 81(7): 674-680. DOI:10.1212/WNL.0b013e3182a08f3f (  0) 0) |
| [29] |
Fallah A, Guyatt GH, Snead OC 3rd, et al. Predictors of seizure outcomes in children with tuberous sclerosis complex and intractable epilepsy undergoing resective epilepsy surgery:an individual participant data meta-analysis[J]. PLoS One, 2013, 8(2): e53565. DOI:10.1371/journal.pone.0053565 (  0) 0) |
| [30] |
Leal AJ, Dias AI, Vieira JP, et al. Analysis of the dynamics and origin of epileptic activity in patients with tuberous sclerosis evaluated for surgery of epilepsy[J]. Clin Neurophysiol, 2008, 119(4): 853-861. DOI:10.1016/j.clinph.2007.11.176 (  0) 0) |
| [31] |
Okanishi T, Akiyama T, Mayo E, et al. Magnetoencephalography spike sources interrelate the extensive epileptogenic zone of tuberous sclerosis complex[J]. Epilepsy Res, 2016, 127: 302-310. DOI:10.1016/j.eplepsyres.2016.09.007 (  0) 0) |
| [32] |
Liang S, Li A, Zhao M, et al. Epilepsy surgery in tuberous sclerosis complex:emphasis on surgical candidate and neuropsychology[J]. Epilepsia, 2010, 51(11): 2316-2321. DOI:10.1111/j.1528-1167.2010.02669.x (  0) 0) |
| [33] |
Hsieh DT, Whiteway SL, Rohena LO, et al. Tuberous sclerosis complex:five new things[J]. Neurol Clin Pract, 2016, 6(4): 339-347. DOI:10.1212/CPJ.0000000000000260 (  0) 0) |
| [34] |
van Eeghen AM, Chu-Shore CJ, Pulsifer MB, et al. Cognitive and adaptive development of patients with tuberous sclerosis complex:a retrospective, longitudinal investigation[J]. Epilepsy Behav, 2012, 23(1): 10-15. DOI:10.1016/j.yebeh.2011.10.005 (  0) 0) |
| [35] |
Jansen FE, van Huffelen AC, Bourez-Swart M, et al. Consistent localization of interictal epileptiform activity on EEGs of patients with tuberous sclerosis complex[J]. Epilepsia, 2005, 46(3): 415-419. DOI:10.1111/j.0013-9580.2005.31704.x (  0) 0) |
| [36] |
Liang S, Wang S, Zhang J, et al. Long-term outcomes of epilepsy surgery in school-aged children with partial epilepsy[J]. Pediatr Neurol, 2012, 47(4): 284-290. DOI:10.1016/j.pediatrneurol.2012.06.014 (  0) 0) |
| [37] |
Shahid A. Resecting the epileptogenic tuber:what happens in the long term?[J]. Epilepsia, 2013, 54(Suppl 9): 135-138. (  0) 0) |
| [38] |
Jansen FE, van Huffelen AC, Algra A, et al. Epilepsy surgery in tuberous sclerosis:a systematic review[J]. Epilepsia, 2007, 48(8): 1477-1484. DOI:10.1111/j.1528-1167.2007.01117.x (  0) 0) |
| [39] |
Zhang K, Hu WH, Zhang C, et al. Predictors of seizure freedom after surgical management of tuberous sclerosis complex:a systematic review and meta analysis[J]. Epilepsy Res, 2013, 105(3): 377-383. DOI:10.1016/j.eplepsyres.2013.02.016 (  0) 0) |
| [40] |
Kannan L, Vogrin S, Bailey C, et al. Centre of epileptogenic tubers generate and propagate seizures in tuberous sclerosis[J]. Brain, 2016, 139(Pt 10): 2653-2667. (  0) 0) |
| [41] |
Wu JY, Salamon N, Kirsch HE, et al. Noninvasive testing, early surgery, and seizure freedom in tuberous sclerosis complex[J]. Neurology, 2010, 74(5): 392-398. DOI:10.1212/WNL.0b013e3181ce5d9e (  0) 0) |
| [42] |
Roulet-Perez E, Davidoff V, Mayor-Dubois C, et al. Impact of severe epilepsy on development:recovery potential after successful early epilepsy surgery[J]. Epilepsia, 2010, 51(7): 1266-1276. DOI:10.1111/j.1528-1167.2009.02487.x (  0) 0) |
| [43] |
Jiang T, Du J, Raynald, et al. Presurgical administration of mTOR inhibitors in patients with large subependymal giant cell astrocytoma associated with tuberous sclerosis complex[J]. World Neurosurg, 2017, 107: 1053. (  0) 0) |
| [44] |
Carlson C, Teutonico F, Elliott RE, et al. Bilateral invasive electroencephalography in patients with tuberous sclerosis complex:a path to surgery?[J]. J Neurosurg Pediatr, 2011, 7(4): 421-430. DOI:10.3171/2011.1.PEDS10348 (  0) 0) |
| [45] |
Liu SY, An N, Yang MH, et al. Surgical treatment for epilepsy in 17 children with tuberous sclerosis-related West syndrome[J]. Epilepsy Res, 2012, 101(1-2): 36-45. DOI:10.1016/j.eplepsyres.2012.02.017 (  0) 0) |
| [46] |
Kalamangalam GP, Tandon N. Stereo-EEG implantation strategy[J]. J Clin Neurophysiol, 2016, 33(6): 483-489. DOI:10.1097/WNP.0000000000000254 (  0) 0) |
| [47] |
Shenkman Z, Rockoff MA, Eldredge EA, et al. Anaesthetic management of children with tuberous sclerosis[J]. Paediatr Anaesth, 2002, 12(8): 700-704. DOI:10.1046/j.1460-9592.2002.00917.x (  0) 0) |
| [48] |
Okanishi T, Akiyama T, Tanaka S, et al. Interictal high frequency oscillations correlating with seizure outcome in patients with widespread epileptic networks in tuberous sclerosis complex[J]. Epilepsia, 2014, 55(10): 1602-1610. DOI:10.1111/epi.12761 (  0) 0) |
| [49] |
Fujiwara H, Leach JL, Greiner HM, et al. Resection of ictal high frequency oscillations is associated with favorable surgical outcome in pediatric drug resistant epilepsy secondary to tuberous sclerosis complex[J]. Epilepsy Res, 2016, 126: 90-97. DOI:10.1016/j.eplepsyres.2016.07.005 (  0) 0) |
| [50] |
Ma TS, Elliott RE, Ruppe V, et al. Electrocorticographic evidence of perituberal cortex epileptogenicity in tuberous sclerosis complex[J]. J Neurosurg Pediatr, 2012, 10(5): 376-382. DOI:10.3171/2012.8.PEDS1285 (  0) 0) |
| [51] |
Krsek P, Jahodova A, Kyncl M, et al. Predictors of seizure-free outcome after epilepsy surgery for pediatric tuberous sclerosis complex[J]. Epilepsia, 2013, 54(11): 1913-1921. DOI:10.1111/epi.12371 (  0) 0) |
| [52] |
Dogan MS, Gumus K, Koc G, et al. Brain diffusion tensor imaging in children with tuberous sclerosis[J]. Diagn Interv Imaging, 2016, 97(2): 171-176. DOI:10.1016/j.diii.2015.04.002 (  0) 0) |
| [53] |
Asano E, Benedek K, Shah A, et al. Is intraoperative electrocorticography reliable in children with intractable neocortical epilepsy?[J]. Epilepsia, 2004, 45(9): 1091-1099. DOI:10.1111/j.0013-9580.2004.65803.x (  0) 0) |
| [54] |
Oh S, Stewart T, Miller I, et al. In vivo optical properties of cortical tubers in children with tuberous sclerosis complex (TSC):a preliminary investigation[J]. Epilepsia, 2011, 52(9): 1699-1704. DOI:10.1111/j.1528-1167.2011.03167.x (  0) 0) |
| [55] |
Colicchio G, Montano N, Fuggetta F, et al. Vagus nerve stimulation in drug-resistant epilepsies. Analysis of potential prognostic factors in a cohort of patients with long-term follow-up[J]. Acta Neurochir (Wien), 2012, 154(12): 2237-2240. DOI:10.1007/s00701-012-1524-9 (  0) 0) |
| [56] |
Englot DJ, Chang EF, Auguste KI. Vagus nerve stimulation for epilepsy:a meta-analysis of efficacy and predictors of response[J]. J Neurosurg, 2011, 115(6): 1248-1255. DOI:10.3171/2011.7.JNS11977 (  0) 0) |
| [57] |
Fallah A, Weil AG, Wang S, et al. Cost-utility analysis of competing treatment strategies for drug-resistant epilepsy in children with tuberous sclerosis complex[J]. Epilepsy Behav, 2016, 63: 79-88. DOI:10.1016/j.yebeh.2016.07.034 (  0) 0) |
| [58] |
Tovar-Spinoza Z, Ziechmann R, Zyck S. Single and staged laser interstitial thermal therapy ablation for cortical tubers causing refractory epilepsy in pediatric patients[J]. Neurosurg Focus, 2018, 45(3): E9. DOI:10.3171/2018.6.FOCUS18228 (  0) 0) |
| [59] |
梁树立, 刘仕勇, 遇涛, 等.中国TSC相关癫痫外科治疗现状调查[C].第三届中国抗癫痫协会结节性硬化学术会议会刊.北京: 中国抗癫痫协会, 2018: 96-98.
(  0) 0) |
| [60] |
中国抗癫痫协会专家组. 癫痫手术前后抗癫痫药物应用共识[J]. 中华神经科杂志, 2010, 43(7): 484-486. DOI:10.3760/cma.j.issn.1006-7876.2010.07.007 (  0) 0) |
| [61] |
Liang S, Zhang S, Hu X, et al. Anterior corpus callosotomy in school-aged children with Lennox-Gastaut syndrome:a prospective study[J]. Eur J Paediatr Neurol, 2014, 18(6): 670-676. DOI:10.1016/j.ejpn.2014.05.004 (  0) 0) |
| [62] |
Liang S, Li A, Jiang H, et al. Anterior corpus callosotomy in patients with intractable generalized epilepsy and mental retardation[J]. Stereotact Funct Neurosurg, 2010, 88(4): 246-252. DOI:10.1159/000315462 (  0) 0) |
 2019, Vol. 21
2019, Vol. 21


