遗传性血管病、肾病、动脉瘤和肌肉痉挛综合征(hereditary angiopathy, nephropathy, aneurysms and muscle cramps syndrome, HANAC综合征)是一种常染色体显性遗传病,主要临床表现为脑白质病变、动脉瘤、视网膜动脉迂曲、多囊肾、镜下血尿、肌肉痉挛等,通常由COL4A1基因变异所致。2005年,Plaisier等[1]首次报告了1个家系中部分成员表现为血尿、视网膜动脉迂曲、肌肉痛性痉挛,部分成员兼具前述二者或三者。该家系中所有表现为肉眼血尿的成员,均有视网膜动脉迂曲和肌肉痉挛等表现;且部分成员存在脑白质病变、雷诺现象等表现,故该学者认为其可能为一种影响小血管的综合征。该研究团队在2007年又发现了2个类似的家系,家系中多名成员也有相同临床表现。之后,该研究团队在以上3个家系中均检测到COL4A1基因变异,并将相应的疾病命名为HANAC综合征[2]。此外,除HANAC综合征外,其他学者研究发现COL4A1基因变异还可引起脑小血管病伴出血、孔洞脑及穿通脑、脑裂畸形、先天性白内障和青光眼等疾病[3-6],均表现为常染色体显性遗传,且临床异质性较大。至今国外共报道100多例COL4A1基因变异引起的相关疾病,国内尚未见儿童病例报道。现报道1例就诊于中南大学湘雅医院儿科,基因确诊为HANAC综合征的患儿,并总结其临床表现、影像学特点、实验室检查及分子遗传学特点,希望能够增强相关医务人员对COL4A1基因及相关疾病的认识。
1 资料与方法 1.1 研究对象患儿男,1岁8个月,因发热抽搐、发现颅内病变1月余就诊于我院。患儿1月余前无明显诱因出现发热,体温最高39.5℃,体温39℃以上时出现抽搐,表现为四肢强直、双手握拳、呼之不应,持续数分钟后可自行缓解,缓解后如常。不伴呕吐、腹泻、咳嗽等,立即就诊于外院,完善尿常规示隐血(3+);心肌酶:乳酸脱氢酶(LDH)331 U/L(参考值:109~245 U/L),肌酸激酶(CK)706.1 U/L(参考值:<24 U/L),肌酸激酶同工酶(CK-MB)62.5 U/L(参考值:24~190 U/L);血常规、大便常规、肝功能、肾功能、电解质均正常。脑脊液常规、生化、三大染色未见异常。头颅CT示双侧半卵圆中心、双侧侧脑室后角对称性密度减低。头颅MRI示左侧基底节区脑软化灶伴左侧脑室前角扩大,侧脑室周边信号异常。泌尿系B超正常。因影像学提示不明原因颅内病变,建议转上级医院进一步查明病因,遂来我院。自起病以来,患儿饮食、睡眠可,二便正常。
患儿家长诉患儿平时易哭闹,按摩小腿后可缓解,每次持续数分钟,1~2次/周。患儿系第1胎第1产,足月小样儿,出生体重2.4 kg,出生时无窒息抢救史,3月龄竖头稳、追光追物,6月龄独坐,1岁独站,1岁4个月独走,现1岁8个月,可独走,可发“bama”音,可认识爸爸妈妈。父母非近亲结婚,家族史无特殊。
入院体检:头围44.5 cm(<-2 SD),神志清楚,精神反应可,可听懂简单指令,可说简单词语,心肺腹检查未见异常,右侧肢体活动较左侧差,左侧肢体肌力5级,右侧肢体肌力5-级,四肢肌张力正常。膝腱反射正常引出,病理征阴性。
辅助检查:头颅MRI+MRA示1.双侧侧脑室旁白质病变,左侧尾状核头部增大,左侧侧脑室前角扩大;2.右侧大脑前动脉狭窄(图 1)。眼底照相示视网膜血管动静脉比例失调,双侧银线样动脉(图 2)。泌尿系彩超、颈动脉及椎动脉彩超、脑电图检查未见异常。
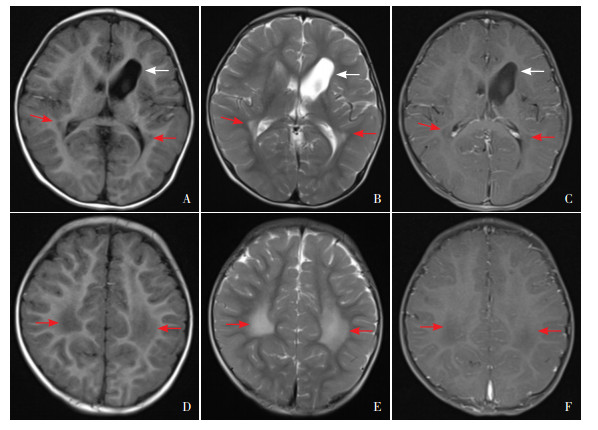
|
图 1 患儿1岁8个月时颅脑MRI平扫增强 图A~C分别为经侧脑室横断面的T1WI、T2WI和增强相,可见双侧侧脑室旁白质对称性信号改变(红色箭头)及左侧侧脑室前角扩大(白色箭头),双侧侧脑室旁白质对称性病灶未见明显强化;图D~F分别为经半卵圆中心横断面的T1WI、T2WI和增强相,可见半卵圆中心白质对称性信号改变(红色箭头),顶叶著,病灶未见明显强化。 |

|
图 2 患儿双侧眼底照相 视网膜血管动静脉比例失调,双侧银线样动脉(红色箭头表示静脉,白色箭头表示动脉,正常动脉应为暗红色)。 |
患儿父母知情同意后,收集患儿和父母4~6 mL EDTA抗凝血,提取基因组DNA,使用IDT xGen® Exome Research Panel v1.0全外显子组捕获芯片,Illumina HiSeq X Ten测序平台进行全外显子组测序,获取原始数据,再进行基因序列的生物信息学分析。以上由北京智因东方转化医学中心完成。
根据二代测序检测结果,对患儿及其父母进行Sanger测序,验证COL4A1基因变异。Sanger测序由北京智因东方转化医学中心完成,测序引物如表 1所示。
| 表 1 Sanger测序验证COL4A1基因变异位点所在DNA序列的扩增和测序引物 |
|
|
本研究获得患儿家长知情同意,以及医院医学伦理委员会批准(2018121146)。
2 结果 2.1 遗传学检查结果全外显子组测序显示患儿COL4A1基因存在c.4150+1(IVS46)G>T的杂合变异,位于46号内含子的鸟嘌呤改变为胸腺嘧啶,为5'端剪切变异,改变RNA前体的剪接方式,可导致翻译的氨基酸序列改变。Sanger测序结果为新发变异,父母均未携带此变异(图 3)。

|
图 3 患儿及其父母COL4A1基因Sanger测序图 患儿COL4A1基因存在c.4150+1(IVS46)G>T杂合变异,父母均未携带此变异。变异位点如箭头所示。 |
查阅万方、知网、维普、人类在线孟德尔遗传数据库(OMIM, http://omim.org)、ClinVar数据库(https://www.ncbi.nlm.nih.gov/clinvar)、人类基因突变数据库(HGMD, http://www.hgmd.cf.ac.uk/ac/index.php)、千人基因组计划(http://browser.1000genomes.org)及基因组聚合数据库(gnomAD, http://gnomad-old.broadinstitute.org),均未发现该位点的记录。根据美国医学遗传学与基因组学学会(American College of Medical Genetics and Genomics, ACMG)序列变异解读标准和指南[7]进行致病性评级,c.4150+1(IVS46)G>T变异致病性评级符合PVS1+PS2+PM2,为致病性变异。
2.2 诊断及确诊依据诊断:HANAC综合征。依据:(1)幼儿男性,隐匿性病程;(2)主要表现为双侧对称性脑白质病变、左侧基底节区脑软化灶形成,眼底照相提示视网膜动脉硬化,有血尿、肌肉痉挛病史;(3)右侧肢体活动较左侧稍差,结合影像学表现,提示既往有卒中病史;(4)COL4A1基因存在致病性新发杂合变异。
2.3 治疗与结局患儿此后无抽搐表现,未予抗癫痫药物治疗。针对其血尿、脑白质病变,目前无有效药物治疗,但患儿易在压力或情绪刺激情况下诱发卒中事件,建议家长尽量减少患儿情绪刺激,并且每隔半年至1年复查头颅MRI+MRA。患儿治疗上予甲钴胺营养神经及其他对症支持治疗。2岁4个月复查MRI示脑白质病变较前无进展,未见动脉瘤形成,尿常规仍提示红细胞镜检(3+),仍有肌肉痉挛,1~2次/周。患儿现3岁,电话随访患儿,一直未发生卒中事件。
3 讨论本例患儿为1岁8个月男性幼儿,隐匿起病;于发热抽搐后完善头颅MRI提示双侧侧脑室后角旁及半卵圆中心对称性长T1长T2信号,左侧基底节区可见一软化灶;查体提示右侧肢体活动较左侧稍差,考虑曾有卒中史。针对不明原因颅内病变,需要从代谢性、炎性、变性、肿瘤、感染、内分泌、遗传、中毒及外伤、卒中方面进行分析。该患儿脑白质病变呈对称性,主要以侧脑室后角旁及双侧半卵圆中心受累,故考虑肿瘤、外伤等可能性不大。患儿无毒物接触史,故排除中毒可能;患儿脑脊液结果正常,且仅发热1 d,无持续发热,考虑炎性、感染性可能性不大。患儿年龄较小,且临床表现无进行性加重趋势,排除变性疾病;血氨正常,起病后无嗜睡、精神差等脑病表现,考虑代谢性病因可能性不大,必要时需完善乳酸、血液氨基酸和酰基肉碱谱分析、尿液有机酸分析、极长链脂肪酸等检查。患儿左侧基底节可见一小软化灶,且左侧侧脑室前角增宽,结合患儿右侧肢体活动较左侧稍差,故需考虑卒中相关因素,结合患儿双侧脑白质异常表现,考虑脑小血管病可能性大。常见的脑小血管病包括常染色体显性遗传性脑动脉病伴皮质下梗死和白质脑病(cerebral autosomal dominant arteriopathy with subcortical infarcts and leukoencephalopathy, CADASIL)、伴有皮质下梗死和白质脑病的常染色体隐性遗传性脑动脉病(cerebral autosomal recessive arteriopathy with subcortical infarcts and leukoencephalopathy, CARASIL)、伴有视网膜病-肾病-卒中的遗传性内皮细胞病(hereditary endotheliopathy with retinopathy, nephropathy and stroke, HERNS),此类疾病有眼、肾等受累,且多为遗传性病因。本例患儿合并有其他系统表现,眼底照相提示动静脉比例失调,双侧银线样动脉,多次尿常规提示镜下血尿,且易哭吵,家长揉小腿后可缓解,考虑为累及多系统的小血管病,故建议完善遗传学检查。
COL4A1基因定位于13q34,其mRNA全长6 549 bp,包含52个外显子,编码Ⅳ型胶原α1链。Ⅳ型胶原是组成基底膜的重要成分,对基底膜的稳定起重要作用,Ⅳ型胶原蛋白α1链及α2链是组成脑血管、肾基底膜及其他组织基底膜的重要组成部分。COL4A1基因由3个蛋白结构域组成:7S结构域、三螺旋结构域及NC1结构域。其中,三螺旋结构域主要编码富含甘氨酸残基的Gly-Xaa-Yaa重复序列,可通过影响Ⅳ型胶原的折叠进而影响基底膜的稳定性而致病。在小鼠中,COL4A1基因变异可妨碍血管的正常组装并引起Ⅳ型胶原蛋白分泌障碍,从而引起小血管畸形,导致脑小血管脆性增加、视网膜动脉迂曲、蛋白尿等表现[8]。HANAC综合征是由于COL4A1变异引起的一种系统性的血管基底膜疾病,其相关变异位点位于COL4A1三螺旋区域的前1/3区域的CB3区,CB3区域的变异可导致Ⅳ型胶原整合素结合位点异常,进而引起Ⅳ型胶原与细胞之间的相互作用异常,可引起眼、脑、肾、肌肉等受累,是一种全身性、多系统疾病[9]。
COL4A1基因变异所致相关疾病均为常染色体显性遗传,如脑小血管病伴出血、孔洞脑及穿通脑、脑裂畸形、脑白质病、HANAC综合征以及眼科疾病如先天性白内障、青光眼、眼前段发育不良、小眼畸形、无眼畸形、视网膜动脉迂曲出血等[1-6, 10-11]。孔洞脑、穿通脑、脑裂畸形是一种严重的颅脑畸形,多于母孕期或新生儿期发现,患儿可有癫痫、智力障碍、截瘫等表现[4-5]。脑白质病、脑出血、眼科疾病可见于各个年龄的患者[3, 6, 10]。
目前国内仅有1例成人HANAC综合征的病例报道[12]。国外有患者具体表型报道的文章共有5篇[1-2, 9, 13-14],包含患者26例。已报道的HANAC综合征患者中,仅有1例儿童患者,年龄11岁,余均为成人患者。目前全球COL4A1基因相关疾病报道100余例,年龄从围产期至71岁。主要影响眼、脑、肾、肌肉、皮肤等系统,儿童病例通常较成人病例重,多有严重脑积水、孔洞脑、癫痫等,成人病例则主要以脑卒中、腔隙性梗死为主要表现。见表 2。
| 表 2 COL4A1基因变异所致儿童与成人相关疾病比较 |
|
|
COL4A1所致相关疾病是一组临床异质性较高的疾病,而导致临床异质性高的原因,既往研究认为与基因型及环境共同作用有关[15]。COL4A1基因变异携带者对于外界环境因素较为敏感,如果妊娠期胎儿受刺激或者出生时受产道挤压等创伤,可引起严重脑积水、孔洞脑、脑裂畸形等改变[6, 9, 16-18],如果影响到眼部,可出现先天性白内障、小眼畸形、眼前段发育不全等表现[3, 6, 10-11, 16-17],中枢神经系统受影响的患儿出生后则出现痉挛性瘫痪、肢体偏瘫、精神运动发育迟缓、智力障碍、癫痫等表现[4, 6, 9, 11, 16, 18-19]。围生期无相关临床表现的携带者,无论在婴幼儿期、其他儿童期、青春期或成年期,可因外界环境刺激如运动应激、高血压、抗凝剂使用等引起颅内出血、卒中、视网膜出血等表现[3, 15]。
以神经系统相关临床表现起病的COL4A1基因相关疾病需要与其他脑小血管病(如CADASIL、CARASIL、HERNS)相鉴别。以上疾病均可表现为偏瘫、偏头痛、癫痫、脑卒中、脑出血、脑白质疏松、腔隙性梗死以及合并眼、肾等疾病表现。COL4A1基因所致脑小血管病起病年龄可由围生期至老年期,新生儿或婴儿期即可有脑卒中、偏瘫等表现,且儿童期患者即有脑白质疏松表现,但是并无血管性痴呆等表现[3, 6, 20]。CADASIL、CARASIL、HERNS等引起的脑小血管病多数成年期起病,且有血管性痴呆等表现。CADASIL主要表现为偏头痛,反复卒中、进行性痴呆等;其脑白质病变多于30岁左右开始出现,35岁后脑白质病变明显,主要表现为侧脑室旁和半卵圆中心长T2信号[21]。CARASIL除了反复卒中、偏头痛、痴呆等表现外,常见脱发、腰腿痛及骨骼变形等表现[22]。HERNS主要表现为视力或视野受损、肾病、反复卒中等,一般30岁以上出现神经系统症状[23]。故针对儿童不明原因脑白质病变并偏瘫、卒中,合并其他系统如血尿、肌肉痉挛、视网膜血管病变,青光眼、白内障等,应考虑COL4A1基因相关疾病。
目前临床上暂无可以明确预防COL4A1相关疾病脑卒中或延缓视网膜迂曲/出血及肾脏损害的靶向药物。最近的动物实验表明,4-苯丁酸钠(sodium 4-phenylbutyrate, 4PBA)可以减少异三聚体的分泌并且预防COL4A1小鼠突变体的颅内出血,但是针对眼、肾等器官的表现无效[24-25]。不同的给药模式可以产生不同效果,4PBA在产前进行干预可以在抑制COL4A1相关的颅内出血和肌病方面达到最大的治疗效果。但是在一组突变体小鼠中,小剂量的4PBA甚至引起了病情恶化。4PBA可能可以作为COL4A1变异所致相关疾病的潜在治疗药物,但是在设计预防、减轻或延缓COL4A1相关疾病的临床试验时必须要谨慎[25]。
COL4A1基因变异所致HANAC综合征是一种系统性的小血管病变性疾病,主要影响小血管,主要表现为脑白质病变、动脉瘤、视网膜动脉迂曲、多囊肾、镜下血尿、肌肉痛性痉挛等,针对有上述表现的患者,需完善COL4A1基因检测,同时应注意家族史的采集。如发现同一个家系,多名成员有上述表现,亦应完善COL4A1基因检测。对于明确有COL4A1基因变异的患者,即使未诊断HANAC综合征,也应建议完善头颅MRI+MRA、尿常规、肾脏彩超、眼底检查,并且需长期随访。对于确诊有COL4A1基因变异的家系,建议完善家系其他成员COL4A1基因检测,明确家族成员携带情况。对于明确有COL4A1变异的家系成员,生育前应进行遗传咨询。对于发生卒中的患者,不建议使用抗凝药物,以免增加卒中后出血转化的风险。
| [1] |
Plaisier E, Alamowitch S, Gribouval O, et al. Autosomal-dominant familial hematuria with retinal arteriolar tortuosity and contractures:a novel syndrome[J]. Kidney Int, 2005, 67(6): 2354-2360. DOI:10.1111/j.1523-1755.2005.00341.x (  0) 0) |
| [2] |
Plaisier E, Gribouval O, Alamowitch S, et al. COL4A1 mutations and hereditary angiopathy, nephropathy, aneurysms, and muscle cramps[J]. N Engl J Med, 2007, 357(26): 2687-2695. DOI:10.1056/NEJMoa071906 (  0) 0) |
| [3] |
Vahedi K, Kubis N, Boukobza M, et al. COL4A1 mutation in a patient with sporadic, recurrent intracerebral hemorrhage[J]. Stroke, 2007, 38(5): 1461-1464. DOI:10.1161/STROKEAHA.106.475194 (  0) 0) |
| [4] |
Breedveld G, de Coo IF, Lequin MH, et al. Novel mutations in three families confirm a major role of COL4A1 in hereditary porencephaly[J]. J Med Genet, 2006, 43(6): 490-495. DOI:10.1136/jmg.2005.035584 (  0) 0) |
| [5] |
Matsumoto T, Miyakoshi K, Fukutake M, et al. Intracranial sonographic features demonstrating in utero development of hemorrhagic brain damage leading to schizencephaly-associated COL4A1 mutation[J]. J Med Ultrason (2001), 2015, 42(3): 445-446. DOI:10.1007/s10396-015-0610-z (  0) 0) |
| [6] |
Sibon I, Coupry I, Menegon P, et al. COL4A1 mutation in Axenfeld-Rieger anomaly with leukoencephalopathy and stroke[J]. Ann Neurol, 2007, 62(2): 177-184. DOI:10.1002/ana.21191 (  0) 0) |
| [7] |
Richards S, Aziz N, Bale S, et al. Standards and guidelines for the interpretation of sequence variants:a joint consensus recommendation of the American College of Medical Genetics and Genomics and the Association for Molecular Pathology[J]. Genet Med, 2015, 17(5): 405-424. DOI:10.1038/gim.2015.30 (  0) 0) |
| [8] |
Gould DB, Phalan FC, Breedveld GJ, et al. Mutations in Col4a1 cause perinatal cerebral hemorrhage and porencephaly[J]. Science, 2005, 308(5725): 1167-1171. DOI:10.1126/science.1109418 (  0) 0) |
| [9] |
Plaisier E, Chen Z, Gekeler F, et al. Novel COL4A1 mutations associated with HANAC syndrome:a role for the triple helical CB3[Ⅳ] domain[J]. Am J Med Genet A, 2010, 152A(10): 2550-2555. DOI:10.1002/ajmg.a.33659 (  0) 0) |
| [10] |
Coupry I, Sibon I, Mortemousque B, et al. Ophthalmological features associated with COL4A1 mutations[J]. Arch Ophthalmol, 2010, 128(4): 483-489. DOI:10.1001/archophthalmol.2010.42 (  0) 0) |
| [11] |
Smigiel R, Cabala M, Jakubiak A, et al. Novel COL4A1 mutation in an infant with severe dysmorphic syndrome with schizencephaly, periventricular calcifications, and cataract resembling congenital infection[J]. Birth Defects Res A Clin Mol Teratol, 2016, 106(4): 304-307. DOI:10.1002/bdra.23488 (  0) 0) |
| [12] |
魏娜, 牛松涛, 李伟, 等. 遗传性血管病、肾病、动脉瘤和肌肉痉挛综合征临床、影像学、病理和基因分析[J]. 中国卒中杂志, 2013, 8(6): 426-431. DOI:10.3969/j.issn.1673-5765.2013.06.005 (  0) 0) |
| [13] |
Alamowitch S, Plaisier E, Favrole P, et al. Cerebrovascular disease related to COL4A1 mutations in HANAC syndrome[J]. Neurology, 2009, 73(22): 1873-1882. DOI:10.1212/WNL.0b013e3181c3fd12 (  0) 0) |
| [14] |
Takenouchi T, Ohyagi M, Torii C, et al. Porencephaly in a fetus and HANAC in her father:variable expression of COL4A1 mutation[J]. Am J Med Genet A, 2015, 167A(1): 156-158. (  0) 0) |
| [15] |
Gould DB, Phalan FC, van Mil SE, et al. Role of COL4A1 in small-vessel disease and hemorrhagic stroke[J]. N Engl J Med, 2006, 354(14): 1489-1496. DOI:10.1056/NEJMoa053727 (  0) 0) |
| [16] |
Shah S, Ellard S, Kneen R, et al. Childhood presentation of COL4A1 mutations[J]. Dev Med Child Neurol, 2012, 54(6): 569-574. DOI:10.1111/j.1469-8749.2011.04198.x (  0) 0) |
| [17] |
Bilguvar K, DiLuna ML, Bizzarro MJ, et al. COL4A1 mutation in preterm intraventricular hemorrhage[J]. J Pediatr, 2009, 155(5): 743-745. DOI:10.1016/j.jpeds.2009.04.014 (  0) 0) |
| [18] |
Shah S, Kumar Y, McLean B, et al. A dominantly inherited mutation in collagen Ⅳ A1(COL4A1) causing childhood onset stroke without porencephaly[J]. Eur J Paediatr Neurol, 2010, 14(2): 182-187. DOI:10.1016/j.ejpn.2009.04.010 (  0) 0) |
| [19] |
Tomotaki S, Mizumoto H, Hamabata T, et al. Severe hemolytic jaundice in a neonate with a novel COL4A1 mutation[J]. Pediatr Neonatol, 2016, 57(6): 522-525. DOI:10.1016/j.pedneo.2014.04.001 (  0) 0) |
| [20] |
Vahedi K, Alamowitch S. Clinical spectrum of type Ⅳ collagen (COL4A1) mutations:a novel genetic multisystem disease[J]. Curr Opin Neurol, 2011, 24(1): 63-68. (  0) 0) |
| [21] |
Chabriat H, Joutel A, Dichgans M, et al. CADASIL[J]. Lancet Neurol, 2009, 8(7): 643-653. DOI:10.1016/S1474-4422(09)70127-9 (  0) 0) |
| [22] |
Hara K, Shiga A, Fukutake T, et al. Association of HTRA1 mutations and familial ischemic cerebral small-vessel disease[J]. N Engl J Med, 2009, 360(17): 1729-1739. DOI:10.1056/NEJMoa0801560 (  0) 0) |
| [23] |
Jen J, Cohen AH, Yue Q, et al. Hereditary endotheliopathy with retinopathy, nephropathy, and stroke (HERNS)[J]. Neurology, 1997, 49(5): 1322-1330. DOI:10.1212/WNL.49.5.1322 (  0) 0) |
| [24] |
Hayashi G, Labelle-Dumais C, Gould DB. Use of sodium 4-phenylbutyrate to define therapeutic parameters for reducing intracerebral hemorrhage and myopathy in Col4a1 mutant mice[J]. Dis Model Mech, 2018, 11(7): pii:dmm034157. DOI:10.1242/dmm.034157 (  0) 0) |
| [25] |
Jones FE, Murray LS, McNeilly S, et al. 4-Sodium phenyl butyric acid has both efficacy and counter-indicative effects in the treatment of Col4a1 disease[J]. Hum Mol Genet, 2019, 28(4): 628-638. DOI:10.1093/hmg/ddy369 (  0) 0) |
 2019, Vol. 21
2019, Vol. 21


