国外学者研究结果显示,哮喘患儿与正常儿童的呼出气温度(exhalation breath temperature, EBT)存在显著差异[1-2],经过治疗病情得到良好控制或因某种诱因如病毒感染加重后,EBT可能发生降低或升高[3-4];另一位国外学者研究发现,未控制的持续性哮喘病人EBT水平显著高于较好控制的哮喘患者[5]。国内有学者研究发现,肺癌患者的EBT升高,EBT有望作为一种新的无创的筛查和监测肺癌的方法[6]。但国内有关EBT和儿童哮喘气道炎症的研究暂未见报道。哮喘是一种慢性炎症疾病,其本质就是慢性气道炎症[7]。炎症,是一种普遍的病理反应,其特征之一是产生更多的热量及更高的温度。哮喘气道壁的组织病理学检查显示了血管的折皱,而可溶性惰性气体吸收方法显示了哮喘患者支气管血流的增加[8]。这些变化可能导致气道温度的变化,甚至引起支气管重塑[9]。因此,本研究提出EBT可以反映哮喘气道的热量,从而作为气道炎症标志的假设。呼出气一氧化氮(FeNO)是另外一种已经应用于临床的无创性且非特异性气道炎症指标,但由于气道炎症的复杂性,并未作为一般哮喘患儿的治疗指导[10]。中文版儿童哮喘控制测试(C-ACT)测量工具能较好地反映患儿4周内哮喘的控制水平,被广泛应用于儿童哮喘控制[11]。本研究根据哮喘患儿复诊时的C-ACT评分将患儿分为不同控制水平的三组,比较了三组初诊和复诊时EBT的变化以及三组间EBT水平的差异,以探讨EBT对哮喘患儿气道炎症变化的预测意义,旨在为监测儿童哮喘的炎症控制情况提供更多的循证医学依据。
1 资料与方法 1.1 研究对象选择2017年10月至2018年9月在我院哮喘门诊初诊为支气管哮喘的60例6~11岁患儿作为研究对象。支气管哮喘的诊断标准参照《儿童支气管哮喘诊断与防治指南(2016年版)》[12],以下简称《指南》。
纳入标准:根据《指南》[12]诊断标准为轻度哮喘急性发作,哮喘严重程度分级为轻度,且哮喘控制水平为部分控制或未控制(C-ACT评分≤22),从未接受过规范化的哮喘治疗或曾接受吸入疗法但停药至少3个月以上。
排除标准:患有其他肺部或全身慢性疾病如囊肿性纤维化、支气管肺发育不良、原发性纤毛运动障碍综合征等;在检测前4周内曾有急慢性发热性疾病或接受过激素等治疗;因各种原因未能完成各项检测者。
根据纳入和排除标准,共60例哮喘患儿纳入研究。另选60名健康儿童作为对照组。入组时两组儿童一般资料的比较差异无统计学意义(P > 0.05),见表 1。
| 表 1 哮喘组与对照组一般资料的比较 |
|
|
本研究的研究方法、预期结果及风险防控均报请医院伦理委员会批准,且告知患儿及患儿监护人并签署知情同意书。
1.2 方法初诊时哮喘组检测EBT水平,并记录C-ACT评分,对照组检测指标同哮喘组。哮喘患儿1个月后复诊,根据患儿病情变化分组,即根据C-ACT测试评分,分为良好控制组(C-ACT评分≥23)、部分控制组(20≤C-ACT评分≤22)和未控制组(C-ACT评分≤19)[13],三组一般资料的比较差异无统计学意义(P > 0.05),见表 2。
| 表 2 不同控制水平三组一般资料的比较 |
|
|
检测三组的EBT和C-ACT评分,分析EBT和FeNO的相关性,并追溯初诊数据,比较初诊时三组EBT水平和C-ACT评分,最后将复诊与初诊EBT水平和C-ACT评分进行比较。
C-ACT评估前由专科医师详细向患儿家长解释填写要求及方法,填写完毕后由专科医生核对并统计分数[13]。应用最新的三代产品(X-halo)检测患儿的EBT水平[6]。检测者双手握住设备,吹气前通过鼻孔吸气,呼气时需在适合患者正常的潮式呼吸模式下的速度和深度自由地通过烟嘴口把气体吹进仪器中,当气体存储腔内的温度达到平稳状态后,吹气结束,结果读出;休息15 min后重复上述试验,取3次结果(相差 < 10%)平均值为最终测量值。
EBT测量尽量安排在早饭后1 h、腋下温度测量后30 min进行。一般安排在上午8 : 30~10 : 00,室温19~25℃,相对湿度30%~60%。
FeNO的测量采用瑞典尼尔斯(NIOX)呼出气一氧化氮检测仪,根据美国胸科学会/欧洲呼吸学会(ATS/ERS)测量方法[14]以及参照骆学勤等[15]文献资料进行操作,以3次测量值(相差 < 10%)取平均值为最终测量值。测量单位以ppb(1 ppb=1 μg/L)表示。
1.3 统计学分析采用SPSS 13.0统计软件进行统计学分析。正态分布的计量资料采用均数±标准差(x±s)表示,两组均数比较采用独立样本t检验或配对t检验,三组均数比较采用独立设计的单因素方差分析,并采用SNK法进行组间两两比较。计数资料用例数和百分比(%)表示,组间比较采用χ2检验。采用Pearson相关分析进行指标间的相关性检验。P < 0.05为差异有统计学意义。
2 结果 2.1 初诊哮喘组和对照组EBT和C-ACT评分的比较初诊时,哮喘组EBT水平明显高于对照组,C-ACT评分明显低于对照组(P < 0.05),见表 3。
| 表 3 初诊哮喘组和对照组EBT和C-ACT评分的比较 |
|
|
复诊时,不同控制水平的三组间EBT比较差异有统计学意义(P < 0.05),组间两两比较差异均有统计学意义,即未控制组 > 部分控制组 > 良好控制组。三组间C-ACT评分的比较差异也有统计学意义(P < 0.05),组间两两比较差异均有统计学意义,即良好控制组 > 部分控制组 > 未控制组(P < 0.05)。追溯其初诊数据,三组EBT水平和C-ACT评分的组间比较差异均无统计学意义(P > 0.05)。见表 4。
| 表 4 复诊及初诊不同控制水平的三组EBT和C-ACT评分的横向及纵向比较(x±s) |
|
|
与初诊比较,复诊时良好控制组EBT水平明显降低(P < 0.05),部分控制组和未控制组明显升高(均P < 0.05);良好控制组和部分控制组C-ACT评分明显升高,未控制组明显降低(均P < 0.05)。见表 4。
2.4 复诊EBT与FeNO水平的相关性分析复诊时良好控制组、部分控制组和未控制组的FeNO水平分别为17.3±1.9、21.9±2.1和29.2±2.1 ppb。良好控制组和部分控制组EBT与FeNO无显著相关性(分别r=0.182,P=0.356;r=0.207,P=0.320);未控制组EBT与FeNO呈显著正相关(r=0.470,P=0.037)。见图 1。
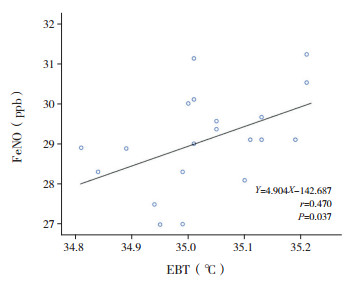
|
图 1 未控制组EBT和FeNO水平的相关性 |
哮喘是儿童常见的呼吸系统慢性疾病,患病人数呈逐年上升趋势[16]。近几年,关于儿童哮喘控制方面的国内外研究有很多,在诊疗技术方面也取得了很大成果,《指南》明确提到了FeNO作为气道炎症指标检测项目[12],这是一种早期、方便、无创的哮喘检测手段,非常适合哮喘患儿检测。目前,还有一些尚未完全认识的反映气道炎症的无创性检测手段,如EBT [17]。既往研究已经证明,哮喘与气道血流增加有关,无论是由于新血管的形成、血管舒张或炎症,支气管循环的改变可以通过EBT改变来反映气流温度[8]。EBT作为一种新的气道炎症标志物,有关成人和儿童哮喘患者的EBT研究在国外已有相关报道,但存在争议[18]。有学者发现哮喘患者EBT水平显著高于健康对照组[19];另外有学者研究发现哮喘病人EBT水平没有显著高于正常成年人,但哮喘患者的EBT增长率显著高于正常人[2]。本研究发现,哮喘患儿EBT水平显著高于健康儿童。这一结果与某些国外学者的研究结果类似[19],提示哮喘患儿始终存在气道炎症,炎症的本质即发热,血管流速加快,导致EBT升高。但与个别国外学者报道不同[2],这可能与研究对象的年龄、测量指标的选择、检测方法等不同有关[20]。
国外学者研究发现,有气喘等症状或没有得到良好控制的哮喘患者EBT水平显著高于没有症状或得到良好控制的患者[5, 21];Ntontsi等[22]发现严重的难治性哮喘患者的EBT显著高于轻中度哮喘患者。但Crespo Lessmann等[23]检测哮喘维持治疗患者的EBT水平,发现在哮喘不同控制水平、不同严重程度的组间比较EBT水平无显著差异。本研究对初诊患者经抗炎等治疗,1个月后复诊发现,有些患儿病情得到良好控制,有些患儿病情呈慢性持续状态,有些患儿比初诊时加重(原因可能是未严格执行医嘱规范用药或其他诱因),根据哮喘病情控制水平,按照C-ACT评分分为良好控制组、部分控制组和未控制组,比较不同控制水平的三组患儿EBT复诊结果发现,未控制组 > 部分控制组 > 良好控制组。这一结果与某些国外学者的研究结果类似[21],提示气道炎症严重程度可能与EBT水平高低有关,炎症越严重,气道血管充血越多,血流越快,EBT水平可能更高。但与个别国外学者报道不同[23],这可能与患者是否接受规范化治疗,是否有其他诱因加重哮喘等因素有关。本研究追溯不同控制水平的三组患儿初诊EBT,发现三组间EBT比较无显著差异,提示初诊时患儿气道炎症严重程度差别不大,具有可比性。
国外学者研究发现,未得到控制的哮喘患者尤其在病情急性加重期间,其EBT显著高于健康对照组,抗炎治疗后EBT显著降低[24];国外学者观察同一患儿在病情平稳和病情恶化两个阶段,发现EBT水平在病情恶化时明显升高[3];另一位学者发现,病毒诱导的哮喘轻度加重患儿EBT水平比相同表型的无症状的哮喘患儿高出大约1℃,没有显著性差异,但EBT增长率更显著[4]。本研究发现,随着时间的推移(1个月后复诊),特别是在病情好转或加重期间(良好控制或未控制),EBT明显降低或升高。这一结果与某些国外学者的研究结果类似[3, 24],提示随着哮喘患儿哮喘病情好转或加重即气道炎症好转或恶化,间接表现在EBT水平的降低或升高,说明EBT对哮喘患儿气道炎症变化具有重要的预测意义。但与个别国外学者报道不同[4],这可能与研究对象年龄段不同、标本量太少掩盖了真实的差异等因素有关。总之,上述结果均提示EBT作为新的无创性的气道炎症标志物,与基础值进行比较,其升高可能提示气道炎症加重,降低提示气道炎症减轻。因此,我们推测,检测EBT水平对预测哮喘患儿气道炎症变化有重要的临床意义。
C-ACT测试是根据患儿近4周的临床症状来评估哮喘控制状况的一个简单的问卷量表,该问卷由7个问题组成,满分27分[25]。该问卷于2007年完成汉化工作,并于当年对其进行为期3个月的多中心、大样本观察评估,认为中文版C-ACT有着良好的信度和效度[13]。经过近几年在临床上的应用,经过多年临床应用研究,多数认为C-ACT可以很好反映哮喘患儿病情控制情况[13]。本研究结果显示,哮喘患儿初诊时C-ACT评分明显低于健康儿童且均≤22分。1个月后复诊时根据C-ACT评分分成三组,三组间C-ACT评分差异有统计学意义,即完全控制组 > 部分控制组 > 未控制组。不同控制水平的这三组初诊C-ACT评分比较无显著差异,提示三组具有可比性。随着时间的推移(1个月后复诊),特别是在病情好转或恶化期间(良好控制或未控制),C-ACT评分明显升高或降低。上述结果再次验证了C-ACT评分可以很好反映哮喘患儿病情控制水平,同时,本研究基于C-ACT评分进行分组亦有了数据支持。
关于EBT和FeNO的相关性研究,目前存在争议。国外学者研究发现哮喘患儿的EBT和FeNO水平呈正相关[26-27]。另一位国外学者对研究对象没有设置任何限制条件(是否近期感染、环境温度、检测前是否安静等均不设限),结果发现EBT和FeNO水平无相关性[28]。本研究结果显示,复诊时未控制组EBT与FeNO水平呈正相关,部分控制组和完全控制组二者无相关性,这与之前的研究结果类似[26-27],提示哮喘患儿在未控制情况下,EBT与FeNO联合检测能更全面评估气道炎症。
综上所述,EBT作为一种新的无创性的气道炎症标志物,根据C-ACT评分对哮喘控制水平进行量化分组,随着病情好转(良好控制)或恶化(未控制),EBT明显降低或升高,提示EBT对哮喘患儿气道炎症变化有重要的预测意义,定期监测EBT水平可能对哮喘患儿气道炎症严重程度有预测作用,结合FeNO检测能更全面评估气道炎症。目前国内关于EBT的研究还较少,需要进行更多的临床研究,收集更多有用的数据,为儿童哮喘的监测提供更多循证医学依据。新一代方便实用无创的EBT检测仪已经问世,希望不久将应用到临床实践中。
| [1] |
Svensson H, Nilsson D, Bjermer L, et al. Exhaled breath temperature increases after exercise in asthmatics and controls[J]. Respiration, 2012, 84(4): 283-290. DOI:10.1159/000335252 (  0) 0) |
| [2] |
Paredi P, Kharitonov SA, Barnes PJ. Faster rise of exhaled breath temperature in asthma:a novel marker of airway inflammation?[J]. Am J Respir Crit Care Med, 2002, 165(2): 181-184. DOI:10.1164/ajrccm.165.2.2103053 (  0) 0) |
| [3] |
Wojsyk-Banaszak I, Mikoś M, Szczepankiewicz A, et al. Evaluation of exhaled breath temperature (EBT) as a marker and predictor of asthma exacerbation in children and adolescents[J]. J Asthma, 2017, 54(7): 699-705. DOI:10.1080/02770903.2017.1290104 (  0) 0) |
| [4] |
Xepapadaki P, Xatziioannou A, Chatzicharalambous M, et al. Exhaled breath temperature increases during mild exacerbations in children with virus-induced asthma[J]. Int Arch Allergy Immunol, 2010, 53(1): 70-74. (  0) 0) |
| [5] |
García G, Bergna M, Uribe E, et al. Increased exhaled breath temperature in subjects with uncontrolled asthma[J]. Int J Tuberc Lung Dis, 2013, 17(7): 969-972. DOI:10.5588/ijtld.12.0657 (  0) 0) |
| [6] |
牟向东, 刘清华. 呼出气温度可作为一种新的无创的检测肺癌的方法吗[J]. 中华结核和呼吸杂志, 2015, 38(6): 466. (  0) 0) |
| [7] |
殷凯生. 气道炎症评估是支气管哮喘控制评估的核心[J]. 中华结核和呼吸杂志, 2015, 38(5): 324-325. DOI:10.3760/cma.j.issn.1001-0939.2015.05.002 (  0) 0) |
| [8] |
Paredi P, Kharitonov SA, Barnes PJ. Correlation of exhaled breath temperature with bronchial blood flow in asthma[J]. Respir Res, 2005, 6: 15. DOI:10.1186/1465-9921-6-15 (  0) 0) |
| [9] |
Piacentini GL, Peroni DG, Bodini A, et al. Exhaled breath temperature as a marker of airway remodelling in asthma:a preliminary study[J]. Allergy, 2008, 63(4): 484-485. DOI:10.1111/j.1398-9995.2007.01622.x (  0) 0) |
| [10] |
Jartti T, Wendelin-Saarenhovi M, Heinonen I, et al. Childhood asthma management guided by repeated FeNO measurements:a meta-analysis[J]. Paediatr Respir Rev, 2012, 13(3): 178-183. DOI:10.1016/j.prrv.2011.11.002 (  0) 0) |
| [11] |
丁国玉, 虞琳, 李昌崇, 等. 儿童哮喘控制测试在轻中度哮喘患儿中的应用[J]. 温州医学院学报, 2013, 43(8): 542-544. (  0) 0) |
| [12] |
中华医学会儿科学分会呼吸学组. 儿童支气管哮喘诊断与防治指南(2016年版)[J]. 中华儿科杂志, 2016, 54(3): 167-181. DOI:10.3760/cma.j.issn.0578-1310.2016.03.003 (  0) 0) |
| [13] |
李博, 刘恩梅, 任洛, 等. 儿童哮喘控制测试与肺功能相关性研究[J]. 中国实用儿科杂志, 2012, 27(4): 292-295. (  0) 0) |
| [14] |
Dweik RA, Boggs PB, Erzurum SC, et al. An official ATS clinical practice guideline:interpretation of exhaled nitric oxide levels (FENO) for clinical applications[J]. Am J Respir Crit Care Med, 2011, 184(5): 602-615. DOI:10.1164/rccm.9120-11ST (  0) 0) |
| [15] |
骆学勤, 刘恩梅, 符州, 等. 呼出气一氧化氮与儿童哮喘控制测试和支气管激发试验指标相关性研究[J]. 中国实用儿科杂志, 2013, 28(7): 533-536. (  0) 0) |
| [16] |
Bateman ED, Hurd SS, Barnes PJ, et al. Global strategy for asthma management and prevention:GINA executive summary[J]. Eur Respir J, 2008, 31(1): 143-178. DOI:10.1183/09031936.00138707 (  0) 0) |
| [17] |
Ferraro V, Carraro S, Bozzetto S, et al. Exhaled biomarkers in childhood asthma:old and new approaches[J]. Asthma Res Pract, 2018, 4: 9. DOI:10.1186/s40733-018-0045-6 (  0) 0) |
| [18] |
Melo RE, Popov TA, Solé D. Exhaled breath temperature, a new biomarker in asthma control:a pilot study[J]. J Bras Pneumol, 2010, 36(6): 693-699. DOI:10.1590/S1806-37132010000600005 (  0) 0) |
| [19] |
Kim SY, Kim JY, Han YK, et al. Clinical implication of exhaled breath temperature measurement in pediatric asthma[J]. Allergy Asthma Respir Dis, 2017, 5(3): 147-152. DOI:10.4168/aard.2017.5.3.147 (  0) 0) |
| [20] |
Stoeva T, Tzocheva I, Mileva S, et al. Exhaled breath temperature in children with asthma, correlation with spirometry, blood eosinophils and exhaled nitric oxide[J]. Merit Res J Med Med Sci, 2017, 5(6): 318-324. (  0) 0) |
| [21] |
Leonardi S, Cuppari C, Lanzafame A, et al. Exhaled breath temperature in asthmatic children[J]. J Biol Regul Homeost Agents, 2015, 29(2 Suppl 1): 47-54. (  0) 0) |
| [22] |
Ntontsi P, Bakakos P, Papathanasiou E, et al. Exhaled breath temperature in optimally treated asthmatics:severity and underlying mechanisms[J]. J Breath Res, 2018, 12(2): 026013. DOI:10.1088/1752-7163/aa9d46 (  0) 0) |
| [23] |
Crespo Lessmann A, Giner J, Torrego A, et al. Usefulness of the exhaled breath temperature plateau in asthma patients[J]. Respiration, 2015, 90(2): 111-117. DOI:10.1159/000431259 (  0) 0) |
| [24] |
Popov TA, Dunev S, Kralimarkova TZ, et al. Evaluation of a simple, potentially individual device for exhaled breath temperature measurement[J]. Respir Med, 2007, 101(10): 2044-2050. DOI:10.1016/j.rmed.2007.06.005 (  0) 0) |
| [25] |
谭力, 张泉, 吴澄清, 等. 儿童哮喘控制水平的影响因素和评估指标分析[J]. 中国当代儿科杂志, 2016, 18(9): 812-816. (  0) 0) |
| [26] |
Piacentini GL, Peroni D, Crestani E, et al. Exhaled air temperature in asthma:methods and relationship with markers of disease[J]. Clin Exp Allergy, 2007, 37(3): 415-419. DOI:10.1111/j.1365-2222.2007.02663.x (  0) 0) |
| [27] |
Piacentini GL, Bodini A, Zerman L, et al. Relationship between exhaled air temperature and exhaled nitric oxide in childhood asthma[J]. Eur Respir J, 2002, 20(1): 108-111. DOI:10.1183/09031936.02.00237702 (  0) 0) |
| [28] |
Hamill LM, Ferris KCA, Kapande KM, et al. Is exhaled breath temperature the new asthma inflammometer[J]. Arch Dis Child, 2012, 97(Suppl 1): A29-A30. (  0) 0) |
 2019, Vol. 21
2019, Vol. 21


