2. 重庆医科大学附属儿童医院儿科研究所, 重庆 400014;
3. 儿童发育疾病研究教育部重点实验室, 重庆 400014;
4. 儿童感染免疫重庆市重点实验室, 重庆 400014
毛细支气管炎是2岁以内儿童,尤其是6个月以内小婴儿常见的下呼吸道感染性疾病[1]。因发病率高,给社会造成的经济负担重,毛细支气管炎已成为全球广泛关注的公共卫生问题[2]。目前,毛细支气管炎的治疗仍以对症支持为主[3],缺乏安全有效的治疗方法。阿奇霉素(azithromycin, AZM)作为一种常用抗生素,除抗菌作用外,还具有调节免疫减轻气道炎症[4-8]、抗病毒[9-12]、减少气道黏液生成[13-15]等作用,统称为抗菌外作用。目前其抗炎作用已被广泛应用于治疗肺囊性纤维化、慢性阻塞性肺疾病、非囊性纤维化支气管扩张、闭塞性细支气管炎等慢性气道炎症性疾病[16]。已有动物实验证明,在毛细支气管炎小鼠模型中,AZM可减轻急性期肺部中性粒细胞浸润,并有效降低感染后期肺部炎症介质水平[17]。但纵观目前AZM辅助治疗毛细支气管炎的临床研究,不仅使用指征、剂量及疗程尚未统一,而且在能否减轻临床症状、缩短住院时间、降低远期反复喘息及哮喘发生等问题上仍存在分歧。本文旨在通过系统评价的方式评价AZM辅助治疗毛细支气管炎的有效性,为临床应用提供依据。
1 资料与方法 1.1 文献检索策略以“azithromycin”、“bronchiolitis”或“阿奇霉素”、“毛细支气管炎”为检索词检索PubMed、EBSCO、Embase、Cochrane图书馆、中国知网、万方数据库、维普中文科技期刊数据库,检索时间为建库至2019年2月17日,获取已经公开发表的AZM辅助治疗毛细支气管炎的临床随机对照试验,并手工检索纳入文献及排除内容相关的综述,最大限度减少遗漏。
1.2 文献纳入及排除标准纳入标准:(1)研究类型为临床随机对照试验;(2)研究对象为小于2岁的临床诊断为毛细支气管炎的住院患儿,无明确使用AZM适应症(如支原体、衣原体感染),除外合并先天性心脏病、先天性气道发育异常、慢性肺部疾病、营养不良等;(3)干预措施:实验组干预措施为静脉输注或口服AZM,剂量不限,疗程不限,对照组除未使用AZM外其余治疗措施均与实验组相同;(4)结局指标:主要结局指标包括住院时间、用氧时间、喘息缓解时间、咳嗽缓解时间,次要结局指标包括再入院或喘息再发生、血清及鼻咽抽吸物IL-8水平、血清半胱氨酰白三烯水平、48 h鼻咽部菌群分析;(5)文献语种限制为英文及中文。
排除标准:(1)研究类型非临床随机对照试验;(2)研究内容为药代动力学研究、药理机制、动物细胞实验或其他与本文研究内容不符合的文献;(3)综述、个案报道、通讯论文等形式不符合的文献;(4)重复报道和数据信息不完整的研究。
1.3 文献筛选过程分别由2人按照已定的文献检索策略进行检索,根据纳入及排除标准,首先通过阅读文章标题及摘要排除明显主题或类型不符的文献,再通过阅读全文明确是否纳入。对有争议的文献,讨论后若无法达成共识,则请具有相关专业背景的第3人加入讨论,最终达成共识。
1.4 资料提取根据Cochrane图书馆推荐的方法制作资料提取表,纳入文献的基本资料信息包括:研究者姓名、发表时间、样本数量、年龄、干预方式、疗程、结局指标。先分别由2人单独提取文献信息,然后交叉核对信息,若意见不统一,则请第3人加入讨论,最终达成共识。
1.5 文献质量评价根据Cochrane图书馆推荐的方法对纳入文献采用Jadad评分法进行文献质量评价。根据纳入临床试验的随机方法及其隐匿、盲法、退出与失访病例的原因及例数3个方面进行评分。≤2分视为低质量研究,≥3分视为较高质量研究。先分别由2人进行,若意见不统一,则请第3人加入讨论,最终达成共识。
1.6 统计学分析采用RevMan 5.3软件对数据进行统计学分析。使用Q检验和和I2检验对纳入研究进行异质性分析,若P < 0.05,且I2 > 50%则认为异质性具有统计学差异,采用随机效应模型,反之,则采用固定效应模型。若合并统计量为连续性资料,则采用均数差(MD)及95%可信区间(CI)为效应量,并对合并统计量进行Z检验。若合并统计量为二分类资料,则采用比值比(OR)及95%CI为效应量,同样对合并统计量进行Z检验。运用漏斗图判断纳入文献是否存在发表偏倚。P < 0.05为差异有统计学意义。
2 结果 2.1 纳入文献一般情况共检索到836篇文献,其中中文文献203篇,英文文献633篇。通过查重、阅读文章标题及摘要,排除757篇文献,进一步阅读全文后,排除文献65篇,最终纳入14个随机对照试验研究。纳入文献的基本情况见表 1。
| 表 1 纳入文献基本信息 |
|
|
最终纳入14篇研究,采用Jadad计分法进行质量评分,结果有5篇文献评分≥3分,为高质量研究,有9篇文献评分≤2分,为低质量研究。见表 2。
| 表 2 Jadad评分 |
|
|
共6篇文献以住院时间作为结局指标,其中5篇采用均数±标准差为效应量,纳入Meta分析,1篇采用中位数(四分位间距)为效应量[21],故排除。异质性检验结果显示,各研究间无显著异质性(χ2=6.26,P=0.18,I2=36%),因此采用固定效应模型。合并效应量结果显示,AZM辅助治疗毛细支气管炎不能缩短住院时间(P=0.08)(图 1)。这一结果与上述另1篇未纳入Meta分析的文献[21]报道的结果一致。
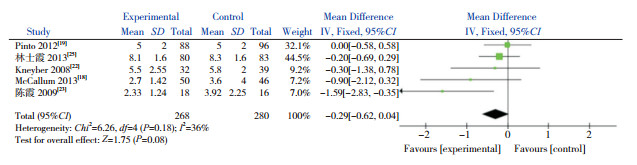
|
图 1 AZM对住院时间的影响 |
共5篇文献以用氧时间作为结局指标,其中4篇采用均数±标准差为效应量,纳入Meta分析,1篇采用中位数(四分位间距)为效应量[21],故排除。异质性检验结果显示,各研究间无显著异质性(χ2=4.76,P=0.19,I2=37%),因此采用固定效应模型。合并效应量结果显示,AZM辅助治疗毛细支气管炎不能缩短用氧时间(P=0.10)(图 2)。此结果与上述另1篇未纳入Meta分析的文献[21]报道的结果一致。
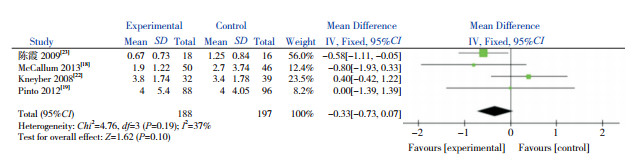
|
图 2 AZM对用氧时间的影响 |
有3篇文献以喘息缓解时间作为结局指标,且都以均数±标准差为效应量,故对这3篇文献进行Meta分析。异质性检验结果显示,各研究间存在显著异质性(χ2=8.48,P=0.01,I2=76%),因此采用随机效应模型。合并效应量结果显示,AZM组较对照组能缩短喘息缓解时间(P=0.007)(图 3)。
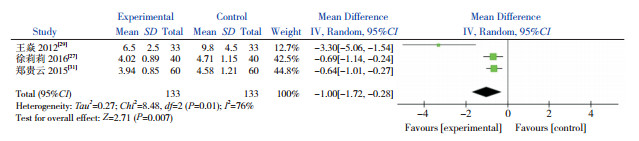
|
图 3 AZM对喘息缓解时间的影响 |
有2篇文献以咳嗽缓解时间作为结局指标,且都以均数±标准差为效应量,故对这2篇文献进行Meta分析。异质性检验结果显示,两个研究间无显著异质性(χ2=0.32,P=0.57,I2=0%),因此采用固定效应模型。合并效应量结果显示,AZM组较对照组能缩短咳嗽缓解时间(P < 0.00001)(图 4)。
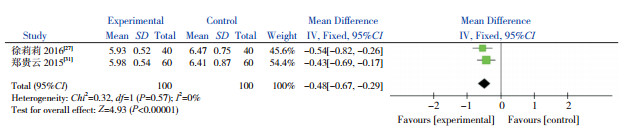
|
图 4 AZM对咳嗽缓解时间的影响 |
共有2篇文献在0 h、48 h对患儿的鼻咽部抽吸物进行菌群分析,故对这2篇文献进行Meta分析。异质性检验结果显示,在对不同菌群进行分析时,两研究间均无显著异质性(P > 0.05,I2=0%),因此采用固定效应模型。合并效应量分析结果显示,AZM组较对照组能降低肺炎链球菌的检出率(P=0.0006)(图 5)、嗜血杆菌属的检出率(P=0.0002)(图 6)和卡他莫拉菌的检出率(P < 0.00001)(图 7),但不能降低金黄色葡萄球菌的检出率(P=0.28)(图 8)。
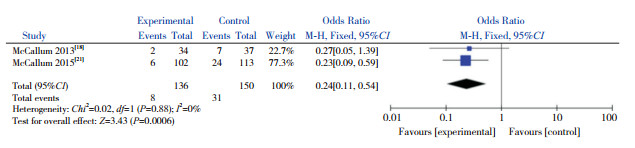
|
图 5 AZM对肺炎链球菌检出率的影响 |
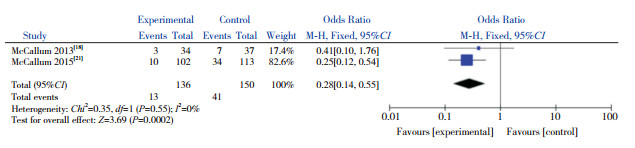
|
图 6 AZM对嗜血杆菌属检出率的影响 |
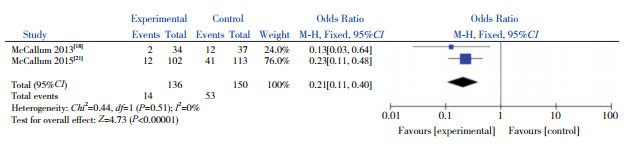
|
图 7 AZM对卡他莫拉菌检出率的影响 |
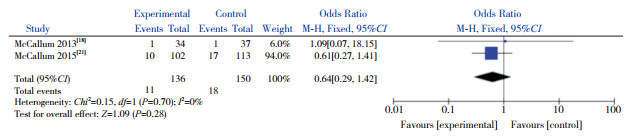
|
图 8 AZM对金黄色葡萄球菌检出率的影响 |
为解决纳入文献质量高低所带来的差异性,根据文献质量评价结果除去9篇低质量的研究,重新进行Meta分析,结果显示,敏感性分析与总体Meta森林图分析的结果趋向一致,提示纳入文献的差异性较小,见表 3。
| 表 3 敏感性分析 |
|
|
因AZM辅助治疗毛细支气管炎气道炎症以住院时间为主要结局指标纳入的文献最多,故选取以住院时间为主要结局指标绘制漏斗图(图 9)。图形基本对称,但由于纳入文献少,对发表偏倚的评价意义有限。
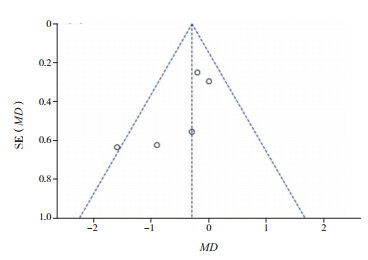
|
图 9 基于住院时间的漏斗图 |
毛细支气管炎是2岁以内儿童,尤其是6个月以内小婴儿常见的下呼吸道感染,给社会造成严重的经济负担,且生命早期重症毛细支气管炎与哮喘的发生相关。目前该病仍以吸氧吸痰等支持治疗为主,缺乏安全有效的特异性治疗方法。AZM作为一种常用抗生素,除抗菌作用外,还具有调节多种免疫细胞、破坏生物膜、减少气道黏液生成等作用,目前已广泛运用于治疗慢性气道炎症性疾病,尤其是中性粒细胞浸润性气道炎症。毛细支气管炎的病原侵犯直径为75~300 μm的细支气管,引起上皮细胞坏死、脱落、凋亡,释放促炎细胞因子募集中性粒细胞、巨噬细胞形成炎症浸润。损伤的黏膜充血、水肿造成管腔狭窄,诱发喘息。气道腺体、杯状细胞增生,黏液分泌增加,气道狭窄加重出现喘息,肺泡通气换气功能下降出现呼吸困难[32],因此气道炎症程度、通畅情况是影响毛细支气管炎病情严重程度的重要因素。
本Meta分析结果显示AZM辅助治疗不能缩短住院时间及用氧时间,分析原因可能是本研究纳入的文献由于诊疗水平不同,无统一及明确的住院、出院及吸氧指征,部分研究质量评价不高。此外,纳入的研究数量有限,样本量较小,无相关分层数据,不能进行重症毛细支气管炎患儿、转入ICU患儿、使用机械辅助通气患儿的住院时间、用氧时间的分层分析,都限制了本研究的临床指导意义。虽然本Meta分析结果显示AZM能相对缩短症状(如喘息、咳嗽)的缓解时间,但其缩短时间均不超过1 d,因此,其临床指导意义相对有限。AZM可通过抑制转录因子NF-κB,抑制促炎细胞因子如IL-8、粒细胞-巨噬细胞集落刺激因子、IL-6的转录[4],减少中性粒细胞及巨噬细胞向炎症部位的迁移,减轻气道炎症。一项关于毛细支气管炎严重程度的临床研究显示,IL-8水平与严重程度呈正相关[7],气管插管、机械辅助通气的患儿血清IL-8水平更高[6]。本文纳入的研究也证实了AZM可以通过降低IL-8水平减轻气道炎症[20]。
气道上皮完整时不易发生气源性致敏,一旦呼吸道黏膜层破坏后,致敏原即可到达黏膜下层,与抗原提呈细胞、炎症细胞相互作用,从而致敏[33]。AZM可减轻气道炎症,减轻气道纤毛上皮细胞的损伤,保护气道上皮的完整性,并且AZM可以通过调节细胞因子的生成,调节Th1类应答与Th2类应答之间的平衡。此外,已有的一项对1 016名毛细支气管炎患儿鼻咽部抽吸物病毒检测及菌群分析的研究发现,呼吸道合胞病毒(RSV)感染后易合并肺炎链球菌感染,鼻病毒(RV)感染后易合并流感嗜血杆菌感染[34],而合并细菌感染是重症毛细支气管炎的一个危险因素。另一项纳入937名儿童的菌群分析的研究发现在生后1个月内气道细菌定植以金黄色葡萄球菌为主,此后逐渐变为肺炎链球菌、流感嗜血杆菌、卡他莫拉菌为主,并且这三种细菌与喘息的发生有密切联系[35]。本文纳入的2篇研究对鼻咽部抽吸物的菌群分析结果显示AZM能减少鼻咽部肺炎链球菌、嗜血杆菌属、卡他莫拉菌的检出。由此猜测,AZM可能降低毛细支气管炎患儿再次喘息及哮喘的发生风险。本文纳入的研究在远期随访过程中就不同的时间点采取不同的指标进行了评价,从整体来看,纳入文献显示短期AZM治疗对再入院及喘息再发作均无显著疗效,长疗程虽可以延长喘息发作的时间间隔,但对于最终哮喘的发生并无显著影响。这与目前的实验研究结果不一致,分析原因可能与本文纳入的文献数据不能进行喘息再发作或对有哮喘发生高危因素的特应质患儿(如有湿疹或有过敏性鼻炎、支气管哮喘家族史)行分层分析有关。另外纳入文献数量较少,且随访时间及结局指标不一致,无法进行结果合并。因此,需要规范的毛细支气管炎的随访标准,更多的临床大样本研究进一步证实AZM是否能改善毛细支气管炎患儿的远期预后。
本文纳入的14篇临床随机对照试验未统一AZM辅助治疗毛细支气管炎的剂量与疗程。从整体来看,药物剂量可大致分为大剂量(每日30 mg/kg)和小剂量(每日5~10 mg/kg),疗程差异也较大,从单剂到短疗程(3~7 d)到较长疗程(3周及以上)。由于缺少相应的病例对照研究,因此无法说明是否增加AZM的剂量或疗程有利于缩短急性期病程和减少远期反复喘息及哮喘的发生。并且,增加剂量和疗程是否会增加药物不良反应发生的风险同样需要进一步研究证明。
综上,本Meta分析结果显示,AZM辅助治疗毛细支气管炎并不能减少住院及用氧时间,仅能相对缩短症状(如喘息、咳嗽)的缓解时间,并且远期随访显示短期AZM治疗对再入院及喘息再发作均无显著疗效,长疗程虽可以延长喘息发作的时间间隔,但对于最终哮喘的发生并无显著影响。由于纳入文献较少、部分文献质量不高、数据内容限制,对于某些结局指标无法进行合并分析或亚组的分层分析,故本研究存在局限性,临床指导意义有限。因此,AZM用于辅助治疗毛细支气管炎气道炎症的有效性仍需更多大样本多中心高质量的临床随机对照研究进一步验证。
| [1] |
Paramore LC, Ciuryla V, Ciesla G, et al. Economic impact of respiratory syncytial virus-related illness in the US:an analysis of national databases[J]. Pharmacoeconomics, 2004, 22(5): 275-284. DOI:10.2165/00019053-200422050-00001 (  0) 0) |
| [2] |
Shi T, McAllister DA, O'Brien KL, et al. Global, regional, and national disease burden estimates of acute lower respiratory infections due to respiratory syncytial virus in young children in 2015:a systematic review and modelling study[J]. Lancet, 2017, 390(10098): 946-958. DOI:10.1016/S0140-6736(17)30938-8 (  0) 0) |
| [3] |
Caffrey Osvald E, Clarke JR. NICE clinical guideline:bronchiolitis in children[J]. Arch Dis Child Educ Pract Ed, 2016, 101(1): 46-48. DOI:10.1136/archdischild-2015-309156 (  0) 0) |
| [4] |
Parnham MJ, Erakovic Haber V, Giamarellos-Bourboulis EJ, et al. Azithromycin:mechanisms of action and their relevance for clinical applications[J]. Pharmacol Ther, 2014, 143(2): 225-245. DOI:10.1016/j.pharmthera.2014.03.003 (  0) 0) |
| [5] |
Hosakote YM, Jantzi PD, Esham DL, et al. Viral-mediated inhibition of antioxidant enzymes contributes to the pathogenesis of severe respiratory syncytial virus bronchiolitis[J]. Am J Respir Crit Care Med, 2011, 183(11): 1550-1560. DOI:10.1164/rccm.201010-1755OC (  0) 0) |
| [6] |
Bont L, Heijnen C, Kavelaars A, et al. Peripheral blood cytokine responses and disease severity in respiratory syncytial virus bronchiolitis[J]. Eur Respir J, 1999, 14(1): 144-149. DOI:10.1034/j.1399-3003.1999.14a24.x (  0) 0) |
| [7] |
Marguet C, Bocquel N, Benichou J, et al. Neutrophil but not eosinophil inflammation is related to the severity of a first acute epidemic bronchiolitis in young infants[J]. Pediatr Allergy Immunol, 2008, 19(2): 157-165. DOI:10.1111/j.1399-3038.2007.00600.x (  0) 0) |
| [8] |
Čulić O, Eraković V, Čepelak I, et al. Azithromycin modulates neutrophil function and circulating inflammatory mediators in healthy human subjects[J]. Eur J Pharmacol, 2002, 450(3): 277-289. (  0) 0) |
| [9] |
DeVincenzo JP, Wilkinson T, Vaishnaw A, et al. Viral load drives disease in humans experimentally infected with respiratory syncytial virus[J]. Am J Respir Crit Care Med, 2010, 182(10): 1305-1314. DOI:10.1164/rccm.201002-0221OC (  0) 0) |
| [10] |
DeVincenzo JP, El Saleeby CM, Bush AJ. Respiratory syncytial virus load predicts disease severity in previously healthy infants[J]. J Infect Dis, 2005, 191(11): 1861-1868. DOI:10.1086/430008 (  0) 0) |
| [11] |
Asada M, Yoshida M, Suzuki T, et al. Macrolide antibiotics inhibit respiratory syncytial virus infection in human airway epithelial cells[J]. Antiviral Res, 2009, 83(2): 191-200. DOI:10.1016/j.antiviral.2009.05.003 (  0) 0) |
| [12] |
Gielen V, Johnston SL, Edwards MR. Azithromycin induces anti-viral responses in bronchial epithelial cells[J]. Eur Respir J, 2010, 36(3): 646-654. DOI:10.1183/09031936.00095809 (  0) 0) |
| [13] |
Desaki M, Takizawa H, Ohtoshi T, et al. Erythromycin suppresses nuclear factor-κB and activator protein-1 activation in human bronchial epithelial cells[J]. Biochem Biophys Res Commun, 2000, 267(1): 124-128. DOI:10.1006/bbrc.1999.1917 (  0) 0) |
| [14] |
Anderson R. Erythromycin and roxithromycin potentiate human neutrophil locomotion in vitro by inhibition of leukoattractant-activated superoxide generation and autooxidation[J]. J Infect Dis, 1989, 159(5): 966-973. DOI:10.1093/infdis/159.5.966 (  0) 0) |
| [15] |
Tamaoki J, Nakata J, Tagaya E, et al. Effects of roxithromycin and erythromycin on interleukin 8-induced neutrophil recruitment and goblet cell secretion in guinea pig tracheas[J]. Antimicrob Agents Chemother, 1996, 40(7): 1726-1728. DOI:10.1128/AAC.40.7.1726 (  0) 0) |
| [16] |
Friedlander AL, Albert RK. Chronic macrolide therapy in inflammatory airways diseases[J]. Chest, 2010, 138(5): 1202-1212. DOI:10.1378/chest.10-0196 (  0) 0) |
| [17] |
Beigelman A, Mikols CL, Gunsten SP, et al. Azithromycin attenuates airway inflammation in a mouse model of viral bronchiolitis[J]. Respir Res, 2010, 11: 90. DOI:10.1186/1465-9921-11-90 (  0) 0) |
| [18] |
McCallum GB, Morris PS, Chatfield MD, et al. A single dose of azithromycin does not improve clinical outcomes of children hospitalised with bronchiolitis:a randomised, placebo-controlled trial[J]. PLoS One, 2013, 8(9): e74316. DOI:10.1371/journal.pone.0074316 (  0) 0) |
| [19] |
Pinto LA, Pitrez PM, Luisi F, et al. Azithromycin therapy in hospitalized infants with acute bronchiolitis is not associated with better clinical outcomes:a randomized, double-blinded, and placebo-controlled clinical trial[J]. J Pediatr, 2012, 161(6): 1104-1108. DOI:10.1016/j.jpeds.2012.05.053 (  0) 0) |
| [20] |
Beigelman A, Isaacson-Schmid M, Sajol G, et al. Randomized trial to evaluate azithromycin's effects on serum and upper airway IL-8 levels and recurrent wheezing in infants with respiratory syncytial virus bronchiolitis[J]. J Allergy Clin Immunol, 2015, 135(5): 1171-1178.e1. DOI:10.1016/j.jaci.2014.10.001 (  0) 0) |
| [21] |
McCallum GB, Morris PS, Grimwood K, et al. Three-weekly doses of azithromycin for indigenous infants hospitalized with bronchiolitis:a multicentre, randomized, placebo-controlled trial[J]. Front Pediatr, 2015, 3: 32. (  0) 0) |
| [22] |
Kneyber MC, van Woensel JB, Uijtendaal E, et al. Azithromycin does not improve disease course in hospitalized infants with respiratory syncytial virus (RSV) lower respiratory tract disease:a randomized equivalence trial[J]. Pediatr Pulmonol, 2008, 43(2): 142-149. DOI:10.1002/ppul.20748 (  0) 0) |
| [23] |
陈霞. 阿奇霉素对呼吸道合胞病毒感染的毛细支气管炎的治疗作用[J]. 山西医药杂志(下半月刊), 2009, 38(14): 608-609. (  0) 0) |
| [24] |
李晓娅. 阿奇霉素在毛细支气管炎中的应用[J]. 中外医学研究, 2010, 8(20): 184. DOI:10.3969/j.issn.1674-6805.2010.20.158 (  0) 0) |
| [25] |
林士霞, 潘伟, 华亚军, 等. 阿奇霉素治疗呼吸道合胞病毒毛细支气管炎患儿的疗效观察[J]. 山西医药杂志(下半月刊), 2013, 42(14): 784-786. (  0) 0) |
| [26] |
张静. 布地奈德联合小剂量阿奇霉素对毛支后小气道病变患儿潮气呼吸肺功能的影响[J]. 药学研究, 2014, 33(12): 727-729. (  0) 0) |
| [27] |
徐莉莉. 毛细支气管炎通过阿奇霉素注射治疗的效果分析[J]. 养生保健指南, 2016(51): 199. (  0) 0) |
| [28] |
王霜. 探讨炎琥宁联合阿奇霉素治疗婴幼儿毛细支气管炎的临床研究[J]. 中国保健营养(上旬刊), 2013(12): 6857. (  0) 0) |
| [29] |
王焱. 小剂量阿奇霉素治疗呼吸道合胞病毒毛细支气管炎疗效观察[J]. 包头医学院学报, 2012, 28(4): 43-45. DOI:10.3969/j.issn.1006-740X.2012.04.023 (  0) 0) |
| [30] |
廖从珍. 炎琥宁联合阿奇霉素治疗毛细支气管炎68例疗效观察[J]. 中外医学研究, 2010, 8(15): 61. DOI:10.3969/j.issn.1674-6805.2010.15.037 (  0) 0) |
| [31] |
郑贵云. 注射用阿奇霉素在毛细支气管炎临床疗效观察[J]. 大家健康(下旬版), 2015, 9(4): 125. DOI:10.3969/j.issn.1009-6019.2015.04.141 (  0) 0) |
| [32] |
孙锟, 沈颖. 小儿内科学[M]. 第5版. 北京: 人民卫生出版社, 2014: 235-236.
(  0) 0) |
| [33] |
Mallia P, Johnston SL. Respiratory viruses:do they protect from or induce asthma?[J]. Allergy, 2002, 57(12): 1118-1129. DOI:10.1034/j.1398-9995.2002.02169.x (  0) 0) |
| [34] |
Mansbach JM, Hasegawa K, Henke DM, et al. Respiratory syncytial virus and rhinovirus severe bronchiolitis are associated with distinct nasopharyngeal microbiota[J]. J Allergy Clin Immunol, 2016, 137(6): 1909-1913.e4. DOI:10.1016/j.jaci.2016.01.036 (  0) 0) |
| [35] |
Bisgaard H, Hermansen MN, Bønnelykke K, et al. Association of bacteria and viruses with wheezy episodes in young children:prospective birth cohort study[J]. BMJ, 2010, 4(341): c4978. (  0) 0) |
 2019, Vol. 21
2019, Vol. 21


