患儿女,12岁,因反复皮肤红斑、水疱半年,关节疼痛3月余就诊。患儿半年前反复出现口腔溃疡、糜烂,伴低热,逐渐出现口周及面部红斑、水疱,就诊当地医院,予对症治疗,病情无好转。5个月前红斑及水疱逐渐扩散至全身,外院查血常规示WBC 3.38×109/L,抗双链DNA(dsDNA)阳性,皮肤病理检查示表皮下水疱形成,大量中性粒细胞浸润,直接免疫荧光(DIF)示基底膜区(BMZ)IgG、IgM、IgA和C3线状沉积。先后予以激素、吗替麦考酚酯(MMF)及柳氮磺胺吡啶治疗,病情逐渐缓解。3月余前患儿皮疹消退,遂自行停药,停药后数天颜面部出现对称性红斑、水疱,同时出现四肢对称性关节疼痛,以膝、踝、腕及肘等大关节为主,伴晨僵及间断低热,无光敏现象。1个月前关节疼痛加重,并出现双手指关节疼痛及脱发,随后出现面部水肿。既往史、个人史及家族史无特殊。入院体查:T 37.1℃,BP 98/66 mm Hg,体重30 kg,轻度库欣氏面容,口腔内见多处溃疡,颜面部对称性红斑,面中部、前胸、躯干、双侧大腿、手臂及双手可见大量大小不等红斑及水疱,疱壁紧张、疱液清亮,基底红,尼氏征阴性,面部、躯干、双侧大腿、腘窝、双足底可见弥漫性水肿性红斑,边界欠清,部分呈环形、多环形,部分融合成片(图 1),左侧大阴唇可见一约0.5 cm×0.5 cm大小的红色浅糜烂面,肛周可见少许色素沉着。心肺腹听诊无异常,双下肢“4”字征阳性。实验室检查:血常规示WBC 3.8×109/L(参考值:5.0~12.0×109/L),Hb 99 g/L(参考值:110~150 g/L),N 66.9%(参考值:40.0%~75.0%);尿常规示潜血(3+),蛋白(+),白细胞15.18个/μL(参考值:0~5个/μL),红细胞524.70个/μL(参考值:0~6个/μL);肝功能示丙氨酸氨基转移酶67.7 U/L(参考值:7.0~40.0 U/L),门冬氨酸氨基转移酶109.3 U/L(参考值:13.0~35.0 U/L);血脂示甘油三脂2.36 mmol/L(参考值:< 1.70 mmol/L),胆固醇6.74 mmol/L(参考值:< 5.18 mmol/L);血沉73 mm/h(参考值:0~26.0 mm/h);抗核抗体1 : 320(均质型),dsDNA阳性;抗核抗体谱示抗核小体、抗组蛋白及抗干燥综合征抗原A抗体均阳性;免疫全套示补体C3 151.0 mg/L(参考值:790.0~1520.0 mg/L),补体C4 50.8 mg/L(参考值:100.0~400.0 mg/L);抗人球蛋白试验示多抗(IgG+C3)(2+),抗IgG(2+);类风湿因子175 IU/mL(参考值:0~30.0 IU/mL);淋巴细胞亚群检测示CD19 4.15%(参考值:6%~25%),CD8 45.04%(参考值:13%~41%),CD16+56 1.06%(参考值:5%~27%);炎症因子四项示肿瘤坏死因子-α 21.6 pg/mL(参考值:< 8.1 pg/mL);24 h尿蛋白定量1.29 g(参考值:< 0.15 g/24 h),尿蛋白/肌酐2.39(参考值:< 0.15 g/g)。肾穿刺活检苏木精-伊红(HE)染色示肾小球系膜基质中度增生,伴内皮细胞增生,毛细血管管腔变窄,可见苏木小体,肾球囊变窄;过碘酸六胺银染色示系膜区增宽,基底膜空泡变性;荧光染色见系膜及毛细血管区IgG、IgM、IgA及C3、C1q沉积,符合狼疮性肾炎(弥漫性节段性增生性),即IV-S(A)型(图 2)。多关节彩超示双踝关节少量积液。皮肤病理检查示表皮下水疱,疱内及真皮乳头大量炎性细胞浸润,以中性粒细胞浸润为主,皮肤DIF示BMZ有IgG、IgM、IgA带状沉积(图 3)。临床诊断:大疱性系统性红斑狼疮(bullous systemic lupus erythematosus, BSLE);狼疮性肾炎。
|
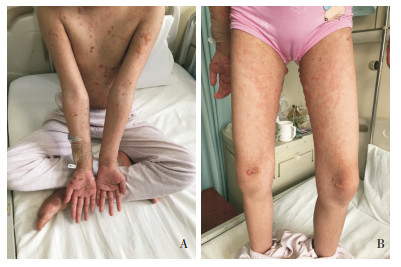
图 1 患儿皮损图 图A、B示患儿前胸、四肢及躯干可见大量大小不等水疱或血疱,疱壁紧张、疱液清亮,基底红;躯干、双侧大腿可见弥漫性水肿性红斑,边界欠清,部分呈环形、多环形,部分融合成片。 |

|
图 2 肾脏病检结果(×400) 图A(HE染色)示肾小球系膜基质中度增生,伴内皮细胞增生毛细血管管腔变窄,可见苏木小体(蓝色箭头),肾球囊变窄;图B(过碘酸六胺银染色)示系膜区增宽(蓝色箭头),基底膜空泡变性(绿色箭头)。 |
|
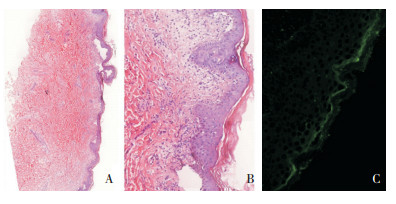
图 3 皮肤病理检查结果 图A(HE染色, ×20)、B(HE染色, ×200)示表皮下水疱、疱内及真皮乳头见大量炎性细胞浸润, 以中性粒细胞浸润为主; 图C(皮肤直接免疫荧光, ×200)示基底膜区免疫复合物IgG、IgM、IgA带状沉积。 |
予以甲泼尼龙(48 mg,1次/日)、羟氯喹(0.2 g,1次/日)及MMF(0.625 g,2次/日)治疗后,症状好转出院。20 d后出现频繁呕吐,自行将甲泼尼龙减半(24 mg,1次/日),再次出现口腔溃疡、大量新发红斑及水疱,数日后逐渐蔓延至全身,收住院。住院后继续口服羟氯喹及MMF,予氢化泼尼松[30 mg/d(相当于泼尼松60 mg)]治疗,红斑及疱疹仍反复,遂加用利妥昔单抗(0.4 g,静滴)治疗,好转出院后继续口服泼尼松(60 mg,1次/日)、羟氯喹及MMF治疗。出院后半月因反复广泛红斑及疱疹再次就诊,留观后予甲基强的松龙(500 mg,静滴,连续3 d)及环磷酰胺(0.8 g,静滴)冲击治疗(由于经济原因家长拒绝继续利妥昔单抗治疗),后继续予以甲泼尼龙(24 mg,1次/日)、羟氯喹及MMF同前治疗,加用沙利度胺(50 mg,2次/日)治疗,激素逐渐减量(每月减量4 mg),水疱及红斑逐渐消退。冲击治疗后20余天全身疱疹基本消退,无发热,关节痛缓解。皮疹消退1个月后患儿因咳嗽6 d再次住院,复查血常规、肝肾功能心肌酶均正常,尿常规示潜血(2+),蛋白(-),胸片示双肺弥漫性渗出性病变,诊断肺炎。期间停用MMF,甲泼尼龙减量(16 mg,1次/日),余治疗同前,予抗感染治疗后好转出院,出院后继续口服上述药物治疗,甲泼尼龙继续减量,出院8个月后停用MMF、羟氯喹及沙利度胺,改用他克莫司(1.0 mg,2次/日)。至今随访10个月,患儿维持甲泼尼龙(4 mg,1次/日)及他克莫司治疗,皮疹及水疱未复发。
讨论:BSLE是一种具有鲜明临床特征的表皮下大疱性疾病,是SLE的一种罕见亚型,好发于青年女性,儿童期和青春期相当少见[1]。约76%的SLE患者病程中出现皮肤病变,仅1%左右的患者表现为BSLE。临床上,BSLE除具有SLE特点外,主要表现为急性、广泛及充满液体的疱疹和大疱。BSLE往往提示SLE活动、病情严重或患有并发症的风险,尤其是狼疮性肾炎[2]。儿童BSLE病情重,多系统同时受累如肾脏、造血系统、免疫系统及肝脏等,国内鲜见报道(共4例),本文报道1例活动期SLE并发BSLE的青春期女性儿童,除了临床、实验诊断依据、皮肤病理检查,还进行了肾穿刺活检,对明确诊断、狼疮性肾炎的分期及患儿治疗方案的制定提供了可靠依据。Camisa和Sharma于1983年首次提出了BSLE的诊断标准[3],并于1988年进行了修订[4]。该患儿为青春期女性,根据症状、体征及实验室检查达到SLE的诊断标准:(1)该患儿有慢性皮肤红斑狼疮表现、反复口腔溃疡、脱发、关节炎、晨僵、24 h尿蛋白1.29 g、尿蛋白/肌酐2.39及WBC降低、贫血;(2)免疫学检查示抗核抗体阳性、抗dsDNA抗体阳性、补体降低及抗人球蛋白试验阳性;(3)肾活检为狼疮性肾炎。SLE疾病活动指数评分为18分,属于重度活动。进一步皮肤活检符合BSLE的病理改变,因而诊断为BSLE、狼疮性肾炎。该病临床上需要与以下疾病鉴别:(1)线状IgA大疱性皮肤病;(2)大疱类天疱疮;(3)获得性大疱性表皮松解症。根据本病的SLE系统表现、免疫学检查及典型的病理改变可明确诊断。
BSLE临床表现异质性强,与受损害的系统相关[5]。日晒、感染、激素减量为其常见诱因,常呈急性发作,表现为全身播散性大疱性皮疹,可局限于日晒部位,也可累及身体其他部位。躯干、上肢、颈部、面部和红色边缘部位为好发部位,常先累及躯干和锁骨上区域,也可累及黏膜,特别是口咽部。BSLE的典型皮损表现为孤立、大而紧张的大疱性天疱疮样皮疹,疱液清亮或血性,亦可表现为小而群集分布,如疱疹样或皮炎样皮疹,常伴有黄斑或荨麻疹。可发生于红斑上或正常皮肤,大多伴有明显瘙痒,大水疱消退后一般无色素沉着,大疱性皮疹可为BSLE的首发症状。该患儿以口腔溃疡起病,后逐渐出现面部红斑、全身水疱、疱疹,随病情进展出现关节疼痛、晨僵及脱发,且并发狼疮性肾炎,同时皮肤病理检查符合典型的BSLE特征,因而BSLE诊断明确。
及时、正确的诊断对BSLE的治疗及预后非常重要,BSLE的治疗方案应根据系统损害程度来确定,传统的SLE治疗方案并不适用。抗疟药氨苯砜是治疗BSLE最有效的药物,对未出现皮肤病变的患者疗效更佳[6],能有效控制皮疹的出现,但对改善脑出血及全身症状无效。激素对BSLE常常无效,甚至使皮疹加重,但当其他药物无效或不适用时,可作为BSLE的替代治疗。氨苯砜治疗无效或伴发全身症状、SLE疾病活动指数高者,可用糖皮质激素和/或免疫抑制剂治疗,甲氨蝶呤有望成为氨苯砜的理想替代药,尤其对抗疟药和激素治疗无效的BSLE,仅用甲氨蝶呤就能完全缓解其皮肤病变。羟氯喹、硫唑嘌呤、环磷酰胺及MMF联合激素可用于BSLE的治疗。利妥昔单抗已用于SLE治疗,对于难治性皮肤病变,氨苯砜、糖皮质激素和免疫抑制剂治疗无效的BSLE患者,利妥昔单抗治疗有效[7]。由于国内购买氨苯砜困难,该患儿予以糖皮质激素联合MMF、羟氯喹治疗病情一度好转,自行停药后皮疹反复,加用利妥昔单抗并针对其并发症狼疮性肾炎予甲泼尼龙及环磷酰胺冲击治疗后,病情明显好转,激素成功减量,皮疹及水疱一直未复发。
BSLE的诊断具有挑战性,任何突发的大疱性疾病都应考虑此病,尤其患有或曾经患有SLE的患者,应积极行自身抗体及免疫球蛋白、补体等相关检查。该病目前病因尚未完全明确,以皮肤真皮层中性粒细胞浸润为主,BMZ有IgG、IgM、IgA和C3线状沉积为典型病理特点,疑似本病者应行病理检查以明确。由于BSLE与SLE病情严重程度与疾病活动度相关,需客观评价其系统损害来确定其治疗方案,目前认为氨苯砜、糖皮质激素联合免疫抑制剂是常用的有效治疗方案。
| [1] |
de Risi-Pugliese T, Cohen Aubart F, Haroche J, et al. Clinical, histological, immunological presentations and outcomes of bullous systemic lupus erythematosus:10 new cases and a literature review of 118 cases[J]. Semin Arthritis Rheum, 2018, 48(1): 83-89. DOI:10.1016/j.semarthrit.2017.11.003 (  0) 0) |
| [2] |
Momen T, Madihi Y. Bullous systemic lupus erythematosus and lupus nephritis in a young girl[J]. Oman Med J, 2016, 31(6): 453-455. DOI:10.5001/omj.2016.91 (  0) 0) |
| [3] |
Camisa C, Sharma HM. Vesiculobullous systemic lupus erythematosus. Report of two cases and a review of the literature[J]. J Am Acad Dermatol, 1983, 9(6): 924-933. DOI:10.1016/S0190-9622(83)70210-0 (  0) 0) |
| [4] |
Camisa C. Vesiculobullous systemic lupus erythematosus. A report of four cases[J]. J Am Acad Dermatol, 1988, 18(1 Pt 1): 93-100. (  0) 0) |
| [5] |
Contestable JJ, Edhegard KD, Meyerle JH. Bullous systemic lupus erythematosus:a review and update to diagnosis and treatment[J]. Am J Clin Dermatol, 2014, 15(6): 517-524. DOI:10.1007/s40257-014-0098-0 (  0) 0) |
| [6] |
Maggio MC, Corsello G, Prinzi E, et al. Systemic lupus erythematosus and bullous pemphigoid with dramatic response to dapsone[J]. Am J Case Rep, 2017, 18: 317-319. DOI:10.12659/AJCR.902351 (  0) 0) |
| [7] |
Anyanwu CO, Ang CC, Werth VP. Oral mucosal involvement in bullous lupus[J]. Arthritis Rheum, 2013, 65(10): 2622. (  0) 0) |
 2019, Vol. 21
2019, Vol. 21

