婴儿神经轴索营养不良(infantile neuroaxonal dystrophy, INAD, OMIM 256600)又称婴儿型PLA2G6相关神经变性,是一种罕见的常染色体隐性遗传的神经变性疾病[1]。典型的患儿2岁以内起病,中枢及周围神经系统的神经轴索均可累及,临床表现为精神运动发育落后/倒退、四肢及躯干肌张力低下、部分患儿伴有视神经萎缩等症状,且病情进展迅速[2-3]。研究发现,编码非Ca2+依赖型磷脂酶A2-VIA的PLA2G6基因为INAD唯一致病基因[4]。目前世界范围内INAD报道的病例不多,尚无发病率数据。本文分析我院诊治的2例INAD患儿,结合临床特征并利用分子诊断、突变功能验证以及免疫组化的方法进行确诊,并探讨该病的临床表现及遗传学特点,以提高临床医师对该病的认识。
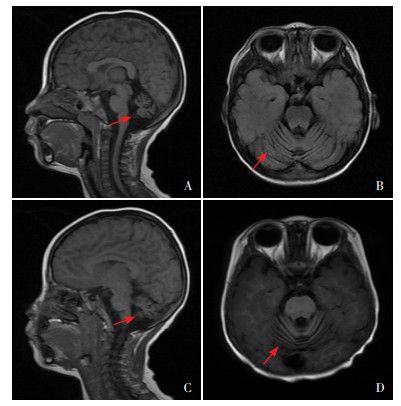
1 资料与方法 1.1 研究对象患儿1,男,3岁,因精神运动发育落后1年就诊。2岁开始出现四肢无力、走路及上楼梯困难,并呈现进行性加重的状态,逐渐失去行走能力;2岁时语言仅会两个字的称呼,至今无进展;叫之反应差,吞咽功能倒退。患儿系第2胎第2产,足月顺产,出生史无异常,3月龄可抬头,8月龄可独坐,2岁开始说话,但进展缓慢,至今仅会说2~3个字的词语。患儿平素身体一般,否认传染病史、外伤史。父母体健,非近亲结婚。有一姐姐,体健;无相关疾病家族史。入院体查:面容正常,体型瘦小,头围49 cm,身高87 cm(-2 SD),体重11.5 kg(-2 SD),学习及辩物能力差,听指令和模仿能力差,不易逗笑,追光追物迟缓,主动抓握慢,精细度和灵活度欠佳;可扶墙缓慢移动,不能独立行走;咽反射正常。双肺呼吸音稍粗,未闻及干湿性啰音;心腹检查未见异常。四肢肌力Ⅲ级,四肢肌张力低下,膝腱反射可引出,双侧巴氏征阳性。辅助检查:肝功能示门冬氨酸氨基转移酶(AST)61 U/L(参考值:10~40 U/L);心肌酶示肌酸激酶同工酶(CK-MB)27.3 U/L(参考值:0~25 U/L),乳酸脱氢酶(LDH)321 U/L(参考值:15~65 U/L);血遗传代谢病氨基酸和酰基肉碱谱分析及尿有机酸分析无异常。双下肢肌电图示神经源性损害。头颅MRI示小脑体积较小,脑沟增宽(图 1A~B)。脑电图未见异常。
|
图 1 患儿头部MRI结果 图A~B为患儿1矢状位和轴位T1相结果,提示小脑脑沟增宽,体积略小;图C~D为患儿2矢状位和轴位T1相结果,提示小脑萎缩。图中红色箭头示异常部位。 |
患儿2,男,4岁2个月,因精神运动、语言发育落后2年,倒退1年就诊。患儿3岁时可说简单句子,可独坐、扶走,可清楚辨物;近1年发育呈倒退趋势,目前语言仅会“爸爸”、“妈妈”等简单称呼,不能独坐,不能独走,不能辨物且咀嚼能力变差。患儿系第1胎第1产,出生史无异常,3月龄翻身,6月龄可独坐,1岁半会说话,2岁半扶走。父母非近亲结婚,无相关疾病家族史。患儿平素身体一般,否认传染病史、外伤史。入院体查:面容正常,体型瘦小,头围50 cm,身高95 cm(-2 SD),体重13.5 kg(-2 SD),精神一般,仅会2个字的叠音,抬头稍困难,不能独坐、不能独走,精细动作欠佳;咽反射减弱。心肺腹检查无异常。双上肢肌力Ⅲ级,双下肢肌力Ⅱ级,四肢肌张力低下,四肢肌肉轻度肌萎缩。膝腱反射对称引出,病理征未引出。辅助检查:肝功能示AST 84 U/L;心肌酶示CK-MB 31 U/L,LDH 412 U/L。血氨、乳酸、血遗传代谢病氨基酸和酰基肉碱谱分析及尿有机酸分析无异常。双下肢肌电图示神经源性损害。脑电图示背景活动偏慢,睡眠期可见少量低中波幅的棘波尖波发放。颅脑MRI示小脑萎缩可能(图 1C~D)。心电图无异常。
1.2 致病基因检测抽取患儿及父母外周静脉血各2 mL,利用全血基因组DNA提取试剂盒提取基因组DNA,并测定浓度,委托北京康旭医学检验所进行全外显子组测序,并进行Sanger测序验证;致病基因PLA2G6的引物由上海生工合成。
本研究得到咸宁市中心医院医学伦理学委员会审核批准(LL20180524009)及患儿家属的知情同意。
1.3 生物信息学分析对检测到的基因变异进行单核苷酸多态性数据库(dbSNP, http://www.ncbi.nlm.nih.gov/SNP)、千人基因组(http://www.internationalgenome.org)、人类基因突变数据库(HGMD, http://www.hgmd.cf.ac.uk)及文献分析,未见报道的新变异按照美国医学遗传学与基因组学学会(American College of Medical Genetics and Genomics, ACMG)发布的序列变异解读标准和指南[5]评估变异的致病性。
1.4 剪接位点功能验证取患儿及父母外周血1 mL,分离白细胞并提取RNA,体外反转录为cDNA,针对剪接位点区域前后设计引物,利用PCR方法扩增相应的片段,并进行Sanger测序。
1.5 肌肉组织免疫组化检测患儿2家长签署知情同意书后,采取患儿2腓肠肌肌肉活检,新鲜肌肉组织放入10%中性福尔马林固定,脱水浸蜡包埋,切片后进行免疫组织化学染色,比较肌肉组织中PLA2G6蛋白的表达水平,实验按照免疫组化试剂盒(北京中杉金桥生物技术有限公司)说明书进行,PLA2G6抗体购自Proteintech(货号22030-1-AP,稀释比例1 : 50)。
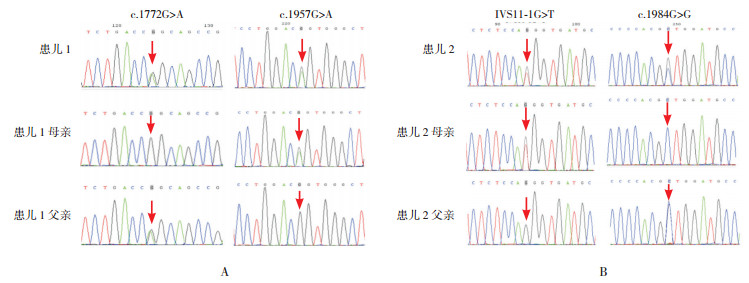
2 结果 2.1 遗传学检测结果及致病性分析全外显子组测序及Sanger测序验证发现患儿1的PLA2G6基因存在复合杂合变异,分别为c.1772G > A及c.1957G > A变异,分别使PLA2G6基因编码的蛋白第591位氨基酸由精氨酸变为谷氨酰胺(p.R591Q),第653位氨基酸由甘氨酸变为丝氨酸(p.G653S);2个变异均为已知致病突变,分别遗传自父母。患儿2的PLA2G6基因检测到2个变异为IVS11-1G > T和c.1984C > G变异,分别遗传自父母。其中IVS11-1G > T变异为剪接位点变异,位于经典的剪接位点区域,推测影响mRNA成熟加工,进一步影响蛋白的功能;依据ACMG指南,该变异为可能致病性变异(PVS1:功能丧失变异可能导致基因功能丧失;PM1:数据库未收录,属于低频变异)。c.1984C > G变异导致PLA2G6基因编码的蛋白第662位氨基酸由亮氨酸变为缬氨酸(p.L662V),该变异在HGMD、dbSNP数据库、千人基因组数据库中均未见收录,文献亦未见报道。依据ACMG指南,该变异为可能致病性变异(PM1:错义变异位于无良性变异的外显子功能域;PM2:低频变异,数据库未收录;PM:多种软件及保守性分析得出变异对基因功能有影响)。见图 2~3。
|
图 2 两例患儿及其父母PLA2G6基因Sanger测序图 图A示患儿1所携带的c.1772G>A及c.1957G>A复合杂合变异分别遗传自父母;图B示患儿2携带的IVS11-1G>T及c.1984C>G变异分别遗传自父母。变异位点如箭头所示。 |

|
图 3 PLA2G6基因c.1984C > G变异在不同物种间保守性分析 图中红色框内表示不同物种间该区域均是亮氨酸。 |
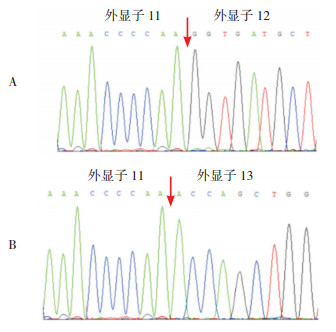
利用PLA2G6基因特异性引物分析剪接位点变异对RNA加工成熟的影响,结果显示与正常对照相比,患儿2的RNA出现2种转录本,对2种转录本进行切胶回收,测序分析发现其中一个转录本为野生型,另外一个转录本缺失外显子12,结果表明IVS11-1G > T影响PLA2G6基因mRNA的加工,见图 4。
|
图 4 IVS11-1G > T剪接位点功能验证 图A示正常剪接异构体;图B示异常剪接异构体(外显子12缺失)。 |
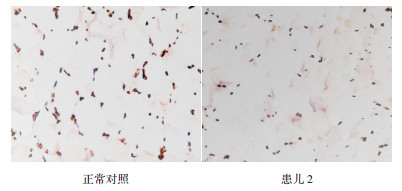
患儿2携带两个未见报道的变异,为证明该变异是否影响蛋白的表达量,取患儿腓肠肌进行PLA2G6蛋白的免疫组化分析。与正常对照相比,患儿2组织中PLA2G6蛋白的表达量降低。见图 5。
|
图 5 正常对照和患儿2腓肠肌PLA2G6蛋白免疫组化结果(400×) 棕色为目标蛋白染色,提示患儿2组织中PLA2G6蛋白的表达量降低。 |
2例患儿明确诊断后,给予维生素B1、甲钴胺营养神经等对症支持治疗,并进行针对性的康复训练,效果不佳,患儿语言、运动均未见改善。目前2例患儿均不能行走,语言能力几乎丧失,预后差。
3 讨论INAD是一种罕见的常染色体隐性遗传病,由Seiteberger于1952年首次报道[6]。其典型的临床表现为6个月~2岁起病,进行性运动、智力倒退,躯干肌张力低下发展至痉挛型四肢瘫;部分患儿伴有视神经萎缩,部分可能有癫痫发作;一般在10岁之前死亡[4, 7]。由于许多临床医生对INAD认识不足,多数患儿在就诊时被误诊为脑瘫、脊髓性肌萎缩或其他神经肌肉病等。目前世界范围内共报道了200多例INAD[8]。INAD的诊断标准包括以下几个方面:(1)临床起病早,通常3岁以内;精神运动发育倒退,肌张力低下;视神经萎缩或视力异常;(2)实验室检查可见AST、ALT水平升高,CK、CK-MB、LDH水平升高;(3)影像学检查可见小脑发育不良或小脑萎缩;(4)肌电图可见神经源性损害;部分患儿脑电图可见快节律波发放等异常[9]。
PLA2G6基因定位于22q13.1,长度约为6 Mb,由17个外显子组成,编码胞浆内非Ca2+依赖的磷脂酶A2-VIA。PLA2G6基因在机体早期的神经系统发育过程中具有非常重要作用,在胚胎组织的神经细胞和非神经细胞中广泛表达[10],该基因功能异常可导致神经细胞膜磷脂代谢紊乱、脂质过氧化反应、高尔基体形态改变、细胞内铁沉积等异常,最终可导致细胞凋亡和机体神经退行性病变[11]。目前研究发现PLA2G6基因异常除导致INAD外,还可以引起不典型神经轴索营养不良以及肌张力障碍-帕金森综合征等疾病[1, 12]。
本文的2例患儿均在2岁内发病,发育落后且呈语言、运动倒退的趋势;肌张力低下;AST、CK-MB、LDH等水平升高;头颅MRI示小脑发育不良或小脑萎缩;血遗传代谢病氨基酸和酰基肉碱谱分析及尿有机酸分析无异常。患儿初步怀疑神经肌肉病,为进一步明确诊断,完善遗传学检测,发现2例患儿PLA2G6基因均存在复合杂合变异,生物信息学分析及功能实验证实变异为可能致病/致病性突变。结合患儿的临床表型及遗传学分析结果,2例患儿最终确诊为INAD。
张平平等[14]曾对26例INAD患儿进行随访,发现患儿平均发病年龄为1岁3个月,临床表现为进行性智力、运动发育倒退;约80%患儿存在小脑萎缩,50%存在眼球震颤或斜视;约95%以上患儿肌电图示神经源性损害,且大多数患儿脑电图异常。本研究中的2例患儿临床表现符合文献报道。26例患儿中,23例患儿存在PLA2G6基因变异,且发现外显子2可能是变异热点[14]。本研究中的4个变异位点均不在外显子2附近,变异热点需要更多的病例进一步分析,国内外文献暂未见基因型和表型的相关性研究。
目前INAD无有效治疗手段,以对症康复治疗为主。INAD患儿的预后一般比较差,多数10岁以内死亡。国外研究随访发现INAD患儿的平均死亡年龄为9.4岁[15],国内暂无相关数据。INAD病情进展较快,我们应加强随访,密切关注2例患儿病情变化。
综上所述,INAD患儿临床表现为精神运动发育落后、倒退,四肢及躯干肌张力低下、小脑萎缩、部分患儿伴有视力异常等症状,且病情进展迅速;全外显子组测序可以尽早的帮助临床诊断。通过本研究可提高临床医生对该疾病的认识,提高疾病的诊断率,尽早明确诊断并进行对症治疗及遗传咨询。
| [1] |
Iodice A, Spagnoli C, Salerno GG, et al. Infantile neuroaxonal dystrophy and PLA2G6-associated neurodegeneration:an update for the diagnosis[J]. Brain Dev, 2017, 39(2): 93-100. DOI:10.1016/j.braindev.2016.08.012 (  0) 0) |
| [2] |
Elsayed LEO, Mohammed IN, Hamed AAA, et al. Case report of a novel homozygous splice site mutation in PLA2G6 gene causing infantile neuroaxonal dystrophy in a Sudanese family[J]. BMC Med Genet, 2018, 19(1): 72. DOI:10.1186/s12881-018-0592-y (  0) 0) |
| [3] |
Mascalchi M, Mari F, Berti B, et al. Fast progression of cerebellar atrophy in PLA2G6-associated infantile neuronal axonal dystrophy[J]. Cerebellum, 2017, 16(3): 742-745. DOI:10.1007/s12311-017-0843-z (  0) 0) |
| [4] |
Morgan NV, Westaway SK, Morton JE, et al. PLA2G6, encoding a phospholipase A2, is mutated in neurodegenerative disorders with high brain iron[J]. Nat Genet, 2006, 38(7): 752-754. DOI:10.1038/ng1826 (  0) 0) |
| [5] |
Richards S, Aziz N, Bale S, et al. Standards and guidelines for the interpretation of sequence variants:a joint consensus recommendation of the American College of Medical Genetics and Genomics and the Association for Molecular Pathology[J]. Genet Med, 2015, 17(5): 405-424. DOI:10.1038/gim.2015.30 (  0) 0) |
| [6] |
Crome L, Weller SD. Infantile neuroaxonal dystrophy[J]. Arch Dis Child, 1965, 40(213): 502-507. DOI:10.1136/adc.40.213.502 (  0) 0) |
| [7] |
Ozes B, Karagoz N, Schüle R, et al. PLA2G6 mutations associated with a continuous clinical spectrum from neuroaxonal dystrophy to hereditary spastic paraplegia[J]. Clin Genet, 2017, 92(5): 534-539. DOI:10.1111/cge.13008 (  0) 0) |
| [8] |
马秀伟, 朱丽娜, 辜蕊洁, 等. 婴儿神经轴索营养不良1例临床和PLA2G6基因变异分析[J]. 临床儿科杂志, 2018, 36(4): 252-255. DOI:10.3969/j.issn.1000-3606.2018.04.004 (  0) 0) |
| [9] |
Nardocci N, Zorzi G, Farina L, et al. Infantile neuroaxonal dystrophy:clinical spectrum and diagnostic criteria[J]. Neurology, 1999, 52(7): 1472-1478. DOI:10.1212/WNL.52.7.1472 (  0) 0) |
| [10] |
Polster B, Crosier M, Lindsay S, et al. Expression of PLA2G6 in human fetal development:implications for infantile neuroaxonal dystrophy[J]. Brain Res Bull, 2010, 83(6): 374-379. DOI:10.1016/j.brainresbull.2010.08.011 (  0) 0) |
| [11] |
Ramanadham S, Ali T, Ashley JW, et al. Calcium-independent phospholipases A2 and their roles in biological processes and diseases[J]. J Lipid Res, 2015, 56(9): 1643-1668. DOI:10.1194/jlr.R058701 (  0) 0) |
| [12] |
Kapoor S, Shah MH, Singh N, et al. Genetic analysis of PLA2G6 in 22 Indian families with infantile neuroaxonal dystrophy, atypical late-onset neuroaxonal dystrophy and dystonia parkinsonism complex[J]. PLoS One, 2016, 11(5): e0155605. DOI:10.1371/journal.pone.0155605 (  0) 0) |
| [13] |
Zhang P, Gao Z, Jiang Y, et al. Follow-up study of 25 Chinese children with PLA2G6-associated neurodegeneration[J]. Eur J Neurol, 2013, 20(2): 322-330. DOI:10.1111/j.1468-1331.2012.03856.x (  0) 0) |
| [14] |
张平平, 高志杰, 王静敏, 等. 中国婴儿神经轴索营养不良患儿临床随访及分子遗传学研究[J]. 实用儿科临床杂志, 2012, 27(9): 692-696. (  0) 0) |
| [15] |
Gregory A, Westaway SK, Holm IE, et al. Neurodegeneration associated with genetic defects in phospholipase A2[J]. Neurology, 2008, 71(18): 1402-1409. DOI:10.1212/01.wnl.0000327094.67726.28 (  0) 0) |
 2019, Vol. 21
2019, Vol. 21


