儿童肺炎支原体肺炎(Mycoplasma pneumoniae pneumonia, MPP)以发热、刺激性咳嗽为主要症状,病情易迁延加重[1]。这与目前相关病原学诊断技术滞后、耐药性产生、感染类型复杂等因素有关[2-3]。与难治性肺炎支原体肺炎(refractory Mycoplasma pneumoniae pneumonia, RMPP)相比,重症肺炎支原体肺炎(severe Mycoplasma pneumoniae pneumonia, SMPP)的概念与其虽有重叠,但更强调实际临床症状的严重性[4]。患儿一旦罹患SMPP,往往要联合抗生素、全身激素、丙种球蛋白等多种治疗,混合感染时还要联合抗菌药、抗病毒药甚至抗真菌药等,治疗难度大,病死率高。因此,及早识别SMPP、评估病情程度,对提高患儿治愈率有重要意义。有研究表明,RMPP患儿与普通型MPP患儿肺泡灌洗液中白细胞介素(IL)-6、IL-10、γ-干扰素等细胞因子水平存在明显差异[5]。痰液肺炎支原体DNA(MP-DNA)复制倍数可准确反映病原载量[6],而痰液肺炎支原体病原载量与儿童MPP严重程度亦呈正相关[7-8]。本研究以44例需肺泡灌洗的SMPP患儿为研究对象,旨在探讨咽拭子及肺泡灌洗液中MP-DNA复制水平与SMPP患儿病情严重程度的相关性,以期为SMPP患儿病情评估提供更多依据。
1 资料与方法 1.1 研究对象以2016年1月至2017年12月洛阳市妇女儿童医疗保健中心收治的SMPP患儿为研究对象。纳入标准:(1)符合“儿童肺炎支原体肺炎诊治专家共识(2015年版)”中关于SMPP的诊断标准[9];(2)符合支气管镜术及肺泡灌洗治疗指征[10];(3)患儿家长知情同意。排除标准:(1)合并免疫功能障碍或缺陷;(2)合并先天性或慢性基础疾患;(3)合并重要脏器的功能障碍、血液系统疾病等。根据纳入和排除标准,共44例患儿纳入研究。其中男29例,女15例,平均年龄6.1±1.8岁(范围:2.6~9.4岁)。
1.2 材料与仪器无水乙醇、DEPC水、异丙醇购于北京鼎国昌盛生物技术有限责任公司,支原体DNA扩增试剂盒、流式荧光试剂Kit购于武汉博士德生物工程有限公司,流式细胞仪、离心机购于Hettich公司(德国),实时荧光定量PCR仪购于美国BD公司,电子荧光支气管镜BF-XP260F购于奥林巴斯。
1.3 样本采集时间及检测方法在急性期和恢复期两个时间点采集患儿血清,利用流式荧光技术检测相关细胞因子水平。急性期定义为发病时间0.5~8 d,入院前未发现好转;恢复期定义为治疗2~8周后临床相关症状消失,胸部X线和体征表现明显减缓或消失[11]。同时,使用咽拭子采集咽后壁拭取物,采集后置于EP管,低温保存,采用PCR荧光探针法于24 h内检测MP-DNA复制倍数。对需要接受电子支气管镜术及肺泡灌洗术治疗的SMPP患儿,监护人签署知情同意书后,行电子支气管镜术及肺泡灌洗术治疗。并获取肺泡灌洗液标本,低温保存,检测MP-DNA复制倍数及相关细胞因子水平。取咽拭子拭取物加入生理盐水,轻震荡后低温过夜,12 000 rpm/min离心5 min,取沉淀,加入50 μL DNA提取液,100℃条件下恒温处理约10 min,再次离心备用。取灌洗液标本,离心后取沉淀,加入生理盐水混匀后再次同条件离心,加入DNA提取液,进行PCR扩增。取血清样本移至流式管,加入荧光抗体,避光条件下染色30 min,加入FACS反应液,10 min后,在1 400 rpm/min条件下离心后弃上清,加入PBS混匀,再次离心弃上清,加入PBS混匀后利用流式细胞技术检测相关细胞因子水平。
1.4 统计学分析采用SPSS 20.0软件进行数据分析。计量资料采用均数±标准差(x±s)表示,组间比较采用配对t检验或两独立样本t检验。对于MP-DNA复制倍数结果予对数化处理后进行t检验。两变量的相关性分析采用Pearson相关分析法。P < 0.05为差异具有统计学意义。
2 结果 2.1 急性期与恢复期实验室指标的比较与恢复期相比,SMPP患儿在急性期时,血清C反应蛋白(CRP)、红细胞沉降率(ESR)、乳酸脱氢酶(LDH)、IL-1、IL-6、IL-8、IL-18水平显著增高,差异均具有统计学意义(P < 0.05),但急性期与恢复期IL-4、IL-10、IL-17、咽拭子MP-DNA复制倍数的比较差异无统计学意义(P > 0.05),见表 1。
| 表 1 SMPP患儿急性期与恢复期实验室指标的比较 |
|
|
SMPP患儿急性期肺泡灌洗液中的MP-DNA复制倍数为6.9±1.0(Log),显著高于咽拭子中的MP-DNA复制倍数[5.5±0.9(Log)],差异有统计学意义(t=6.999,P < 0.001)。急性期咽拭子与肺泡灌洗液中的MP-DNA复制倍数呈显著正相关(r=0.667,P < 0.001),见图 1。
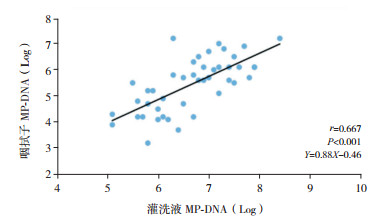
|
图 1 急性期咽拭子与肺泡灌洗液的MP-DNA复制倍数的相关性 |
SMPP患儿急性期血清IL-18水平与肺泡灌洗液MP-DNA复制倍数呈正相关(r=0.41,P=0.013)(图 2);急性期肺泡灌洗液IL-18水平与肺泡灌洗液MP-DNA复制倍数亦呈正相关(r=0.53,P < 0.001)(图 3)。
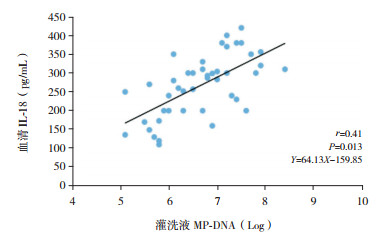
|
图 2 急性期血清IL-18与灌洗液MP-DNA复制倍数的相关性 |
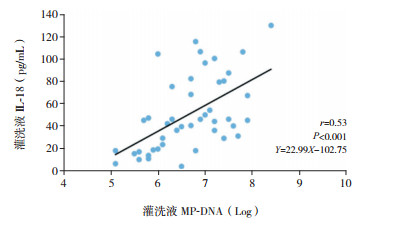
|
图 3 急性期灌洗液IL-18与MP-DNA复制倍数的相关性 |
所纳入研究的44例患儿中,19例病程中出现呼吸衰竭,进行了机械通气治疗。以是否需要进行机械通气为依据,将患儿分为机械通气组(19例,其中男11例,女8例,平均年龄6.1±2.1岁)和非机械通气组(25例,其中男18例,女7例,平均年龄5.5±2.1岁),两组性别及年龄的比较差异无统计学意义(P > 0.05)。统计分析发现,机械通气组急性期肺泡灌洗液MP-DNA复制倍数显著高于非机械通气组,且全身激素治疗时间明显长于非机械通气组,血清LDH、IL-18及肺泡灌洗液中WBC总数、IL-18水平也更高,差异均具有统计学意义(P < 0.05),见表 2。
| 表 2 不同病情患儿肺泡灌洗液MP-DNA复制水平及实验室指标的比较 (x±s) |
|
|
MPP是儿童社区获得性肺炎最常见的类型之一,SMPP是病情的进展阶段,以呼吸困难、低氧血症、长期发热等作为主要症状[9]。一般认为,SMPP患儿影像学检查更易出现肺不张、纵膈淋巴结肿大等表现,严重者可出现全身炎性反应综合征、支原体脑病等并发症[12]。缺乏高度特异性和灵敏性的生物标记物是SMPP延误诊治的重要原因,也是目前的研究热点之一。
支原体PCR检测特异性、敏感性更高,是支原体感染早期诊断的重要依据[13]。本研究发现,急性期肺泡灌洗液中的MP-DNA复制倍数显著高于咽拭子MP-DNA复制倍数。相关性分析也显示,两者的复制倍数呈显著正相关关系。但肺泡灌洗液与病变组织在解剖位置上更为接近,因此,对病原增殖情况的变化更敏感,更准确。与急性期相比,患儿在恢复期的咽拭子MP-DNA水平虽然有所下降,但差异未显示出统计学意义。这表明:(1)当临床取得显著疗效时,并不意味者患儿体内支原体复制水平也随着下降。受年龄影响,儿童的抗生素选择范围较小,支原体耐药现象也越来越普遍,传统的大环内酯类抗生素有时并不能有效清除体内残余支原体,基因位点突变是支原体耐药性产生的主要机制之一;(2)支原体有着独特的逃避机制,进入呼吸道后,可通过P1蛋白粘附于呼吸道黏膜上皮细胞,躲避纤毛清除;(3)SMPP患儿存在不同程度的纤毛功能受损,导致其清除病原菌及异物的作用下降。
抗炎系统与促炎系统对抗的结局直接决定着重症肺炎的临床转归,多种炎性标记物,如IL-2、IL-10、IL-12、TNF-α等常被作为病情严重程度的标志物。NF-κB信号通路激活是导致MPP患儿异常免疫反应的主要原因之一,NF-κB信号通路涉及包括IL-6、IL-8、TNF-α及LDH在内的多种细胞因子。有研究发现,MPP患儿体内NF-κB mRNA水平显著升高[14],这也在基因层面部分解释了MPP的免疫反应机制。全身激素应用是治疗SMPP的常用方法,其可能的原理是阻断NF-κB信号通路,促进炎症反应终止。在本研究中,患儿的血清CRP、ESR、LDH及血清IL-6、IL-8、IL-18等细胞因子均升高,表明其体内NF-κB信号通路可能已被激活。在MPP患者中,LDH水平常用来评估全身激素治疗的时机。Kurai等[15]指出,LDH达302~364 IU/L时,应考虑采用全身激素治疗。Inamura等[16]则认为,当LDH达410 IU/L时,有必要进行激素治疗。本研究患儿急性期LDH水平为403±123 IU/mL。细胞因子,尤其是IL-17/18等与机体免疫状态密切相关,MP-DNA复制倍数则反映了支原体的活动状况。进一步相关性分析结果显示,患儿急性期血清、肺泡灌洗液IL-18水平与肺泡灌洗液的MP-DNA复制倍数均呈正相关关系。机械通气组血清LDH、IL-18及肺泡灌洗液中WBC总数、IL-18水平也显著高于非机械通气组,提示MP-DNA的高倍复制可能是SMPP患儿过度免疫反应的触发因素之一,但MP-DNA的高倍复制是否是全身免疫功能亢进的维持因素尚不清楚。此外,本研究中,出现呼吸衰竭的机械通气组肺泡灌洗液复制倍数显著高于非机械通气组,且全身激素治疗时间明显长于非机械通气组,提示肺泡灌洗液复制倍数越高,患儿可能更易出现呼吸衰竭,但因本研究样本量小,尚需大样本数据进一步统计分析。
综上所述,本研究发现,需要纤维支气管镜干预治疗的SMPP急性期时,咽拭子MP-DNA复制倍数越高,则肺泡灌洗液中MP-DNA复制倍数越高,肺泡灌洗液MP-DNA复制倍数越高,血清及灌洗液中IL-18水平越高。病程中出现呼吸衰竭需要机械通气的患儿肺泡灌洗液MP-DNA复制倍数高于不需要机械通气的患儿,提示SMPP急性期肺泡灌洗液MP-DNA复制水平及IL-18水平可作为SMPP病情评估的参考指标。但本研究样本量较小,且为单中心研究,未来在多中心联合、增加样本量的基础上,或能为相关研究提供更具说服力的临床证据。
| [1] |
戴瑞, 刘亢亢, 牛曼曼, 等. 儿童难治性支原体肺炎86例分析[J]. 临床肺科杂志, 2017, 22(1): 96-98. DOI:10.3969/j.issn.1009-6663.2017.01.027 (  0) 0) |
| [2] |
谭政, 杨菁菁, 许小毛, 等. 支原体肺炎合并ARDS 2例并文献复习[J]. 国际呼吸杂志, 2017, 37(6): 411-417. DOI:10.3760/cma.j.issn.1673-436X.2017.06.003 (  0) 0) |
| [3] |
张慧芬, 白海涛, 李基明, 等. 肺炎支原体肺炎患儿肺炎支原体耐药性与DNA载量和基因型的关系研究[J]. 中国当代儿科杂志, 2017, 19(11): 1180-1184. DOI:10.7499/j.issn.1008-8830.2017.11.011 (  0) 0) |
| [4] |
宋宪蓉, 杜宇哲. 糖皮质激素在儿童难治性肺炎支原体肺炎中的研究[J]. 中国药物与临床, 2017, 17(6): 888-890. (  0) 0) |
| [5] |
郑茂, 陈瑶, 符佳, 等. 难治性肺炎支原体肺炎患儿的早期临床特征及相关细胞因子水平变化[J]. 中国医药, 2017, 12(10): 1499-1502. DOI:10.3760/cma.j.issn.1673-4777.2017.10.015 (  0) 0) |
| [6] |
张志英, 韩淑娟, 张小宁, 等. 肺炎痰液支原体DNA联合血清MP-IgM抗体检测在小儿肺炎支原体肺炎早期诊断中的价值[J]. 中国临床新医学, 2017, 10(9): 866-868. DOI:10.3969/j.issn.1674-3806.2017.09.11 (  0) 0) |
| [7] |
Chen Z, Shao X, Dou X, et al. Role of the Mycoplasma pneumoniae/interleukin-8/neutrophil axis in the pathogenesis of pneumonia[J]. PLoS One, 2016, 11(1): e0146377. DOI:10.1371/journal.pone.0146377 (  0) 0) |
| [8] |
Zhao J, Zhang W, Shen L, et al. Association of the ACE, GSTM1, IL-6, NOS3, and CYP1A1 polymorphisms with susceptibility of Mycoplasma pneumoniae pneumonia in Chinese children[J]. Medicine (Baltimore), 2017, 96(15): e6642. DOI:10.1097/MD.0000000000006642 (  0) 0) |
| [9] |
中华医学会儿科学分会呼吸学组, 《中华实用儿科临床杂志》编辑委员会. 儿童肺炎支原体肺炎诊治专家共识(2015年版)[J]. 中华实用儿科临床杂志, 2015, 30(17): 1304-1308. DOI:10.3760/cma.j.issn.2095-428X.2015.17.006 (  0) 0) |
| [10] |
支气管镜在急危重症临床应用专家共识组. 支气管镜在急危重症临床应用的专家共识[J]. 中华急诊医学杂志, 2016, 25(5): 568-572. DOI:10.3760/cma.j.issn.1671-0282.2016.05.006 (  0) 0) |
| [11] |
周连平, 陈晓艳, 袁斌. 心肌酶在肺炎支原体肺炎急性期感染患儿中的水平变化及相关因素分析[J]. 临床肺科杂志, 2018, 23(10): 1799-1803. DOI:10.3969/j.issn.1009-6663.2018.10.013 (  0) 0) |
| [12] |
侯昌凤, 茅双根. 儿童重症支原体肺炎治疗的进展[J]. 中华全科医学, 2016, 14(9): 1563-1565. (  0) 0) |
| [13] |
姜长宏, 沈永棋, 赵崇泉, 等. 肺炎支原体抗体检测与培养法、PCR法在诊断肺炎支原体感染的比较[J]. 热带医学杂志, 2017, 17(10): 1304-1306. DOI:10.3969/j.issn.1672-3619.2017.10.008 (  0) 0) |
| [14] |
梁景强, 梁燕芳, 伦志勇. 肺炎支原体肺炎患儿血清中NF-κB mRNA的表达及其意义[J]. 海南医学, 2010, 21(5): 112-113. DOI:10.3969/j.issn.1003-6350.2010.05.059 (  0) 0) |
| [15] |
Kurai D, Nakagaki K, Wada H, et al. Mycoplasma pneumoniae extract induces an IL-17-associated inflammatory reaction in murine lung:implication for mycoplasmal pneumonia[J]. Inflammation, 2013, 36(2): 285-293. (  0) 0) |
| [16] |
Inamura N, Miyashita N, Hasegawa S, et al. Management of refractory Mycoplasma pneumoniae pneumonia:utility of measuring serum lactate dehydrogenase level[J]. J Infect Chemother, 2014, 20(4): 270-273. DOI:10.1016/j.jiac.2014.01.001 (  0) 0) |
 2019, Vol. 21
2019, Vol. 21

