随着分子生物学、细胞遗传学、药物代谢酶等研究的不断深入,急性淋巴细胞白血病(acute lymphoblastic leukemia, ALL)这一威胁儿童生命的最常见的恶性肿瘤疗效不断提高。我国自2008年首次开展CCLG-ALL2008方案的多中心临床队列研究,协作组发表中位随访47.3个月的生存分析数据,5年无事件生存(EFS)率为79.9%[1],接近国际先进水平。我中心参与CCLG-ALL2008方案的临床研究,中位随访时间超过5年,现对940例应用此方案治疗的ALL患儿进行回顾性队列研究,评估不同分子生物学特征ALL患儿的长期疗效。
1 资料与方法 1.1 研究对象选取2008年1月至2015年4月于中国医学科学院血液病医院儿童血液病诊疗中心初诊并按CCLG-ALL2008方案接受治疗的ALL患儿共940例为研究对象,其中男570例,女370例,男女比为1.54 : 1,中位年龄5(1~15)岁。所有病例的诊断和疗效标准按照《血液病诊断及疗效标准》第3版[2]。
1.2 治疗方案所有患儿按CCLG-ALL2008方案[3-5]设定的危险度分级进行划分及治疗。CCLG-ALL2008方案是以BFM-95方案为蓝本,主要进行以下几点调整:(1)柔红霉素用量减少为25 mg/m2。(2)大剂量甲氨喋呤用量在标危组减为2 g/m2。(3)取消了预防性颅脑放疗。
1.3 随访总体生存(OS):从开始治疗至死亡或末次随访的时间。EFS:从开始治疗至第1次事件发生或末次随访时间;事件评估包括:诱导治疗未达完全缓解(CR)、失访、任何部位的复发、CR期间的死亡和发生第二肿瘤。失访:进入第2个疗程后放弃治疗或完成化疗后1年内无任何形式随访记录,失访患者OS期计算至末次随访日。
1.4 统计学分析采用SPSS 22.0统计软件对数据进行统计学分析,计量资料采用中位数(范围)表示,多组间的比较采用Kruskal-Wallis H检验。计数资料采用百分率(%)表示,样本率的比较采用卡方检验。采用Kaplan-Meier法评估患儿的OS率和EFS率并绘制生存曲线,组间患儿OS率和EFS率的比较采用log-rank检验。P < 0.05为差异有统计学意义。
2 结果 2.1 临床特征940例ALL患儿中,ETV6-RUNX1阳性177例(18.8%),TCF3-PBX1阳性56例(6.0%),BCR-ABL阳性44例(4.7%),MLL重排阳性19例(2.0%),无以上分子生物学特征患儿644例(68.5%)。
2.2 诱导治疗CR率940例初诊ALL患儿中,916例患儿经VDLD方案(长春新碱+柔红霉素+左旋门冬酰胺酶/培门冬酶+地塞米松)诱导化疗达CR,一疗程CR率为97.4%。ETV6-RUNX1阳性、TCF3-PBX1阳性、BCR-ABL阳性、MLL重排阳性、无以上分子生物学特征患儿一疗程CR率分别为97.2%(172/177)、98.2%(55/56)、84.1%(37/44)、100%(19/19)、98.3%(633/644),经比较差异有统计学意义(χ2=34.078,P < 0.001)。
2.3 复发916例经治疗后达CR患儿中,201例(21.9%)患儿复发。不同分子生物学特征患儿复发率及复发时间比较差异有统计学意义(P < 0.05)。其中MLL重排阳性、TCF3-PBX1阳性及BCR-ABL阳性患儿复发率较高;且ETV6-RUNX1阳性患儿易于晚期复发,MLL重排阳性患儿易于早期复发。见表 1。
| 表 1 不同分子生物学特征患儿复发情况分析 |
|
|
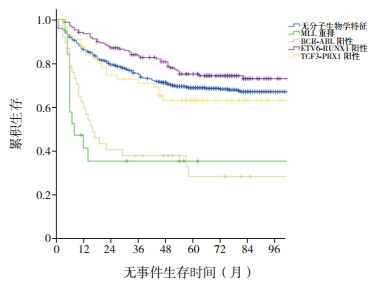
随访时间截止至2018年12月,随访中位时间为65(1~128)个月。940例ALL患儿中,失访45例,占4.8%;5年OS率为(77.6±1.5)%,EFS率为(67.0±1.6)%;预期10年OS率为(76.5±1.5)%,EFS率为(65.1±1.7)%。ETV6-RUNX1阳性177例患儿中,预期10年OS率为(85.6±2.9)%,EFS率为(73.1±3.7)%;TCF3-PBX1阳性56例患儿中,预期10年OS率为(69.1±7.2)%,EFS率为(63.1±6.6)%;BCR-ABL阳性44例患儿中,预期10年OS率为(49.6±10.5)%,EFS率为(28.5±8.3)%;MLL重排阳性19例患儿中,预期10年OS率为(46.6±13.4)%,EFS率为(35.5±11.2)%;无以上分子生物学特征的644例患儿中,预期10年OS率为(77.0±1.8)%,EFS率为(67.2±2.0)%(图 1~2)。log-rank分析显示,伴有ETV6-RUNX1阳性ALL患儿的预期10年OS率明显高于伴有BCR-ABL阳性(χ2=27.476,P < 0.001)、MLL重排(χ2=29.046,P < 0.001)、TCF3-PBX1阳性(χ2=6.782,P=0.009)及无分子生物学特征(χ2=6.640,P=0.010)ALL患儿;伴有ETV6-RUNX1阳性ALL患儿的预期10年EFS率明显高于伴有BCR-ABL阳性(χ2=44.454,P < 0.001)及MLL重排(χ2=30.946,P < 0.001)ALL患儿,而与伴有TCF3-PBX1阳性(χ2=3.547,P=0.461)及无分子生物学特征(χ2=3.402,P=0.065)患儿的预期10年EFS率比较差异无统计学意义。

|
图 1 不同分子生物学特征ALL患儿总生存曲线 |
|
图 2 不同分子生物学特征ALL患儿无事件生存曲线 |
中国儿童白血病协作组自2008年开展了国内多中心儿童ALL治疗协作方案即CCLG-ALL2008方案,此方案是在德国柏林-法兰克福-蒙斯特(BFM)协作组和美国儿童肿瘤协作组的治疗方案基础上制定的,以形态学、免疫学、细胞遗传学、分子生物学分型为诊断基础,以年龄、初诊白细胞数、免疫分型、泼尼松预治疗敏感性、分子生物学特征等进行危险性分组,总体上降低了标危组的化疗强度,增加了高危组的化疗强度,并取消了颅脑放疗,以三联鞘注代替来预防中枢神经系统白血病。
协作组在2018年发表了多中心总结数据,结果显示5年OS率及EFS率分别为85.3%和79.9%[1],国内亦有各中心的疗效总结,5年OS率和EFS率分别为80.6%和79.1%,中低危组2.5年OS率和EFS率分别为89.5%~96.1%和85.5%~93.0%[4-5]。本研究的中位随访时间为65个月,失访率低,预期10年OS率及EFS率分别为(76.5±1.5)%和(65.1±1.7)%,与其他中心报道相似,但较St.Jude儿童医院报道的5年OS率(93.5%)仍存在差异[6]。同时数据分析显示,伴有TCF3-PBX1融合基因阳性者预后相对较差,比文献报道的生存率低[7-8],可能与本组患儿起病时白细胞较高存在病例偏倚有关。而ETV6-RUNX1融合基因阳性者生存率与文献报道相似[9]。
复发仍是导致儿童ALL治疗失败的最主要原因,本研究中患儿总复发率为21.9%,伴有BCR-ABL或TCF3-PBX1及合并MLL重排者更容易复发。合并MLL重排及BCR-ABL阳性患儿多早期复发,而ETV6-RUNX1融合基因阳性者复发相对较晚, 与文献报道一致[10-12]。国内外报道儿童ALL采用微小残留病(MRD)作为治疗指导可明显提高生存率[13-14],且如能辨别Ph-like这一类基因表达谱与BCR-ABL阳性ALL患儿相似,却不伴有BCR-ABL融合基因突变的患者,加入靶向治疗可进一步提高疗效[15-16],但由于早期检测条件所限,本研究方案没有将MRD监测作为分型和调整危险度的依据,也未进行Ph-like等的检测,为本研究缺陷。
总之,回顾性分析本中心应用CCLG-ALL2008方案治疗初诊儿童ALL,结果显示第二肿瘤发生率低,与文献报道一致[17],并取得较好的长期疗效,接近国际先进协作组的疗效[18-19]。MLL重排、BCR-ABL阳性仍是ALL高复发的风险因素,规律、足量应用酪氨酸激酶抑制剂联合化疗治疗BCR-ABL阳性ALL,并定期检测MRD,通过先进的基因检测等手段,辨别出隐藏的高危因素,个体化加入靶向药物,免疫治疗等的应用,合理选择造血干细胞移植,可进一步提高儿童ALL的长期生存率。
| [1] |
Cui L, Li ZG, Chai YH, et al. Outcome of children with newly diagnosed acute lymphoblastic leukemia treated with CCLG-ALL 2008:The first nation-wide prospective multicenter study in China[J]. Am J Hematol, 2018, 93(7): 913-920. DOI:10.1002/ajh.25124 (  0) 0) |
| [2] |
秘营昌, 卞寿庚.急性淋巴细胞白血病[M]//张之南, 沈悌.血液病诊断及疗效标准.第3版.北京: 科学出版社, 2007: 116-121.
(  0) 0) |
| [3] |
中华医学会儿科学分会血液学组, 《中华儿科杂志》编辑委员会. 儿童急性淋巴细胞白血病诊疗建议(第四次修订)[J]. 中华儿科杂志, 2014, 52(9): 641-644. DOI:10.3760/cma.j.issn.0578-1310.2014.09.001 (  0) 0) |
| [4] |
刘晓明, 邹尧, 王慧君, 等. CCLG-2008方案治疗标危中危儿童急性淋巴细胞白血病中期随访结果[J]. 中华儿科杂志, 2014, 52(6): 449-454. DOI:10.3760/cma.j.issn.0578-1310.2014.06.011 (  0) 0) |
| [5] |
陈晓娟, 邹尧, 杨文钰, 等. CCLG-ALL2008方案治疗儿童急性淋巴细胞白血病复发患儿的特征分析[J]. 中国当代儿科杂志, 2015, 7(4): 321-326. (  0) 0) |
| [6] |
Pui CH, Yang JJ, Hunger SP, et al. Childhood acute lymphoblastic leukemia:progress through collaboration[J]. J Clin Oncol, 2015, 33(27): 2938-2948. DOI:10.1200/JCO.2014.59.1636 (  0) 0) |
| [7] |
Asai D, Imamura T, Yamashita Y, et al. Outcome of TCF3-PBX1 positive pediatric acute lymphoblastic leukemia patients in Japan:a collaborative study of Japan Association of Childhood Leukemia Study (JACLS) and Children's Cancer and Leukemia Study Group (CCLSG)[J]. Cancer Med, 2014, 3(3): 623-631. DOI:10.1002/cam4.221 (  0) 0) |
| [8] |
Pui CH, Mullighan CG, Evans WE, et al. Pediatric acute lymphoblastic leukemia:where are we going and how do we get there?[J]. Blood, 2012, 120(6): 1165-1174. DOI:10.1182/blood-2012-05-378943 (  0) 0) |
| [9] |
王邢玮, 李本尚, 沈树红, 等. ETV6/RUNX1阳性儿童急性B系淋巴细胞白血病临床预后研究[J]. 临床儿科杂志, 2016, 34(5): 321-325. DOI:10.3969/j.issn.1000-3606.2016.05.001 (  0) 0) |
| [10] |
王振华, 戢莉, 王莉红, 等. 伴MLL基因异常白血病的检测及其临床意义[J]. 实用医学杂志, 2018, 34(15): 2533-2536. DOI:10.3969/j.issn.1006-5725.2018.15.019 (  0) 0) |
| [11] |
郭晔, 刘天峰, 阮敏, 等. 伊马替尼治疗儿童Ph阳性急性淋巴细胞白血病的疗效和安全性[J]. 中国当代儿科杂志, 2015, 17(8): 819-824. (  0) 0) |
| [12] |
Sun C, Chang L, Zhu X. Pathogenesis of ETV6/RUNX1-positive childhood acute lymphoblastic leukemia and mechanisms underlying its relapse[J]. Oncotarget, 2017, 8(21): 35445-35459. (  0) 0) |
| [13] |
蔡娇阳, 王宁玲, 蒋慧, 等. 儿童急性淋巴细胞白血病2005方案多中心远期临床报告[J]. 中华儿科杂志, 2018, 56(7): 511-517. DOI:10.3760/cma.j.issn.0578-1310.2018.07.008 (  0) 0) |
| [14] |
Pui CH, Campana D. Minimal residual disease in pediatric ALL[J]. Oncotarget, 2017, 8(45): 78251-78252. (  0) 0) |
| [15] |
Mullighan CG, Su X, Zhang J, et al. Deletion of IKZF1 and prognosis in acute lymphoblastic leukemia[J]. N Engl J Med, 2009, 360(5): 470-480. DOI:10.1056/NEJMoa0808253 (  0) 0) |
| [16] |
Den Boer ML, van Slegtenhorst M, De Menezes RX, et al. A subtype of childhood acute lymphoblastic leukaemia with poor treatment outcome:a genome-wide classification study[J]. Lancet Oncol, 2009, 10(2): 125-134. DOI:10.1016/S1470-2045(08)70339-5 (  0) 0) |
| [17] |
Schmiegelow K, Levinsen MF, Attarbaschi A, et al. Second malignant neoplasms after treatment of childhood acute lymphoblastic leukemia[J]. J Clin Oncol, 2013, 31(19): 2469-2476. DOI:10.1200/JCO.2012.47.0500 (  0) 0) |
| [18] |
Pui CH, Yang JJ, Hunger SP, et al. Childhood acute lymphoblastic leukemia:progress through collaboration[J]. J Clin Oncol, 2015, 33(27): 2938-2948. DOI:10.1200/JCO.2014.59.1636 (  0) 0) |
| [19] |
Pui CH, Pei D, Campana D, et al. A revised definition for cure of childhood acute lymphoblastic leukemia[J]. Leukemia, 2014, 28(12): 2336-2343. DOI:10.1038/leu.2014.142 (  0) 0) |
 2019, Vol. 21
2019, Vol. 21


