儿童严重脓毒症是一种危及生命的疾病,其发病率为8.2%,住院死亡率高达25%,且有逐年增加的趋势,已成为全世界一个非常普遍的公共卫生问题和严重的社会负担[1-3]。2016年美国医学杂志发布的第3版脓毒症与脓毒症休克定义国际共识将脓毒症定义为由宿主对感染反应失调所致的危及生命的脏器功能不全,脏器功能不全采用序贯器官衰竭评分(sepsis-related organ failure assessment, SOFA)来评估,同时删除了原有的严重脓毒症定义[4]。遗憾的是,这一共识是基于成人的研究,其在儿科领域的应用价值还有待更多的研究验证。本研究通过回顾性分析我院重症医学科收治的严重脓毒症患儿的临床资料,探讨3种评分系统在预测儿童严重脓毒症预后方面和临床决策中的价值,以期为儿童脓毒症研究提供临床依据。
1 资料与方法 1.1 研究对象回顾性收集2012年7月至2018年6月我院重症医学科收治的严重脓毒症患儿为研究对象。纳入标准:符合《儿童脓毒性休克(感染性休克)诊治专家共识(2015版)》[5]中严重脓毒症诊断标准的患儿,即为由脓毒症导致的器官功能障碍或组织低灌注;脓毒症定义为由感染引起的全身炎症反应综合征(systemic inflammatory response syndrome, SIRS)。排除标准:(1)入院24 h内死亡或放弃治疗后预计在24 h内死亡的患儿;(2)入院72 h内修正诊断不符合严重脓毒症诊断标准的患儿;(3)临床资料不完整者(缺省值> 5项)。
1.2 研究资料收集符合纳入标准的严重脓毒症患儿入院24 h内的临床资料,并依此计算儿童年龄适应性序贯器官衰竭评分(Pediatric Age-adapted SOFA, pSOFA)、儿童死亡危险度评分(Pediatric Risk of Mortality Ⅲ, PRISM Ⅲ)、儿童危重病例评分(Pediatric Critical Illness Score, PCIS)。其中pSOFA评分采用Schlapbach等[6]修订的经年龄适应性调整的SOFA评分表。
1.3 结局指标住院28 d内因脓毒症直接导致死亡的患儿纳入死亡组,未死亡的患儿则为存活组。
1.4 统计学分析采用SPSS 24.0软件进行数据处理。计数资料以例数和百分率(%)表示。受试者工作特征曲线(receiver operating characteristic curve, ROC)下面积(area under the cure, AUC)用以评估3种评分系统对严重脓毒症预后的预测价值。MedCalc 18.2.1软件对AUC进行Z检验。R软件3.4.3对3种评分系统进行曲线拟合和阈值效应分析,并用决策曲线分析(decision curve analysis, DCA)绘制决策曲线,计算某风险下的标准化净受益(standardized net benefit, SNB)以评价3种评分系统的临床实用价值。P < 0.05示差异有统计学意义。SNB定义为在一定的预测概率下,采取干预措施,每百人能从中获益而不损害其他任何人利益的人数。
2 结果 2.1 一般资料共收集193例严重脓毒症患儿,男113例(58.5%),女80例(41.5%),起病年龄5.7(2,21)个月;存活组151例(78.2%),死亡组42例(21.8%)。所有患儿均存在明确的感染部位,其中下呼吸道感染75例(38.9%),腹腔胃肠道感染49例(25.4%),血源性感染33例(17.1%),中枢神经系统感染27例(14.0%),皮肤及软组织感染6例(3.1%),其他部位感染3例(1.6%)。微生物培养阳性84例(43.5%),共培养出与临床感染符合的病原微生物93株,革兰氏阳性菌39株,革兰氏阴性菌54株。排列前5位的病原菌分别为肺炎链球菌14株,铜绿假单胞菌14株,大肠埃希菌12株,金黄色葡萄球菌11株,肺炎克雷伯菌6株。193例严重脓毒症患儿中合并感染性休克74例(38.3%),存在2个及以上器官功能障碍69例(35.8%)。
2.2 ROC分析3种评分系统对严重脓毒症患儿预后的预测价值PRISM Ⅲ、pSOFA、PCIS评分系统的AUC值分别为0.876、0.848、0.802,均具有一定的预测价值(P < 0.05)。其中,PCIS与pSOFA预测价值相当(Z=1.334,P=0.182),PRISM Ⅲ与pSOFA预测价值相当(Z=1.255,P=0.210),但PRISM Ⅲ评分优于PCIS评分(Z=2.008,P=0.045)。见图 1,表 1。
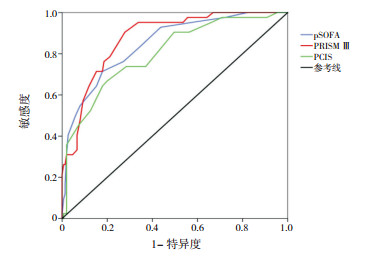
|
图 1 三种评分系统ROC分析 |
| 表 1 三种评分系统对儿童严重脓毒症预后的ROC分析 |
|
|
将3种评分系统两两进行曲线拟合,pSOFA与PRISMⅢ拟合判定系数(R2=0.634)高于pSOFA与PCIS拟合判定系数(R2=0.474),高于PRISMⅢ与PCIS拟合判定系数(R2=0.463),说明pSOFA与PRISMⅢ相关性更好。见图 2~4。
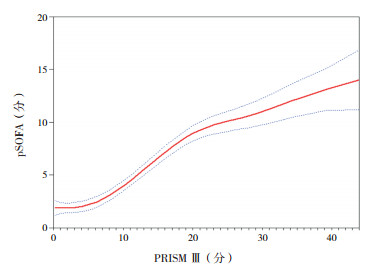
|
图 2 PRISM Ⅲ与pSOFA拟合曲线 图中红实线代表拟合曲线,蓝虚线代表 95%置信区间。 |
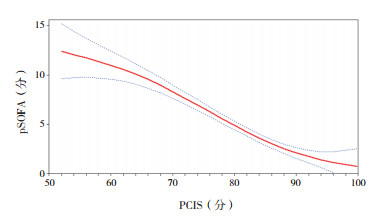
|
图 3 PCIS与pSOFA拟合曲线 图中红实线代表拟合曲线,蓝虚线代表 95%置信区间。 |
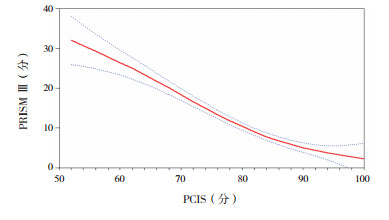
|
图 4 PCIS与PRISM Ⅲ拟合曲线 图中红实线代表拟合曲线,蓝虚线代表 95%置信区间。 |
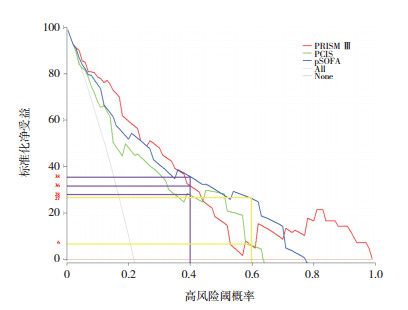
将3种评分系统作为临床决策辅助工具,进行DCA分析。假设严重脓毒症患儿死亡风险概率为0.4时,立即采取紧急干预措施,使用pSOFA评分作为预测工具,每百人中有38人从中受益而不损害其他任何人的利益;使用PRISM Ⅲ评分作为预测工具,每百人中有32人从中受益而不损害其他任何人的利益;使用PCIS评分作为预测工具,每百人中有28人从中受益而不损害其他任何人的利益。当严重脓毒症患儿死亡风险概率为0.6时,立即采取紧急干预措施,使用pSOFA评分作为预测工具,每百人中有27人从中受益而不损害其他任何人的利益;使用PRISM Ⅲ评分和PCIS评分作为预测工具,每百人中仅有6人从中受益而不损害其他任何人的利益。作为预测工具,SNB(pSOFA) > SNB(PRISM Ⅲ) > SNB(PCIS),pSOFA评分优于PRISM Ⅲ评分和PCIS评分。见图 5。
|
图 5 三种评分系统DCA分析 [pSOFA]儿童年龄适应性序贯器官衰竭评分;[PRISMⅢ]儿童死亡危险度评分;[PCIS]儿童危重病例评分。斜灰线(All)代表所有患儿给予紧急干预,患儿的标准化净受益;横实线(None)表示所有患儿均不给予紧急干预,此时标准化净受益为0。 |
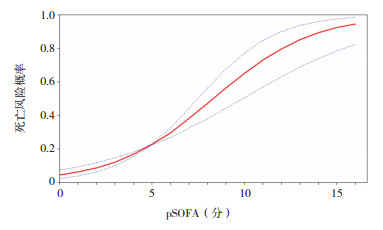
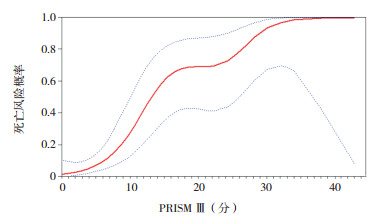
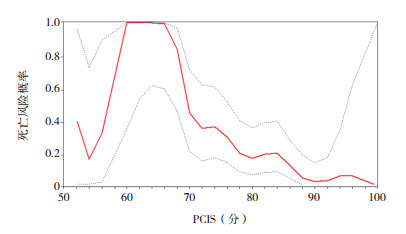
将pSOFA、PRISM Ⅲ、PCIS评分系统与预后进行平滑曲线拟合,并进行阈值效应分析。pSOFA、PRISM Ⅲ与死亡风险呈直线性关系(P > 0.05),pSOFA每增加1分,死亡风险增加40%(OR=1.4,95%CI:1.3~1.6,P < 0.001),PRISM Ⅲ每增加1分,死亡风险增加20%(OR=1.2,95%CI:1.1~1.3,P < 0.001);PCIS与死亡风险呈非直线性关系(P=0.016),当PCIS > 66分时,每增加1分,死亡风险减少20%(OR=0.8,95%CI:0.8~0.9,P < 0.001),PCIS≤66分时,只提示病情轻重,对死亡风险预测差异无统计学意义(P=0.320)。见图 6~8。
|
图 6 pSOFA评分与死亡风险拟合曲线 图中红实线代表拟合曲线,蓝虚线代表 95%置信区间。 |
|
图 7 PRISM Ⅲ评分与死亡风险拟合曲线 图中红实线代表拟合曲线,蓝虚线代表 95%置信区间。 |
|
图 8 PCIS评分与死亡风险拟合曲线 图中红实线代表拟合曲线,蓝虚线代表 95%置信区间。 |
2018年拯救脓毒症运动(Surviving Sepsis Campaign,SSC)发布了“1小时集束化治疗(hour-1 bundle)”指南[7],旨在为早期识别和快速干预提供科学依据。集束化治疗的核心理念就是将脓毒症视为一种紧急医疗事件而不是单一疾病,早期鉴别和紧急干预将有利于改善脓毒症患者的预后。
2016年发布的成人第3版脓毒症与脓毒症休克定义国际共识完全摒弃了SIRS标准,采用SOFA评分来判断感染引起的器官功能障碍,即Sepsis 3.0标准[4]。新标准提出后,很快就有国内外儿科领域研究者尝试将此标准经年龄适应性修改后运用于儿童脓毒症的诊断和预后。事实上,2006年俄罗斯研究者曾将SOFA评分用于儿童脓毒症死亡的预测,研究结果显示SOFA评分可以较好预测儿童脓毒症的死亡,但文中并没有提及SOFA评分是否经过年龄适应性修改[8]。目前Schlapbach等[6]和Matics等[9]依据儿童器官功能障碍评分(Pediatric Logistic Organ Dysfunction, PELOD-2),将SOFA评分中心血管和肾脏部分进行年龄适应性调整,2个研究均得到了相似的结果:pSOFA≥2分对儿童脓毒症死亡有较好的区分度,优于SIRS评分,与PELOD-2评分相当。Wu等[10]研究也得到了相似的结果。因此,在设计本次研究时,结合本中心的实际,选择了Schlapbach等[6]发布的pSOFA评分系统进行研究。结果显示,pSOFA≥2分时,死亡率为27.3%;pSOFA < 2分时,仅1例死亡,死亡率为2.3%,同样对严重脓毒症患儿死亡预后有较高的区分能力,与上述研究一致。但SOFA评分是基于成人的研究,尚无公认的适合儿童的标准,特别是其中的心血管和肾功能方面的评估,儿童与成人有较大差异,SOFA评分的儿童适应性研究也大多集中在此。这些研究大多都是单中心、小样本,虽取得了一定的成果,但离推广使用尚需国内外同行验证。
PCIS是1995年中华医学会儿科学分会急诊学组和中华医学会急诊学分会儿科学组依据我国国情制订的。该评分简便易操作,即使在二级医疗机构也能获得全部的评分资料,因此在我国各级儿童重症监护室(PICU)广泛使用[11]。上海ICU脓毒症诊治情况调查协作组发布的上海市4家PICU脓毒症调查分析显示PCIS对脓毒症患儿的严重程度和预后判断具有指导意义[12]。齐英征[13]和李娟珍等[14]研究也得出类似的结论。本研究中曲线拟合和阈值效应分析显示,PCIS与严重脓毒症患儿的预后并非直线关系,当PCIS≤66分时只提示病情严重度,并不能准确预测预后。李耿等[15]将PCIS按分值和时间分层后在急性呼吸窘迫综合征患儿中的应用研究也显示,PCIS在一定程度上可以提示病情的轻重,但不能准确预测患儿的预后。这可能因为儿童群体的特殊性和个体间的差异性,疾病的轻重程度与预后并不完全一致有关。此外,国内大多数研究仅局限于组间均值的比较,并未就PCIS评分与预后的关系进行更深入的研究,因此所得结果并不一定能完全反映真实情况。
PRISMⅢ是1996年Pollack等[16]在原PRISM基础上建立的,囊括神经、呼吸、循环、凝血、内环境等17项生理参数,26项参数范围。国内外临床研究均肯定了其在预测疾病严重度和死亡风险方面的价值[17-20]。Nadel等[21]多中心研究显示PRISM Ⅲ是儿童严重脓毒症的独立危险因素,每增加1分,死亡风险增加4%。本研究显示PRISM Ⅲ与预后呈直线关系,PRISM Ⅲ评分越高,提示死亡风险越大,PRISM Ⅲ评分每增加1分,死亡风险增高20%,明显高于Nadel等的研究。这可能与本院作为区域性儿童疾病治疗中心,纳入的病例大多为区域内其他医疗机构治疗后效果不佳或疾病仍旧进展加重的患儿,疾病的基线水平异质性有关。此外,本研究为单中心研究,样本量不足也可能是导致结果偏高的重要原因。
本研究ROC分析显示pSOFA、PRISM Ⅲ、PCIS对严重脓毒症患儿的预后均有一定预测效能。PRISM Ⅲ灵敏度最高(90.5%),pSOFA特异度最高(82.1%),PRISMⅢ的预测价值优于PCIS评分。DCA分析显示pSOFA评分作为临床决策辅助工具,在死亡风险 < 0.6的较大区间内都能使患儿明显受益。因此,从总体水平上分析,pSOFA评分的实际使用意义可能更优于PRISM Ⅲ评分,特别是那些临床已经表现明显的中、高死亡风险的患儿,使用pSOFA评分系统可能更加适宜。当然,此时使用PRISM Ⅲ、PCIS评分系统仍可用于判断患儿病情的轻重,如能动态评估对患儿预后和治疗效果也有一定的提示作用。
本研究严重脓毒症诊断标准严格依据2015版儿童脓毒性休克诊治专家共识,与Sepsis 3.0标准的脓毒症定义相符。研究结果显示,儿童严重脓毒症最常见感染部位分别是下呼吸道、腹腔及胃肠道、血液和神经,与2017全球疾病负担研究(Global Burden of Disease 2017 Study)公布的全球儿童因感染死亡原因分布一致[22]。本研究中严重脓毒症的住院死亡率,多器官功能障碍和脓毒症休克发生率均与其他中心的研究吻合[1, 10, 14, 23],因此数据具有一定的代表性。但本研究系单中心回顾性研究,且时间跨度较长,部分病案数据缺失和遗漏,因此存在一定的偏倚和误差。我们期待尽快开展多中心前瞻性的研究,以为儿童脓毒症新定义提供依据。
脓毒症不仅仅是一个单一的疾病,年龄、性别、种族、经济、环境等对其病理生理机制都存在一定的影响,并且具有不同的风险和预后。因此,儿童脓毒症不是简单的缩小版的成人脓毒症,它有其独特的病理生理特点,在参考成人研究的同时,必须充分考虑,反复求证改良,才能更好的服务于儿童这一特殊人群。
| [1] |
Weiss SL, Fitzgerald JC, Pappachan J, et al. Global epidemiology of pediatric severe sepsis:the sepsis prevalence, outcomes, and therapies study[J]. Am J Respir Crit Care Med, 2015, 191(10): 1147-1157. DOI:10.1164/rccm.201412-2323OC (  0) 0) |
| [2] |
Hartman ME, Linde-Zwirble WT, Angus DC, et al. Trends in the epidemiology of pediatric severe sepsis[J]. Pediatr Crit Care Med, 2013, 14(7): 686-693. DOI:10.1097/PCC.0b013e3182917fad (  0) 0) |
| [3] |
Kissoon N, Uyeki TM. Sepsis and the global burden of disease in children[J]. JAMA Pediatr, 2016, 170(2): 107-108. DOI:10.1001/jamapediatrics.2015.3241 (  0) 0) |
| [4] |
Singer M, Deutschman CS, Seymour CW, et al. The third international consensus definitions for sepsis and septic shock (Sepsis-3)[J]. JAMA, 2016, 315(8): 801-810. DOI:10.1001/jama.2016.0287 (  0) 0) |
| [5] |
中华医学会儿科学分会急救学组, 中华医学会急诊医学分会儿科学组, 中国医师协会儿童重症医师分会. 儿童脓毒性休克(感染性休克)诊治专家共识(2015版)[J]. 中华儿科杂志, 2015, 53(8): 576-580. DOI:10.3760/cma.j.issn.0578-1310.2015.08.007 (  0) 0) |
| [6] |
Schlapbach LJ, Straney L, Bellomo R, et al. Prognostic accuracy of age-adapted SOFA, SIRS, PELOD-2, and qSOFA for in-hospital mortality among children with suspected infection admitted to the intensive care unit[J]. Intensive Care Med, 2018, 44(2): 179-188. DOI:10.1007/s00134-017-5021-8 (  0) 0) |
| [7] |
Levy MM, Evans LE, Rhodes A. The Surviving Sepsis Campaign bundle:2018 update[J]. Crit Care Med, 2018, 46(6): 997-1000. DOI:10.1097/CCM.0000000000003119 (  0) 0) |
| [8] |
Chkhaidze MG, Kheladze ZS, Pruidze DR, et al. Comparison of PIM and SOFA scoring systems for mortality risk prognosis in critically ill children with sepsis[J]. Georgian Med News, 2006, 131: 66-68. (  0) 0) |
| [9] |
Matics TJ, Sanchez-Pinto LN. Adaptation and validation of a Pediatric Sequential Organ Failure Assessment Score and evaluation of the Sepsis-3 definitions in critically ill children[J]. JAMA Pediatr, 2017, 171(10): e172352. DOI:10.1001/jamapediatrics.2017.2352 (  0) 0) |
| [10] |
Wu Z, Liang Y, Li Z, et al. Accuracy comparison between age-adapted SOFA and SIRS in predicting in-hospital mortality of infected children at China's PICU[J]. Shock, 2019, 52(3): 347-352. DOI:10.1097/SHK.0000000000001261 (  0) 0) |
| [11] |
小儿危重病例评分试用协作组. 小儿危重病例评分法(草案)临床应用的评价[J]. 中华儿科杂志, 1998, 10: 579. DOI:10.3760/j.issn:0578-1310.1998.10.001 (  0) 0) |
| [12] |
上海ICU脓毒症诊治情况调查协作组. 上海市四家儿童医院重症监护病房304例脓毒症诊治调查分析[J]. 中华儿科杂志, 2012, 50(3): 172-177. DOI:10.3760/cma.j.issn.0578-1310.2012.03.004 (  0) 0) |
| [13] |
齐英征. 降钙素原与小儿危重病例评分对脓毒症患儿预后的影响[J]. 中国当代儿科杂志, 2014, 16(2): 190-193. (  0) 0) |
| [14] |
李娟珍, 王莹. PICU中儿童脓毒症临床特点和预后相关因素分析[J]. 临床儿科杂志, 2017, 35(10): 762-768. DOI:10.3969/j.issn.1000-3606.2017.10.012 (  0) 0) |
| [15] |
李耿, 喻文亮, 于学军, 等. 小儿危重病例评分和死亡指数在急性呼吸窘迫综合征中的应用[J]. 中华急诊医学杂志, 2007, 16(5): 518-521. DOI:10.3760/j.issn:1671-0282.2007.05.017 (  0) 0) |
| [16] |
Pollack MM, Patel KM, Ruttimann UE. PRISM Ⅲ:an updated Pediatric Risk of Mortality score[J]. Crit Care Med, 1996, 24(5): 743-752. DOI:10.1097/00003246-199605000-00004 (  0) 0) |
| [17] |
Silva PS, Fonseca MC, Iglesias SB, et al. Comparison of two different severity scores (Paediatric Risk of Mortality[J]. Ann Trop Paediatr, 2001, 21(2): 135-140. (  0) 0) |
| [18] |
van Keulen JG, Polderman KH, Gemke RJ. Reliability of PRISM and PIM scores in paediatric intensive care[J]. Arch Dis Child, 2005, 90(2): 211-214. DOI:10.1136/adc.2003.046722 (  0) 0) |
| [19] |
Wang C, Xie G, Cheng B, et al. Performance of Pediatric Risk of Mortality, Pediatric Index of Mortality and PIM2 in term Chinese neonates[J]. J Trop Pediatr, 2010, 56(4): 235-241. DOI:10.1093/tropej/fmp124 (  0) 0) |
| [20] |
应佳云, 张铮铮, 陆国平. 儿童危重病例评分和第三代儿童死亡危险评分在危重患儿的应用情况[J]. 中国循证儿科杂志, 2018, 13(3): 185-189. DOI:10.3969/j.issn.1673-5501.2018.03.006 (  0) 0) |
| [21] |
Nadel S, Goldstein B, Williams MD, et al. Drotrecogin alfa (activated) in children with severe sepsis:a multicentre phase Ⅲ randomised controlled trial[J]. Lancet, 2007, 369(9564): 836-843. DOI:10.1016/S0140-6736(07)60411-5 (  0) 0) |
| [22] |
GBD 2017 Causes of Death Collaborators. Global, regional, and national age-sex-specific mortality for 282 causes of death in 195 countries and territories, 1980-2017:a systematic analysis for the Global Burden of Disease Study 2017[J]. Lancet, 2018, 392(10159): 1736-1788. DOI:10.1016/S0140-6736(18)32203-7 (  0) 0) |
| [23] |
北京地区PICU脓毒症调查协作组. 北京地区两家医院儿科重症监护病房486例脓毒症分析[J]. 中华儿科杂志, 2012, 50(3): 178-183. DOI:10.3760/cma.j.issn.0578-1310.2012.03.005 (  0) 0) |
 2019, Vol. 21
2019, Vol. 21


