我国儿童肥胖发病率为7.4%[1],且不断增高,肥胖是引起胰岛素抵抗的最主要危险因素,且与2型糖尿病密切相关。胰岛素抵抗发病机制复杂,微小RNA(microRNA)是近年来新发现的一类普遍存在于动植物体内的非编码小分子RNA,有重要调控作用。其中microRNA-122(miR-122)在肝脏中高度表达,占肝脏中所有microRNA的70%以上,而肝脏作为糖脂代谢的中心,是胰岛素抵抗发生发展的关键部位,miR-122与胰岛素抵抗相关已有报道,但仍存在争议。Willeit等[2]发现miR-122与新发代谢综合征及2型糖尿病强相关,Wang等[3]发现miR-122与胰岛素抵抗及体重指数正相关,Shah等[4]也得出了类似结论。但Ortega等[5]发现重度病态性肥胖患者miR-122与体重指数负相关,但并未对miR-122与胰岛素抵抗的关系进行研究。由于miR-122与胰岛素抵抗的关系仍不明确,且相关研究主要针对成年人群,故非常有必要在儿童肥胖患者中对miR-122及胰岛素抵抗的相关性进行研究。近年来,胰岛素抵抗是由炎症因子诱发的慢性低水平炎症反应的观点逐渐被认可,炎症因子与胰岛素抵抗的相关性逐渐被认识。在单纯性肥胖儿童的研究中发现,IL-6是胰岛素抵抗的独立影响因子[6],而细胞实验中miR-122可抑制炎症因子如IL-6的释放[7],提示miR-122可能与IL-6相关并影响胰岛素抵抗。本文拟收集我院就诊的单纯性肥胖儿童患者,进一步探讨miR-122与胰岛素抵抗及炎症因子IL-6的相关性。
1 资料与方法 1.1 一般资料选取2016年1月至2017年1月在郑州大学附属儿童医院内分泌遗传代谢科就诊的7~14岁重度肥胖儿童为研究对象。体重大于同年龄同性别同身高儿童体重均值50%者定义为重度肥胖[8]。排除标准:(1)患严重肝肾或其他全身性疾病;(2)应用可能影响肝功能、血脂、改善胰岛素抵抗的药物;(3)饮酒史;(4)下丘脑、垂体、甲状腺等其他原因引起的病理性肥胖;(5)排除空腹血糖≥5.6 mmol/L及已达糖尿病标准的患儿。最终纳入本研究的重度肥胖患儿47例为肥胖组,其中男28例,女19例,平均年龄9.9±2.0岁。选取同期于本院门诊体检,与肥胖组年龄、性别相匹配的正常体重健康儿童作为健康对照组,其中男23例,女22例,年龄10.2±1.7岁。本研究均征得入组儿童家长同意,并获得医院医学伦理委员会批准。
1.2 体格指标两组儿童清晨空腹、脱鞋,仅穿单衣测量体重(kg)、身高(cm)、腰围(cm)和臀围(cm)。体重指数(BMI)=体重/身高2,腰臀比(WHR)=腰围/臀围。
1.3 生化指标上午8 : 00~9 : 00,采集两组儿童空腹静脉血,检测空腹血糖(FBG)、空腹胰岛素(FINS)、甘油三酯(TG)、总胆固醇(TC)、游离脂肪酸(FFA)、白介素-6(IL-6)。胰岛素抵抗指数(HOMA-IR)=FBG×FINS/22.5。
1.4 实时荧光定量PCR法检测miR-122水平使用TRIzol法提取血清总RNA,紫外分光光度计法根据OD260/OD280比值估测RNA纯度,比值在1.8~2.0之间满足实验要求。采用逆转录试剂盒(北京东胜创新生物科技有限公司,EDC-810)将RNA逆转录为cDNA,操作步骤依据试剂盒说明书进行。引物的设计与合成由武汉擎科创新生物科技有限公司提供,miRNA-122环状引物序列为5'-GTCGTATCCAGTGCAGGGTCCGAGGTATTCG-CACTGGATACGACCAAACACC-3',上游引物序列为5'-TGCGCTGGAGTGTGACAATGGT-3',下游引物序列为5'-CCAGTGCAGGGTCCGAGGTATT-3',片段长度为130 bp;内参U6的上游引物序列为5'-CGCTTCGGCAGCACATATAC-3',下游引物序列为5'-AAATATGGAACGCTTCACGA-3',片段长度为95 bp。实时荧光定量PCR(qRT-PCR)试剂盒由南京诺唯赞生物科技有限公司提供。反应体系:cDNA 4 μL,上、下游引物(10 μmol/L)各0.4 μL,SYBR Green Master Mix 10 μL,50×ROX Reference Dye 20.4 μL,H2O 4.8 μL。反应条件:50℃ 2 min,95℃ 10 min;95℃ 30 s,60℃ 30 s,40个循环。实验在qRT-PCR仪(QuantStudio 6,美国ABI)上进行,每个cDNA样本平行检测3次,所得循环阈值(CT值)取平均值。绘制溶解曲线,最终结果以2-△△Ct表示。
1.5 统计学分析采用SPSS 20.0统计软件对数据进行统计学分析。计量资料以均数±标准差(x±s)表示,两组间的比较采用两样本t检验。采用Pearson相关分析法探讨miR-122与各实验室指标的相关性。采用多元线性回归分析各实验室指标对miR-122水平的影响。P≤0.05为差异有统计学意义。
2 结果 2.1 两组儿童临床资料肥胖组身高、体重、BMI、WHR及TG、FINS、HOMA-IR、miR-122、FFA、IL-6水平均高于健康对照组(P < 0.05),肥胖组年龄、性别及TC、FBG水平与健康对照组比较差异无统计学意义(P > 0.05),见表 1。
| 表 1 两组儿童临床资料比较 (x±s或例) |
|
|
92例肥胖及健康对照组儿童总体相关分析结果显示:miRNA-122与BMI、WHR、FBG、FINS、HOMA-IR、FFA及IL-6呈正相关(P≤0.05);47例肥胖组儿童相关分析结果显示:miR-122与FINS、HOMA-IR、IL-6呈正相关(P < 0.05),相关分析图见图 1~3;45例对照组儿童相关分析结果显示:miR-122与FINS及HOMA-IR呈正相关(P < 0.05)。见表 2。
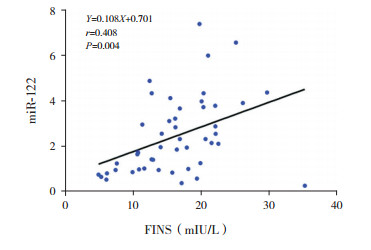
|
图 1 肥胖组miR-122与FINS相关分析图 |
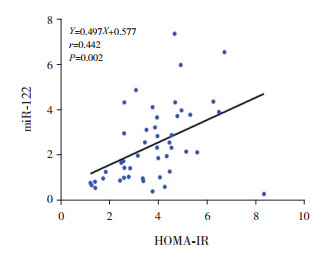
|
图 2 肥胖组miR-122与HOMA-IR相关分析图 |
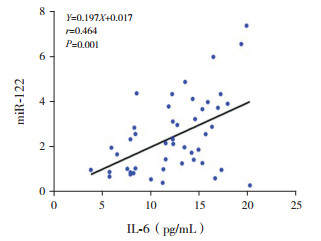
|
图 3 肥胖组miR-122与IL-6相关分析图 |
| 表 2 miR-122与各指标相关性分析 |
|
|
为探讨肥胖组儿童中各实验室检测指标对miR-122水平的影响,将相关分析中有显著意义的变量作为自变量,以miR-122指标作为因变量进行多元线性回归,结果显示仅IL-6具有统计学意义(P < 0.05),提示miR-122的变化与IL-6有线性回归关系,且呈正相关(b'=0.318),见表 3。
| 表 3 miR-122多元线性回归分析结果 |
|
|
随着经济发展,儿童肥胖发病率不断升高,由肥胖引起的并发症严重危害儿童健康,成为重要的公共卫生课题。肥胖与胰岛素抵抗密切相关,调查显示,美国肥胖青少年胰岛素抵抗的发生率为52.1%,提示肥胖也是青少年发生胰岛素抵抗的重要危险因素[9]。胰岛素抵抗是指胰岛素的效应器官(如肝脏、骨骼肌、脂肪组织等)对正常剂量的胰岛素产生低于正常生物学效应的一种病理生理状态,是导致2型糖尿病的关键原因。
胰岛素抵抗的发病机制尚不清楚,microRNA是一种能起到调控作用的非编码RNA小分子,因在血清及血浆中存在稳定,可以作为良好的生物标志物, 其与胰岛素抵抗的关系逐渐被认识,目前已发现多种microRNA与肥胖的胰岛素抵抗相关,microRNA可能作为病理性肥胖的血清学标志物[5]。
miR-122定位于18q21.31,是肝脏富含的特异性RNA。其能激活固醇调节元件结合蛋白-1c和二脂酰甘油酰基转移酶-2等,参与肝脏脂代谢[10]。肝脏是糖脂代谢的中心,肝脏代谢的早期改变可能引发肥胖、胰岛素抵抗及糖尿病。近年来,miR-122与胰岛素抵抗的关系被认识。本研究中总体分析结果显示miR-122与BMI、WHR、FBG、FINS、HOMA-IR、FFA及IL-6呈正相关,肥胖组儿童中miR-122与FINS、HOMA-IR及IL-6呈正相关。但目前miR-122与胰岛素抵抗的关系仍存争议。一项多达810人的前瞻性研究发现,高miR-122水平与胰岛素抵抗、肥胖、脂代谢异常、2型糖尿病呈正相关[2]。与此研究结果类似,Wang等[3]研究发现miR-122水平在平均年龄为24.02岁青年肥胖患者中升高,与BMI水平及胰岛素抵抗水平呈正相关。而Ortega等[5]研究发现成人中度肥胖患者中miR-122水平升高,而重度肥胖(BMI≥40 kg/m2)患者中miR-122反而下降,对重度肥胖患者进行外科手术减肥后miR-122水平进一步降低,且重度肥胖患者miR-122水平与BMI水平呈负相关。FFA诱导的脂肪变性的肝细胞中及链脲菌素联合高脂饮食诱导的脂肪肝小鼠中miR-122表达下调[11]。本研究结论与Wang等[3]研究结果类似。Wang等[3]研究中123例肥胖患者仅有23例存在糖代谢异常(FBG调节受损及糖耐量异常),其BMI水平为37.73 kg/m2,本研究中肥胖患儿BMI水平为29.7 kg/m2,同时排除了糖尿病及糖代谢异常状态患儿,而Ortega等[5]纳入重度病理性肥胖患者33%存在2型糖尿病,其BMI水平为45.5 kg/m2,提示结论不同可能与BMI水平及糖代谢异常状态有关,有必要进一步收集BMI水平更高肥胖儿童及对比糖代谢异常状态患儿进一步验证miR-122与BMI的相关性。
本研究中发现总体及肥胖人群中miR-122与胰岛素抵抗相关,提示miR-122可能参与胰岛素抵抗,但具体机制未明。有研究表明在肝细胞中miR-122可能通过胰岛素样生长因子1受体调控胰岛素抵抗[12],但其他相关机制尚不明确。炎症与胰岛素抵抗的关系近年来逐渐被论证。炎症主要通过IKKβ和JNK1炎症通路活化与胰岛素抵抗相关,介导其作用的主要转录因子分别为核因子κB(NF-κB)和活化蛋白1 [13]。肝脏炎症在胰岛素抵抗中有重要作用。肝脏选择性过表达IKKβ的小鼠出现肝脏NF-κB激活和全身性胰岛素抵抗,提示肝脏炎症通路活化在全身胰岛素抵抗中有重要作用。研究表明,通过miR-122干扰RNA对PKR活化蛋白靶向瞬态抑制,可抑制促炎因子如IL-1β、IL-6等表达,进一步在人肝脏星状细胞LX-2免疫荧光中显示miR-122可阻滞NF-κB细胞核迁移[6],提示miR-122可能通过阻滞NF-κB细胞核迁移抑制炎症因子如IL-6等的产生。本研究中仅IL-6与miR-122有线性回归关系,且与miR-122呈正相关,推测随IL-6水平升高,机体可能通过某种机制使miR-122水平升高以抑制炎症因子等释放,但此推论需进一步研究证实。
综上所述,肥胖儿童miR-122水平升高,其水平与胰岛素抵抗相关,IL-6与肥胖儿童miR-122有线性回归关系,miR-122在胰岛素抵抗中的作用及机制尚需进一步研究。
| [1] |
Liu JM, Ye R, Li S, et al. Prevalence of overweight/obesity in Chinese children[J]. Arch Med Res, 2007, 38(8): 882-886. DOI:10.1016/j.arcmed.2007.05.006 (  0) 0) |
| [2] |
Willeit P, Skroblin P, Moschen AR, et al. Circulating microRNA-122 is associated with the risk of new-onset metabolic syndrome and type 2 diabetes[J]. Diabetes, 2017, 66(2): 347-357. DOI:10.2337/db16-0731 (  0) 0) |
| [3] |
Wang R, Hong J, Cao Y, et al. Elevated circulating microRNA-122 is associated with obesity and insulin resistance in young adults[J]. Eur J Endocrinol, 2015, 172(3): 291-300. DOI:10.1530/EJE-14-0867 (  0) 0) |
| [4] |
Shah R, Murthy V, Pacold M, et al. Extracellular RNAs are associated with insulin resistance and metabolic phenotypes[J]. Diabetes Care, 2017, 40(4): 546-553. DOI:10.2337/dc16-1354 (  0) 0) |
| [5] |
Ortega FJ, Mercader JM, Catalán V, et al. Targeting the circulating microRNA signature of obesity[J]. Clin Chem, 2013, 59(5): 781-792. DOI:10.1373/clinchem.2012.195776 (  0) 0) |
| [6] |
谷亚楠.单纯性肥胖儿童胰岛素抵抗与IL-6、TNF-α、hs-CRP的关系[D].大连: 大连医科大学, 2017.
(  0) 0) |
| [7] |
Nakamura M, Kanda T, Sasaki R, et al. MicroRNA-122 inhibits the production of inflammatory cytokines by targeting the PKR activator PACT in Human Hepatic Stellate Cells[J]. PLoS One, 2015, 10(12): e0144295. DOI:10.1371/journal.pone.0144295 (  0) 0) |
| [8] |
中华儿科杂志编辑委员会, 中华医学会儿科学分会儿童保健学组. 儿童期单纯性肥胖症防治常规[J]. 中华儿科杂志, 2000, 38(9): 568-570. DOI:10.3760/j.issn:0578-1310.2000.09.012 (  0) 0) |
| [9] |
Lee JM, Okumura MJ, Davis MM, et al. Prevalence and determinants of insulin resistance among U.S. adolescents:a population-based study[J]. Diabetes Care, 2006, 29(11): 2427-2432. DOI:10.2337/dc06-0709 (  0) 0) |
| [10] |
Iliopoulos D, Drosatos K, Hiyama Y, et al. MicroRNA-370 controls the expression of microRNA-122 and Cpt1alpha and affects lipid metabolism[J]. J Lipid Res, 2010, 51(6): 1513-1523. DOI:10.1194/jlr.M004812 (  0) 0) |
| [11] |
Wu GY, Rui C, Chen JQ, et al. MicroRNA-122 inhibits lipid droplet formation and hepatic triglyceride accumulation via Yin Yang 1[J]. Cell Physiol Biochem, 2017, 44(4): 1651-1664. DOI:10.1159/000485765 (  0) 0) |
| [12] |
Dong L, Hou X, Liu F, et al. Regulation of insulin resistance by targeting the insulin-like growth factor 1 receptor with microRNA-122-5p in hepatic cells[J]. Cell Biol Int, 2019, 43(5): 553-564. DOI:10.1002/cbin.11129 (  0) 0) |
| [13] |
Röhl M, Pasparakis M, Baudler S, et al. Conditional disruption of IkappaB kinase 2 fails to prevent obesity-induced insulin resistance[J]. J Clin Invest, 2004, 113(3): 474-481. DOI:10.1172/JCI200418712 (  0) 0) |
 2019, Vol. 21
2019, Vol. 21


