乙型肝炎病毒相关性肾炎(HBV-GN)病变主要位于肾小球毛细血管绊,足细胞病变为其突出表现,足细胞凋亡、增殖功能丧失是导致足细胞减少的主要机制。足细胞足突之间的裂孔隔膜(SD)是维持滤过屏障的完整性和防止尿蛋白产生的关键因素。肾小球足细胞裂孔隔膜相关蛋白(CD2AP)主要定位于SD上,是足细胞胞内重要的接头蛋白;足细胞去氧肾上腺素(nephrin)是SD的主要结构蛋白,对维持细胞形态和稳定滤过屏障起重要作用,突触足蛋白(synaptopodin)可通过A-肌动蛋白与足细胞表达的紧密连结蛋白相互作用,进而与细胞骨架蛋白相连接。瞬时受体电位阳离子通道蛋白(TRPC6)编码基因突变,会导致肾小球滤过屏障紊乱和肌动蛋白细胞骨架重排,导致肾脏疾病的发生。TRPC6在足细胞中主要分布于初级足突和SD处,并且和足细胞SD相关蛋白(CD2AP、nephrin)存在共定位分布且能够相互作用,共同维持SD的正常功能和稳定性[1]。所以足细胞SD相关蛋白和细胞骨架相关蛋白功能的维持对肾脏疾病的治疗至关重要。
乙型肝炎病毒X(HBx)蛋白通过激活STAT3/JAK2信号通路,下调足细胞中nephrin蛋白表达,从而抑制小鼠足细胞增殖,促进其凋亡的发生,足细胞的凋亡在HBV-GN尿蛋白形成中发挥至关重要的作用[2-3]。临床上干扰素α(INF-α)治疗HBV-GN的过程中,我们发现:(1)HBV-GN患儿经干扰素治疗后,体内尿蛋白水平明显下降。(2)HBV-GN初治患儿血清干扰素水平明显低于慢性乙型肝炎无肾损害者。实验研究证实HBx在HBV-GN患者肾组织中分布于肾小管和足细胞,与HBV-DNA在肾组织内的分布区域一致[4],且外源性HBx表达可直接诱导足细胞凋亡[5]。因此我们推测INF-α可能通过下调HBx基因,抑制足细胞凋亡,从而改善HBV-GN尿蛋白水平。本研究利用基因转染技术,从细胞学角度研究HBx转染小鼠足细胞系(MPC5)后,利用INF-α与HBx诱导MPC5共培养,采用流式细胞术检测MPC5的凋亡情况,同时采用Western blot法检测足细胞SD相关蛋白(CD2AP、nephrin、synaptopodin)和细胞骨架相关蛋白(TRPC6)的表达水平,为干扰素治疗HBV-GN提供体外细胞实验依据。
1 材料与方法 1.1 足细胞和质粒小鼠足细胞系(mouse podocyte clone 5, MPC5,美国CHI Scientific公司);pEX-HBx质粒(上海吉玛制药技术有限公司)。
1.2 主要试剂和酶胎牛血清、DMEM培养基(美国Gibco公司);Lipofectamine®LTX & PLUS转染试剂盒(美国Invitrogen公司);MTT试剂盒(美国Biomol公司);4%多聚甲醛(北京索莱宝科技有限公司);胰蛋白酶、NC膜(武汉博士德生物工程有限公司);兔抗小鼠synaptopodin多克隆抗体(美国Santa Cruz公司);兔抗小鼠nephrin、TRPC6多克隆抗体(美国Abcam公司);兔抗小鼠CD2AP多克隆抗体(美国Cell signaling公司)。
1.3 MPC5培养将3份冻存的足细胞复苏后,分别置于含10%胎牛血清的低糖DMEM培养基中,5% CO2、37℃的饱和湿度培养箱内培养,3~4 d待细胞融合至70%左右传代,取对数生长期细胞进行以下实验。
1.4 pEX-HBx质粒转染感受态细胞的制备、限制性内切酶酶切、载体DNA与片段DNA的连接及转化参照文献[6]。实验分为3组,即HBx转染组(脂质体+HBx质粒),阴性对照组(脂质体+空质粒),空白对照组(脂质体)。将MPC5细胞以5×104个/cm2浓度接种于6孔板上,每组3个复孔,待细胞生长融合约为70%时,分别对各组进行不同处理。采用脂质体转染试剂盒开始转染(具体步骤参照说明书),选择转染效率最高的条件进行后续实验。
1.5 逆转录PCR法检测HBx mRNA的表达分别于MPC5细胞转染12、24、48、72 h后用胰酶消化并经PBS洗后收集细胞,采用TRIzol(美国Invitrogen公司)提取细胞的总RNA并逆转录为cDNA。HBx及内参基因ABL引物由上海生工生物工程股份有限公司设计合成(表 1)。逆转录PCR(RT-PCR)反应体系(20 μL):25 ng cDNA 3 μL,0.1 mmol/L dNTP 3 μL,2 mmol/L MgCl2 2 μL,0.5 μmol/L上、下游引物各2 μL,0.5 U Taq DNA聚合酶(美国MBI Fermentas公司)3 μL,ddH2O补足剩余体积。反应条件:95℃预变性10 min;95℃变性15 s,60℃退火60 s,循环40次。扩增产物经1.5%琼脂糖凝胶电泳,结果以目的基因相对于内参基因的比值表示,实验独立重复3次。
| 表 1 RT-PCR引物序列 |
|
|
将MPC5细胞分为4组:对照组:正常条件下培养的MPC5细胞;INF-α组:正常MPC5细胞与INF-α共培养;HBx组:HBx诱导的MPC5细胞;HBx+INF-α组:HBx诱导的MPC5细胞与INF-α共培养。用0.25%胰蛋白酶溶液消化并收集各组足细胞,用预冷的缓冲液冲洗2次,使得细胞的终浓度为1.0×107个/mL。取INF-α加入10%胎牛血清的DMEM完全培养基,37℃、5%CO2培养箱内培养。
1.7 流式细胞术检测细胞凋亡取各组细胞培养48 h,消化后,1 000 r/min离心10 min,弃酶消化液,加入细胞培养液悬浮细胞,收集106个细胞,加入结合缓冲液200 μL重悬细胞,分别加入PI和Annexin-V各5 μL,放在室温条件下反应30 min,用流式细胞仪分别检测各组细胞凋亡情况,实验独立重复3次。
1.8 实时荧光定量PCR法检测mRNA表达水平MPC5细胞总RNA的提取和cDNA的合成按试剂盒说明书操作。nephrin、CD2AP、synaptopodin、TRPC6及内参β-actin序列的引物设计采用Primer 3软件,合成由上海生工生物工程技术服务有限公司完成,各引物序列及片段长度见表 2。实时荧光定量PCR(qRT-PCR)反应体系(25 μL)包括:10×Buffer 2.5 μL,dNTP(10 mmol/L)0.5 μL,MgCl2(25 mmol/L)4.0 μL,上下游引物(10 pmol/μL)各0.5 μL,Taq DNA聚合酶1.0 μL,20×EvaGreen 1.2 μL,50×ROX 0.6 μL,cDNA模板2.0 μL,ddH2O 12.2 μL。反应在ABI7300扩增仪(美国ABI公司)上进行,扩增条件为:94℃预变性4 min;94℃变性30 s,退火见表 2,72℃延伸30 s,收集荧光见表 2,循环40次。以β-actin为内参照,2-ΔΔCt法计算目的基因相对表达水平。实验独立重复3次。
| 表 2 qRT-PCR引物序列及反应条件 |
|
|
各组MPC5细胞用蛋白裂解液处理,按Braford蛋白定量试剂盒说明书操作,测定蛋白含量。SDS-PAGE分离蛋白,电泳后移至硝酸纤维素膜,5%脱脂奶粉-TBST室温封闭90 min,加入第一抗体分别为免抗小鼠nephrin(1 : 200),免抗小鼠CD2AP(1 : 1 000),免抗小鼠synaptopodin(1 : 500),4℃孵育过夜,以FITC标记的山羊抗大鼠IgG为第二抗体(1 : 2 000),37℃孵育2 h,用增强化学发光法使胶片显影,扫描后用QuantityOne系统软件分析,蛋白表达量用灰度值来表示。以β-actin为内参,蛋白相对表达量以目的蛋白/β-actin比值表示。实验独立重复3次。
1.10 统计学分析采用SPSS 20.0统计软件对数据进行统计学分析,计量资料以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验,P < 0.05为差异有统计学意义。
2 结果 2.1 pEX-HBx质粒转染MPC5细胞的鉴定及转染效率的验证分别于pEX-HBx转染MPC5细胞后12、24、48、72 h,RT-PCR法检测各组HBx mRNA表达水平。结果显示,48 h时HBx转染组HBx mRNA表达最高,与12 h、24 h及72 h比较差异有统计学意义(P < 0.05),同时其表达水平较同时期空白对照及阴性对照组显著增加(P < 0.05),而阴性对照组和空白对照组各时间点HBx mRNA表达水平比较差异无统计学意义(P < 0.05),见表 3。
| 表 3 HBx基因在MPC5细胞中的转染效率 (x±s,n=3) |
|
|
流式细胞术检测结果显示:足细胞凋亡率在对照组(4.86%±0.55%)、INF-α组(4.65%±0.43%)、HBx组(10.82%±0.45%)和HBx+INF-α组(4.91%±0.37%)间比较差异有统计学意义(F=8.351,P < 0.01)。其中HBx组足细胞凋亡率明显高于对照组、INF-α组和HBx+INF-α组(P < 0.05),而对照组、INF-α组和HBx+INF-α组足细胞凋亡率比较差异无统计学意义(P > 0.05)。说明HBx可促进足细胞凋亡,但与INF-α共培养后足细胞凋亡明显被抑制。
2.3 INF-α对HBx诱导的足细胞功能蛋白的影响与对照组相比,INF-α组足细胞TRPC6、CD2AP、nephrin和synaptopodin的mRNA及其蛋白表达水平差异均无统计学意义(P > 0.05);与对照组和INF-α组相比,HBx组足细胞CD2AP、nephrin和synaptopodin的mRNA及其蛋白表达水平明显降低,TRPC6 mRNA及其蛋白表达水平明显增高(P < 0.05)。与HBx组相比,HBx+INF-α组足细胞CD2AP、nephrin和synaptopodin的mRNA及其蛋白表达水平明显增高,且高于对照组和INF-α组(P < 0.05);TRPC6 mRNA及其蛋白表达水平明显降低,且低于对照组和INF-α组(P < 0.05)。见表 4,图 1。
| 表 4 各组足细胞TRPC6、CD2AP、nephrin及synaptopodin mRNA及其蛋白相对表达量的比较 (x±s,n=3) |
|
|
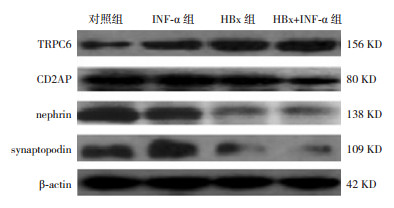
|
图 1 Western blot法检测各组足细胞TRPC6、CD2AP、nephrin及synaptopodin蛋白表达 |
足细胞是维持肾小球滤过膜完整性的主要细胞,目前已有大量研究表明,足细胞的损伤、脱落及功能异常在局灶节段性肾小球硬化、膜性肾等疾病中扮演着重要的角色,因此,维持足细胞结构和功能的完整性,保护足细胞不受损伤,已成为改善蛋白尿的潜在治疗方法[6-7]。足细胞凋亡是足细胞缺失的一种主要方式,足细胞损伤是蛋白尿相关疾病的共同特征,也是导致肾小球硬化和慢性肾脏病发展的重要机制之一[8]。
本研究结果一方面显示:HBx转染足细胞后发现足细胞凋亡率较空白及阴性对照组均显著增加,这说明了HBx可能通过促进足细胞凋亡、抑制其增殖、加速其损伤从而参与蛋白尿的形成。另一方面显示:HBx转染组中nephrin蛋白表达较阴性对照及空白对照组均下降,这说明HBx除了抑制足细胞增殖、促进其凋亡外,还可能通过对nephrin蛋白的调节引起蛋白尿的产生[9-10]。前期研究发现HBV-GN足细胞凋亡可能与HBx能上调STAT3、JAK2表达,从而激活STAT3/JAK2信号通路有关[11-12]。
干扰素是一类具有抗病毒、免疫调节及抗肿瘤作用的细胞因子[13]。临床发现慢性乙型肝炎合并肾损害者较没有肾损害者血清干扰素水平低,儿童HBV-GN给予干扰素治疗后,病毒水平抑制后尿蛋白明显缓解,但干扰素缓解蛋白尿机制仍不十分清楚。因此本研究设计了上述实验,探讨干扰素是否能调节HBx的功能,为HBV-GN的治疗提供新的理论指导。
该研究通过将干扰素与HBx诱导足细胞共培养,发现与干扰素共培养的足细胞生长状态较好,CD2AP、nephrin、synaptopodin的表达水平升高,TRPC6的表达水平下降。Russo等[14]研究发现CD2AP基因敲除小鼠出现蛋白尿,可能与肾小球滤过功能障碍有关,CD2AP主要定位于足细胞SD上,是足细胞胞内重要的接头蛋白,一旦CD2AP受到损伤,细胞骨架的稳定性就会遭到破坏,进而足突融合消失,产生大量的蛋白尿。nephrin是SD的主要结构蛋白,对维持细胞形态和稳定滤过屏障起重要作用。Kim等[15]发现synaptopodin可通过A-肌动蛋白4与足细胞表达的紧密连结蛋白MACI-1相互作用,进而与细胞骨架蛋白相连接,synaplopodin是足细胞分化成熟的经典标志之一。synaptopodin在多种肾脏疾病中表达减少,伴有足细胞的结构和功能变化及蛋白尿的产生[16]。Wilson等[17]研究发现TRPC6的编码基因突变,会导致肾小球滤过屏障紊乱和肌动蛋白细胞骨架重排,导致肾脏疾病的发生。TRPC6在足细胞中主要分布于初级足突和SD处,并且和足细胞SD相关蛋白nephrin、podocin存在共定位分布且能够相互作用,共同维持SD的正常功能。该研究发现,干扰素对足细胞SD相关蛋白及细胞骨架相关蛋白的功能有一定程度的保护作用,从而维持SD的结构稳定和足细胞正常功能,对损伤的足细胞起一定的修复作用,其机制有待进一步研究。
总之,该研究表明干扰素可以改善HBx诱导的足细胞凋亡,通过对CD2AP、nephrin、synaptopodin蛋白的调节,从而维持足细胞SD的完整性及细胞骨架蛋白的稳定性,该研究为干扰素治疗HBV-GN蛋白尿提供实验依据,同时为HBV-GN今后靶向治疗提供思路。
| [1] |
Mundel P, Reiser J. Proteinuria:an enzymatic disease of the podocyte[J]. Kidney Int, 2010, 77(7): 571-580. DOI:10.1038/ki.2009.424 (  0) 0) |
| [2] |
Clippinger AJ, Gearhart TL, Bouchard MJ. Hepatitis B virus X protein modulates apoptosis in primary rat hepatocytes by regulating both NF-kappaB and the mitochondrial permeability transition pore[J]. J Virol, 2009, 83(10): 4718-4731. DOI:10.1128/JVI.02590-08 (  0) 0) |
| [3] |
蒋伟, 罗从娟, 董晖, 等. X基因突变对乙型肝炎病毒相关性肾炎患者尿蛋白及肾脏病理的影响[J]. 国际流行病学传染病学杂志, 2018, 45(2): 85-88. DOI:10.3760/cma.j.issn.1673-4149.2018.02.004 (  0) 0) |
| [4] |
张瑜, 周建华, 王洪涛. 乙型肝炎病毒相关性膜性肾病患儿足细胞缺失的研究[J]. 中华儿科杂志, 2007, 45(5): 344-348. DOI:10.3760/j.issn:0578-1310.2007.05.006 (  0) 0) |
| [5] |
雷晓燕, 孙永红, 陈星星, 等. 乙肝病毒X蛋白抑制小鼠足细胞系MPC5增殖并促进其凋亡[J]. 基础医学与临床, 2019, 39(5): 617-622. DOI:10.3969/j.issn.1001-6325.2019.05.001 (  0) 0) |
| [6] |
Asanuma K. The role of podocyte injury in chronic kidney disease[J]. Nihon Rinsho Meneki Gakkai Kaishi, 2015, 38(1): 26-36. DOI:10.2177/jsci.38.26 (  0) 0) |
| [7] |
朱晓娜, 王玉环, 吴娟娟, 等. VEGF及TRPC6的表达与糖尿病肾病大鼠足细胞损伤的相关机制[J]. 南方医科大学学报, 2018, 38(3): 296-304. DOI:10.3969/j.issn.1673-4254.2018.03.09 (  0) 0) |
| [8] |
Cai B, Cai JP, Luo YL, et al. The specific roles of JAK/STAT signaling pathway in sepsis[J]. Inflammation, 2015, 38(4): 1599-1608. DOI:10.1007/s10753-015-0135-z (  0) 0) |
| [9] |
Zhang Y, Chen Y, Yang F. HBx transfection limits proliferative capacity of podocytes through cell cycle regulation[J]. Acta Biochim Biophys Sin (Shanghai), 2014, 46(12): 1016-1023. DOI:10.1093/abbs/gmu102 (  0) 0) |
| [10] |
蒋伟, 董晖, 马瑞霞, 等. HBx基因在乙型肝炎病毒相关性肾炎致病机制中的研究进展[J]. 中华临床感染杂志, 2014, 7(3): 277-281. (  0) 0) |
| [11] |
Ma Y, Yang Q, Zhong Z, et al. Role of c-Abl and nephrin in podocyte cytoskeletal remodeling induced by angiotensin Ⅱ[J]. Cell Death Dis, 2018, 9(2): 185. DOI:10.1038/s41419-017-0225-y (  0) 0) |
| [12] |
Kato T, Mizuno S, Kamimoto M. The decreases of nephrin and nuclear WTl in podoeytes may callse albuminuria during the experimental sepsis in mice[J]. Biomed Res, 2010, 31(6): 363-369. DOI:10.2220/biomedres.31.363 (  0) 0) |
| [13] |
Lin SM, Lin CJ, Hsu CW, et al. Prospective randomized controlled study of interferon-alpha in preventing hepatocellular carcinoma recurrence after medical ablation therapy for primary tumors[J]. Cancer, 2004, 100(2): 376-382. DOI:10.1002/cncr.20004 (  0) 0) |
| [14] |
Russo LM, Srivatsan S, Seaman M, et al. Albuminuria associated with CD2AP knockout mice is primarily due to dysfunction of the renal degradation pathway processing of filtered albumin[J]. FEBS Lett, 2013, 587(22): 3738-3741. DOI:10.1016/j.febslet.2013.09.045 (  0) 0) |
| [15] |
Kim EY, Suh JM, Chiu YH, et al. Regulation of podocyte BK(Ca) channels by synaptopodin, Rho, and actin microfilaments[J]. Am J Physiol Renal Physiol, 2010, 299(3): F594-F604. DOI:10.1152/ajprenal.00206.2010 (  0) 0) |
| [16] |
Zuo Y, Yang HC, Pothoff SA, et al. Protective effects of PPARγ agonist in acute nephrotic syndrome[J]. Nephrol Dial Transplant, 2012, 27(1): 174-181. DOI:10.1093/ndt/gfr240 (  0) 0) |
| [17] |
Wilson C, Dryer SE. A mutation in TRPC6 channels abolishes their activation by hypoosmotic stretch but does not affect activation by diacylglycerol or G protein signaling cascades[J]. Am J Physiol Renal Physiol, 2014, 306(9): F1018-F1025. DOI:10.1152/ajprenal.00662.2013 (  0) 0) |
 2019, Vol. 21
2019, Vol. 21


