宫内生长受限(intrauterine growth restriction, IUGR)是指基于种族和性别,胎儿未能到达其期望的生长潜能[1]。目前认为,IUGR和许多代谢性疾病有关,包括2型糖尿病、血脂异常和代谢综合征等[2]。前期研究发现IUGR大鼠在成年后更易出现肝脏脂肪堆积,这和IUGR大鼠脂肪酸代谢途径中相关基因的调节紊乱有关[3]。近年来,绿茶中所含的表没食子儿茶素-3-没食子酸酯(epigallocatechin-3-gallate, EGCG)对非酒精性脂肪肝(non-alcoholic fatty liver, NAFLD)的改善作用被广泛地研究[4]。然而,EGCG是否能够防治IUGR子代肝脏脂肪变性的发生,这还并不清楚。脂肪酸的从头合成和β氧化通路异常是NAFLD发病机制中的重要环节之一。Srebf1是脂肪酸从头合成调节通路中的关键基因,受多个上游基因的调控,包括Ampk、Pparg、Irs、Adipor等,这些基因和能量代谢及胰岛素抵抗密切相关;而Cpt1a是脂肪酸β氧化的关键基因,受到Ppara、Ppargc1a等的调节,对肝脏脂肪酸的代谢起到重要的调节作用[5-6]。当前研究探索EGCG对IUGR子代肝脏脂代谢的影响,并在转录水平上了解脂肪酸合成和氧化相关基因的表达变化,以期为IUGR导致的脂代谢紊乱的防治提供指导。
1 材料与方法 1.1 动物模型的建立本研究采用孕期全程限食法(进食量为正常孕鼠前1日进食量的50%)建立IUGR大鼠模型。该模型是IUGR的经典动物模型之一,操作简便,成功率高,许多代谢相关性研究均采用该模型[7-8]。选取未曾交配的雄性和雌性Sprague-Dawley(SD)大鼠,体重250~300 g,经过1周的适应性喂养,以雌雄2 : 1的比例进行交配,妊娠第0天定义为阴道涂片中出现精子当天。雌鼠怀孕后,随机分为正常组(n=8)和限食组(n=8)。仔鼠出生后,所有母鼠均不限制饮食,且新生仔鼠由其母鼠喂养。为避免哺乳条件不同造成的差异,生后将每笼子鼠数量调整为8只。
考虑到性别和性激素对脂代谢的影响,本研究只采用雄性仔鼠进行后续实验。离乳后,正常组从每只母鼠分娩的仔鼠中随机取1只雄性仔鼠作为对照组(n=8);限食组从每只母鼠分娩的仔鼠中随机取2只雄性子鼠,再随机分配到IUGR组(n=8,正常饮水)和EGCG组(n=8,生后第21天起,给予含0.25 mg/mL EGCG的水饮用,直至第10周,之后改为正常饮水),以减少组间母体和遗传因素影响。在生后第13周,经过12 h禁食,用血糖仪测量大鼠尾静脉血糖值后,腹腔内注射10%水合氯醛麻醉,采集血液和肝脏标本。
1.2 测量体重和饮水量出生时和出生后每周于清晨测量1次大鼠体重。断奶后,于每日清晨供给新鲜的饮水,并于次日晨丢弃剩余饮水。饮水量每周测定1次,定义为(供给水量-剩余水量)×100/体重,即为每日每100 g体重的饮水量。
1.3 血清和肝脏相关指标测定将采集的血液标本离心后收集上清,然后使用总胆固醇(total cholesterol, TC)、甘油三酯(triglycerides, TG)、胰岛素、游离脂肪酸(free fatty acid, FFA)诊断试剂盒来测定样本的指标水平。使用公式计算稳态模型评估胰岛素抵抗(homeostasis model assessment of insulin resistance, HOMA-IR)和脂肪组织胰岛素抵抗(adipose tissue insulin resistance, adipo-IR),即HOMA-IR=空腹血糖(fasting plasma glucose, FPG)×空腹胰岛素(fasting insulin, FINS)/22.5,adipo-IR= FFA×FINS。根据试剂盒说明书,测定肝脏TG和TC的含量。对肝脏组织冰冻切片行油红染色后,显微镜下观察肝细胞脂肪变性情况。
1.4 实时荧光定量PCR提取肝脏组织的总RNA,使用超微量分光光度计测定其浓度和纯度。经鉴定合格后,取1 µg的总RNA样本,经逆转录得到单链cDNA。使用Primer Premier 6和Oligo 7进行引物设计并验证,实验中采用的引物序列和产物长度列于表 1。采用管家基因β-actin作为内参基因。PCR反应体系:2×SYBR Green Master Mix 5 µL,上、下游引物各0.2 µL,cDNA模板0.5 µL,RNA-free水4.1 µL。混匀后3 000 r/min离心2 min,置于实时荧光定量PCR系统上进行扩增反应,反应条件:50℃激活2 min,95℃激活2 min;95℃变性15 s,60℃退火15 s,72℃延伸1 min,循环40次。分析目的基因相对表达量时,使用2-ΔΔCt法进行数据分析。
| 表 1 引物序列和产物长度 |
|
|
采用SPSS 22.0统计软件对数据进行统计学分析。符合正态分布计量资料以均数±标准差(x±s)表示,两组间均数比较采用两独立样本t检验;多组间均数比较采用方差分析,组间两两比较采用SNK-q法。不符合正态分布计量资料以中位数(四分位间距)[M(P25, P75)]表示,多组间比较采用Kruskal-Wallis H检验,组间两两比较采用Dunn法。P < 0.05为差异有统计学意义。
2 结果 2.1 各组大鼠一般情况出生时,正常大鼠的体重为6.7±0.6 g,IUGR大鼠为5.8±0.6 g,两者出生体重比较差异有统计学意义(t=10.206,P < 0.001)。出生后,各组大鼠的生长曲线见图 1。生后第13周,对照组大鼠体重为385±22 g,IUGR组大鼠为359±21 g,EGCG组大鼠为367±21 g,各组间的体重比较差异无统计学意义(F=3.085,P=0.067)。此外,方差分析结果显示,各个时间点三组间饮水量的比较差异均无统计学意义(P > 0.05)。
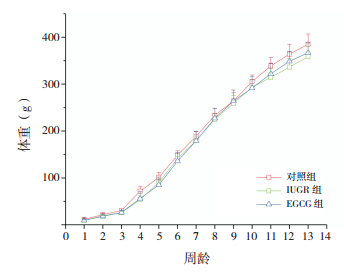
|
图 1 各组大鼠生后1~13周的生长曲线 |
三组大鼠的FPG水平比较差异有统计学意义(P < 0.05),IUGR组大鼠的FPG水平较对照组升高,且离乳后EGCG干预能够降低IUGR大鼠的FPG至正常水平(P > 0.05)。三组之间的血清TG、TC水平比较差异无统计学意义(P > 0.05);但是肝脏组织的TG和TC水平比较差异有统计学意义(P < 0.05),与对照组大鼠比较,IUGR组的肝脏TG和TC水平有升高,但差异未达到统计学意义(P > 0.05),与IUGR组大鼠比较,EGCG组的肝脏TG和TC水平明显下降(P < 0.05),且与对照组比较差异无统计学意义(P > 0.05)。三组之间FFA、FINS、HOMA-IR和adipo-IR水平比较差异有统计学意义(P < 0.001)。与对照组相比,IUGR组大鼠FFA、FINS及adipo-IR水平明显升高,EGCG能降低其水平,但仍高于对照组(P < 0.05)。IUGR组大鼠HOMA-IR水平高于对照组,EGCG组的HOMA-IR水平低于IUGR组(P < 0.05),且与对照组比较差异无统计学意义(P > 0.05)。见表 2。油红染色结果显示,与对照组大鼠相比,IUGR大鼠的肝脏呈现明显的脂肪变性,而EGCG能够减少肝细胞的脂肪储积,见图 2。
| 表 2 各组血清生化指标和肝脏脂质水平比较 |
|
|

|
图 2 各组大鼠在生后13周时的肝脏组织病理切片(油红染色) 与对照组大鼠相比,IUGR组大鼠的肝细胞出现明显的脂肪变性(低倍镜下示肝组织油红染色面积增大,高倍镜下示肝细胞内染色脂滴体积增大),而经EGCG干预后的IUGR大鼠肝脏脂肪颗粒体积和数量均有减少。 |
三组之间Ampk、Adipor1、Irs2和Srebf1的mRNA表达水平比较差异有统计学意义(P < 0.05)。与对照组相比,IUGR组的Ampk mRNA及Adipor1 mRNA水平均降低,Srebf1 mRNA水平增加(P < 0.05);EGCG组与对照组比较,Ampk mRNA及Srebf1 mRNA水平差异均无统计学意义(P > 0.05);EGCG组与IUGR组比较,Adipor1 mRNA水平差异无统计学意义(P > 0.05)。与对照组比较,IUGR组大鼠的Irs2 mRNA水平虽然没有降低(P > 0.05),但是EGCG能提高其表达水平(P < 0.05)。脂肪酸氧化相关基因(Ppara、Ppargc1a和Cpt1a)的mRNA水平,以及Adipor2、Pparg、Irs1和Nr1h3的mRNA水平在各组间比较差异均无统计学意义(P > 0.05)。见表 3。
| 表 3 各组肝脏相关基因的mRNA水平比较 |
|
|
本研究的主要发现是EGCG能够改善IUGR诱导的肝脏脂肪储积,这可能是由于EGCG可导致肝脏细胞的Ampk mRNA表达增加,从而抑制Srebf1 mRNA的表达,减少肝脏脂肪酸的从头合成。此外,本研究还发现,EGCG能够显著改善IUGR大鼠的胰岛素抵抗。
临床研究发现,虽然IUGR子代出生时表现为体重降低,但是大部分会在生后早期出现追赶生长[9]。这和本研究结果相似,虽然出生时IUGR大鼠体重明显降低,但至生后13周时,其和正常大鼠的体重比较差异已无统计学意义,表明有出现追赶生长。但是,IUGR大鼠在成年早期就已经出现了肝脏的脂质代谢紊乱,包括TG和TC的水平升高,且病理学检查也发现肝细胞出现了脂肪的积累。这个和Niu等[10]的研究结果类似,他们在IUGR大鼠的肝脏组织也发现了TG水平的升高,进一步的PCR结果显示IUGR的Ampk mRNA水平降低而Srebf1 mRNA水平升高。AMPK在脂代谢中发挥着重要的作用,AMPK的激活能够降低脂肪酸的从头合成、增加脂肪酸氧化及改善胰岛素抵抗[11]。AMPK作为多个代谢路径的重要调节因子,是代谢相关性疾病的重要治疗靶点之一[12]。IUGR大鼠的Ampk mRNA表达降低,继而减少对Srebf1 mRNA的抑制,增加肝脏的脂肪酸从头合成,导致脂肪在肝脏的堆积。
本研究发现,离乳后的EGCG干预能够改善肝脏的脂肪堆积。目前认为,EGCG的作用机制之一是通过激活AMPK而引起下游一系列改善脂代谢的效应[13]。与此相应,我们也发现离乳后EGCG摄入能够增加IUGR大鼠的Ampk mRNA水平。Li等[14]对高脂饮食喂养的小鼠研究发现,在皮下和附睾脂肪组织,EGCG喂养的小鼠AMPK活性明显增加。Srebf1是脂肪酸合成路径中的重要调控基因,能够增加脂肪酸合成酶等相关基因表达,增加肝脏细胞的脂肪酸从头合成[15-16]。EGCG干预的IUGR大鼠Srebf1 mRNA水平降低,可能是通过EGCG增加Ampk mRNA表达介导的。
胰岛素抵抗是非酒精性脂肪肝病的关键环节之一。IUGR子代的空腹FFA和胰岛素水平明显升高,且反映胰岛素抵抗水平的两个指标HOMA-IR和adipo-IR也均升高,提示IUGR大鼠存在明显的胰岛素抵抗。蛋白组学的研究发现,肝脏中代谢相关的关键激素和酶的改变可能是IUGR猪在成年后更容易发生胰岛素抵抗的原因[17]。本研究发现IUGR大鼠肝脏的Adipor1 mRNA表达较对照组降低近一半,这可能会导致肝脏对脂联素的反应性降低,从而降低胰岛素敏感度,遗憾的是,EGCG并不能上调Adipor1 mRNA的表达。虽然如此,本研究还是发现离乳后的EGCG干预能够改善胰岛素抵抗相关指标,这可能和EGCG上调Irs2 mRNA的表达有关系。
综上所述,本研究发现早期EGCG干预可能通过Ampk/Srebf1通路下调脂肪酸的从头合成,并通过改善肝细胞的胰岛素抵抗,从而降低IUGR大鼠的肝脏脂肪积累。
| [1] |
Kesavan K, Devaskar SU. Intrauterine growth restriction:postnatal monitoring and outcomes[J]. Pediatr Clin North Am, 2019, 66(2): 403-423. DOI:10.1016/j.pcl.2018.12.009 (  0) 0) |
| [2] |
Mierzynski R, Dluski D, Darmochwal-Kolarz D, et al. Intra-uterine growth retardation as a risk factor of postnatal metabolic disorders[J]. Curr Pharm Biotechnol, 2016, 17(7): 587-596. DOI:10.2174/1389201017666160301104323 (  0) 0) |
| [3] |
陈联辉, 梁黎, 朱伟芬, 等. 宫内生长迟缓和高脂饮食对大鼠血脂及肝脏相关基因转录水平的影响[J]. 中国当代儿科杂志, 2015, 17(10): 1124-1130. DOI:10.7499/j.issn.1008-8830.2015.10.021 (  0) 0) |
| [4] |
Chen C, Liu Q, Liu L, et al. Potential biological effects of (-)-epigallocatechin-3-gallate on the treatment of nonalcoholic fatty liver disease[J]. Mol Nutr Food Res, 2018, 62(1). DOI:10.1002/mnfr.201700483.Epub2017Oct12 (  0) 0) |
| [5] |
Shimano H, Sato R. SREBP-regulated lipid metabolism:convergent physiology-divergent pathophysiology[J]. Nat Rev Endocrinol, 2017, 13(12): 710-730. DOI:10.1038/nrendo.2017.91 (  0) 0) |
| [6] |
Enjoji M, Yasutake K, Kohjima M, et al. Nutrition and nonalcoholic fatty liver disease:the significance of cholesterol[J]. Int J Hepatol, 2012, 2012: 925807. (  0) 0) |
| [7] |
Garofano A, Czernichow P, Bréant B. In utero undernutrition impairs rat beta-cell development[J]. Diabetologia, 1997, 40(10): 1231-1234. DOI:10.1007/s001250050812 (  0) 0) |
| [8] |
Schwitzgebel VM, Somm E, Klee P. Modeling intrauterine growth retardation in rodents:impact on pancreas development and glucose homeostasis[J]. Mol Cell Endocrinol, 2009, 304(1-2): 78-83. DOI:10.1016/j.mce.2009.02.019 (  0) 0) |
| [9] |
Kayemba-Kay's S, Maillet O, Hindmarsh P, et al. Growth screening in children aged 3-5 years:a useful tool for public health programs in community pediatrics[J]. J Pediatr Endocrinol Metab, 2019, 32(7): 727-732. DOI:10.1515/jpem-2018-0545 (  0) 0) |
| [10] |
Niu Y, He J, Ahmad H, et al. Curcumin attenuates insulin resistance and hepatic lipid accumulation in a rat model of intrauterine growth restriction through insulin signaling pathway and sterol regulatory element binding proteins[J]. Br J Nutr, 2019, 122(6): 616-624. DOI:10.1017/S0007114519001508 (  0) 0) |
| [11] |
Smith BK, Steinberg GR. AMP-activated protein kinase, fatty acid metabolism, and insulin sensitivity[J]. Curr Opin Clin Nutr Metab Care, 2017, 20(4): 248-253. DOI:10.1097/MCO.0000000000000380 (  0) 0) |
| [12] |
Day EA, Ford RJ, Steinberg GR. AMPK as a therapeutic target for treating metabolic diseases[J]. Trends Endocrinol Metab, 2017, 28(8): 545-560. DOI:10.1016/j.tem.2017.05.004 (  0) 0) |
| [13] |
Yang CS, Zhang J, Zhang L, et al. Mechanisms of body weight reduction and metabolic syndrome alleviation by tea[J]. Mol Nutr Food Res, 2016, 60(1): 160-174. DOI:10.1002/mnfr.201500428 (  0) 0) |
| [14] |
Li F, Gao C, Yan P, et al. EGCG reduces obesity and white adipose tissue gain partly through AMPK activation in mice[J]. Front Pharmacol, 2018, 9: 1366. DOI:10.3389/fphar.2018.01366 (  0) 0) |
| [15] |
Song Z, Xiaoli AM, Yang F. Regulation and metabolic significance of de novo lipogenesis in adipose tissues[J]. Nutrients, 2018, 10(10): pii:E1383. DOI:10.3390/nu10101383 (  0) 0) |
| [16] |
Moslehi A, Hamidi-zad Z. Role of SREBPs in liver diseases:amini-review[J]. J Clin Transl Hepatol, 2018, 6(3): 1-7. (  0) 0) |
| [17] |
Ferenc K, Pietrzak P, Wierzbicka M, et al. Alterations in the liver of intrauterine growth retarded piglets may predispose to development of insulin resistance and obesity in later life[J]. J Physiol Pharmacol, 2018, 69(2): 211-218. (  0) 0) |
 2020, Vol. 22
2020, Vol. 22


