2. 郑州大学第三附属医院影像科, 河南 郑州 450052
当前我国二孩政策全面开放,高龄孕产妇增多,早产的发生率逐渐升高,随着新生儿重症救护技术的发展,早产儿和极低出生体重儿的存活率明显提高[1],但存活者易出现各种并发症。支气管肺发育不良(bronchopulmonary dysplasia, BPD)是早产儿常见的慢性呼吸系统疾病,胎龄22~28周早产儿BPD的发生率可达68%[2],出生体重 < 1 250 g的早产儿BPD发生率可达97%[3],该病不仅增加了早产儿再入院次数,并且有研究显示BPD患儿更容易发生神经系统发育障碍[4-5],往往导致早产儿死亡、脑瘫、认知及运动发育迟缓等,对家庭和社会造成严重的经济负担。因此,对BPD早产儿神经系统发育的研究具有重要临床意义。目前临床上常用头颅多普勒彩超、CT、MRI常规序列、振幅整合脑电图等技术辅助诊断早产儿脑损伤[6-7]。但应用这些技术仅能检测到脑内宏观结构的病变,对定量评价脑白质结构损伤有一定的局限性。而磁共振弥散张量成像(diffuse tensor imaging, DTI)是在MRI扩散加权成像基础上发展而来的,反映分子扩散特性的影像学技术,常用参数各项异性分数(fractional anisotropy, FA)和表观弥散系数(apparent diffusion coefficient, ADC)可反映早产儿大脑结构与神经发育结局之间的关系,定量测量脑发育的异常。随着脑白质发育的成熟,FA值逐渐增加,而ADC值逐渐下降[8]。本研究旨在应用DTI的FA值和ADC值评价BPD早产儿生后早期(住院期间)的脑白质发育情况,以期对BPD早产儿的神经系统发育进行量化评估。
1 资料与方法 1.1 研究对象以2016年8月至2019年4月生后24 h内入住郑州大学第三附属医院NICU的、出生胎龄≤32周、出生体重 < 1 500 g,且出院前完成头颅MRI及DTI检查的96例早产儿为研究对象。根据出院诊断分为BPD组(n=48)和非BPD组(n=48)。BPD诊断标准为:生后超过28 d仍存在氧依赖(吸入氧浓度 > 21%)[9]。排除标准:(1)生后首次头颅超声发现存在Ⅱ级以上的脑室内出血者;(2)先天性颅脑畸形者;(3)围生期有重度窒息者;(4)患染色体病、先天遗传代谢性疾病者。
1.2 资料收集收集以下资料:(1)早产儿基本情况:性别、出生胎龄、出生体重、出生方式、头颅MRI检查时纠正胎龄、Apgar评分、肺表面活性物质(pulmonary surfactant, PS)及咖啡因应用和辅助通气时间(机械通气及持续气道正压通气);(2)母亲妊娠情况:妊娠合并症(胎膜早破、妊娠期高血压、妊娠期糖尿病)、羊水及胎盘情况等;(3)早产儿并发症情况:呼吸暂停(apnea of prematurity, AOP)、BPD、新生儿坏死性小肠结肠炎(neonatal necrotizing enterocolitis, NEC)、早产儿视网膜病(retinopathy of prematurity, ROP)、肺炎、败血症、新生儿胆汁淤积症;(4)MRI常规序列发现的脑室周围-脑室内出血(periventricular-intraventricular hemorrhage, PV-IVH)、局灶性脑白质损伤(punctate white matter lesions, PWML)、囊性脑室周围白质软化(periventricular leukomalacia, PVL)等。
AOP定义为呼吸停止≥20 s,或停止时间 < 20 s,伴有血氧饱和度下降(< 85%)或心动过缓(< 100次/min)[10]。败血症定义为血液或者脑脊液等无菌腔隙能培养出致病菌(包括细菌和真菌)引起的全身炎症反应综合征[11]。肺炎、NEC、ROP、新生儿胆汁淤积综合征诊断标准参考第5版《实用新生儿学》[12]。
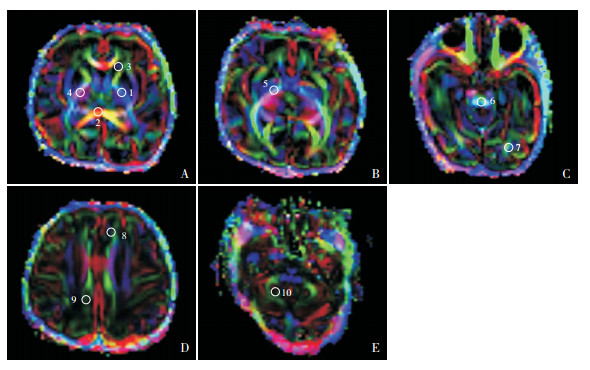
1.3 头颅MRI检查及DTI图像处理分析两组早产儿于纠正胎龄34~36周完成头颅MRI及DTI检查。患儿镇静(静脉注射苯巴比妥钠5 mg/kg)熟睡后,应用Siemens Skyra 3.0 T超导MRI扫描仪,采用Head 20线圈进行检查。行常规矢状位T1WI扫描和轴位T1WI、T2WI、FLAIR、DWI、DTI扫描。扫描结束后,图像资料自动导入Siemens syngo.via后处理站,得到FA图。在FA图上确定感兴趣区(region of interest, ROI)位置,每个ROI大小控制在(10±2)mm2,所有ROI均位于解剖部位中间(图 1),并尽量避开脑白质或灰质损伤区域,分别测量每个ROI的FA值和ADC值3次,并计算平均值。
|
图 1 FA图ROI的选取 A~E为FA彩色编码图。各数字代表相应部位的ROI:1.内囊后肢;2.胼胝体压部;3.尾状核;4.丘脑;5.豆状核;6.大脑脚;7.枕叶白质;8.额叶白质;9.顶叶白质;10.小脑。 |
PVL定义为存在脑白质减少、脑室扩张或变形,或脑室周围白质T2WI信号异常增高,T1WI信号异常降低[13]。PWML定义为半卵圆中心、侧脑室周围脑白质出现点、线或簇状T1WI高信号、T2WI低或等信号病灶[14]。PV-IVH定义为脑室周围/脑室内区域的T1WI信号强度增加,而T2WI信号强度降低[15-16],并根据Papile等[17]文献分为Ⅰ~Ⅳ级。
1.5 统计学分析应用SPSS 21.0软件分析数据。正态分布的计量资料用均数±标准差(x±s)表示,组间比较采用两样本t检验;非正态分布的计量资料用中位数(四分位数间距)[M(P25,P75)]表示,组间比较用Mann-Whitney U检验。计数资料用例数和百分率(%)表示,组间比较应用χ2检验或校正χ2检验。P < 0.05为差异有统计学意义。
2 结果 2.1 两组早产儿基本情况BPD组与非BPD组早产儿在出生胎龄、出生体重、性别、出生方式、PS应用情况、Apgar评分、头颅MRI检查时纠正胎龄、咖啡因应用、孕母妊娠期高血压、孕母妊娠期糖尿病、胎膜早破、先兆早产、胎盘异常、羊水异常、多胎妊娠、产前应用激素方面比较差异均无统计学意义(P > 0.05)。BPD组机械通气比例及辅助通气时间均高于非BPD组(P < 0.05)。见表 1。
| 表 1 两组早产儿基本情况比较 |
|
|
与非BPD组相比,BPD组早产儿肺炎发生率更高、AOP次数更多(P < 0.05);两组早产儿NEC、ROP、败血症、新生儿胆汁淤积综合征发生率差异无统计学意义(P > 0.05)。见表 2。
| 表 2 两组早产儿并发症比较 |
|
|
两组早产儿PV-IVH、PWML、PVL发生率及脑损伤总发生率差异均无统计学意义(P < 0.05),见表 3。
| 表 3 两组早产儿脑损伤情况比较 |
|
|
10个ROI中,BPD组内囊后肢、胼胝体压部、枕叶白质、小脑、大脑脚的FA值低于非BPD组,各ADC值高于非BPD对照组,差异均有统计学意义(P < 0.05),见表 4~5。
| 表 4 两组早产儿各ROI的FA值比较 |
|
|
| 表 5 两组早产儿各ROI的ADC值比较 |
|
|
BPD是早产儿最常见的一种慢性炎症性肺部疾病,常存在肺泡形态异常、数量减少、分布不均,以及异常发育的肺血管系统。BPD患儿预后较差,对感染因素易感性增加、再入院率较高且常伴有肺功能异常。另外,有研究表明BPD与脑白质损伤具有相关性[18],BPD患儿更容易发生运动、认知和智力障碍等神经缺陷[19]。
头颅MRI是评价新生儿神经系统发育的重要手段,与MRI常规序列相比,DTI对于微小病灶及白质纤维束病变的检查更灵敏,可以评价水分子扩散的方向性及扩散程度,从而能够定量反映脑白质发育情况。DTI各种参数中部分FA值及ADC值比较敏感并且容易观察[20]。FA值随着出生胎龄增加、白质髓鞘化成熟而逐渐增大。ADC值与脑白质的水分子含量、轴突密度、发育程度相关;随着脑组织发育逐渐成熟,脑白质水分含量减少,且树突、胶质细胞髓鞘化使水分子运动进一步受限,ADC值逐渐下降[21]。
本研究两组早产儿头颅MRI常规序列发现的PV-IVH、PVL、PWML等脑损伤的发生率差异无统计学意义,而BPD组内囊后肢、胼胝体压部、枕叶白质、小脑、大脑脚FA值低于非BPD组,各ADC值高于非BPD组。这表明BPD组早产儿脑白质髓鞘化发育程度较低。Lee等[22]发现与非BPD组相比,BPD组早产儿脑容量和白质的FA值均较低,说明BPD早产儿脑发育落后,这与本研究的结果一致。Boardman等[23]通过分析早产儿头颅MRI结果发现生后长期氧依赖是阻碍早产儿脑生长发育的危险因素。Thompson等[24]应用头颅MRI研究了202例早产儿和36例足月儿,发现在矫正胎龄足月时患BPD的早产儿全脑容量减少。Anjari等[25]对53名在头颅常规MRI上没有局灶异常的早产儿进行了研究,控制混杂因素后发现慢性肺疾病早产儿脑白质的FA值降低,提示慢性肺疾病和脑白质损伤存在相关性。
BPD是多种因素共同作用的结果,各种产前和产后因素均可导致疾病的发生发展,其中以气压伤、感染、高氧最常见,可诱发炎症因子及自由基释放,激活肺部细胞凋亡途径,影响肺发育。而参与脑白质髓鞘化发育的少突胶质细胞前体细胞极易受炎症反应、自由基和缺氧缺血的影响而凋亡,导致髓鞘形成障碍。因此,BPD和脑损伤具有共同的发病机制,这可能是BPD患儿脑白质发育延迟的机制之一。另外,BPD患儿易合并感染、新生儿呼吸窘迫综合征、呼吸暂停等并发症,相应的容易发生低氧血症或酸中毒,加重脑白质损伤[26]。本研究发现BPD组早产儿AOP次数更多、肺炎发生率和机械通气比例更高、辅助通气时间更长,这些均可能是导致BPD脑白质损伤的因素[27]。
本研究具有一定局限性。首先,我们并未测量DTI的径向或轴向扩散系数等,这些参数也是反映脑白质发育的重要指标。其次,我们并没有对患有BPD的早产儿进行随访,因此,BPD患儿的长期神经系统结局仍有待进一步研究揭示。
综上所述,通过测定分析FA值和ADC值可得出BPD患儿更容易发生脑白质发育障碍,可能与导致BPD的炎症反应或BPD引起的低氧血症等因素有关。因此,我们在积极预防和治疗BPD的同时,还需要对患儿进行早期神经发育评估,必要时早期干预。
| [1] |
Stoll BJ, Hansen NI, Bell EF, et al. Trends in care practices, morbidity, and mortality of extremely preterm neonates, 1993-2012[J]. JAMA, 2015, 314(10): 1039-1051. DOI:10.1001/jama.2015.10244 (  0) 0) |
| [2] |
Guaman MC, Gien J, Baker CD, et al. Point prevalence, clinical characteristics, and treatment variation for infants with severe bronchopulmonary dysplasia[J]. Am J Perinatol, 2015, 32(10): 960-967. DOI:10.1055/s-0035-1547326 (  0) 0) |
| [3] |
Viscardi RM. Perinatal inflammation and lung injury[J]. Semin Fetal Neonatal Med, 2012, 17(1): 30-35. DOI:10.1016/j.siny.2011.08.002 (  0) 0) |
| [4] |
Trittmann JK, Nelin LD, Klebanoff MA. Bronchopulmonary dysplasia and neurodevelopmental outcome in extremely preterm neonates[J]. Eur J Pediatr, 2013, 172(9): 1173-1180. DOI:10.1007/s00431-013-2016-5 (  0) 0) |
| [5] |
Lin F, Dong H, Song Y, et al. Effect of bronchopulmonary dysplasia on early intellectual development in preterm infants[J]. Pediatr Int, 2017, 59(6): 691-697. DOI:10.1111/ped.13257 (  0) 0) |
| [6] |
林颖仪, 黄水清. 早产儿脑损伤影像学及脑电图诊断的研究进展[J]. 临床儿科杂志, 2017, 35(7): 548-552. (  0) 0) |
| [7] |
张浩然, 黄海云. 早产儿脑损伤的早期评估研究进展[J]. 国际儿科学杂志, 2018, 45(1): 28-31. (  0) 0) |
| [8] |
Schneider J, Kober T, Bickle Graz M, et al. Evolution of T1 relaxation, ADC, and fractional anisotropy during early brain maturation:a serial imaging study on preterm infants[J]. AJNR Am J Neuroradiol, 2016, 37(1): 155-162. DOI:10.3174/ajnr.A4510 (  0) 0) |
| [9] |
Jensen EA, Dysart K, Gantz MG, et al. The diagnosis of bronchopulmonary dysplasia in very preterm infants. an evidence-based approach[J]. Am J Respir Crit Care Med, 2019, 200(6): 751-759. DOI:10.1164/rccm.201812-2348OC (  0) 0) |
| [10] |
Zulqarnain A, Hussain M, Suleri KM, et al. Comparison of caffeine versus theophylline for apnea of prematurity[J]. Pak J Med Sci, 2019, 35(1): 113-116. (  0) 0) |
| [11] |
中华医学会儿科学分会新生儿学组, 中国医师协会新生儿科医师分会感染专业委员会. 新生儿败血症诊断及治疗专家共识(2019年版)[J]. 中华儿科杂志, 2019, 57(4): 252-257. (  0) 0) |
| [12] |
邵肖梅, 叶鸿瑁, 丘小汕.实用新生儿学[M].第5版.北京: 人民卫生出版社, 2019: 368-370, 582-588, 632-639, 1025-1029.
(  0) 0) |
| [13] |
王飞, 刘亚辉, 黄婷婷. PVL脑瘫患儿MRI分级与粗大运动功能分级的相关性分析[J]. 医学影像学杂志, 2019, 29(5): 721-725. (  0) 0) |
| [14] |
Wagenaar N, Chau V, Groenendaal F, et al. Clinical risk factors for punctate white matter lesions on early magnetic resonance imaging in preterm newborns[J]. J Pediatr, 2017, 182: 34-40.e1. DOI:10.1016/j.jpeds.2016.11.073 (  0) 0) |
| [15] |
Sie LT, van der Knaap MS, van Wezel-Meijler G, et al. Early MR features of hypoxic-ischemic brain injury in neonates with periventricular densities on sonograms[J]. AJNR Am J Neuroradiol, 2000, 21(5): 852-861. (  0) 0) |
| [16] |
Keeney SE, Adcock EW, Mcardle CB. Prospective observations of 100 high-risk neonates by high-field (1.5 Tesla) magnetic resonance imaging of the central nervous system:I. Intraventricular and extracerebral lesions[J]. Pediatrics, 1991, 87(4): 421-430. (  0) 0) |
| [17] |
Papile LA, Burstein J, Burstein R, et al. Incidence and evolution of subependymal and intraventricular hemorrhage:a study of infants with birth weights less than 1, 500 gm[J]. J Pediatr, 1978, 92(4): 529-534. DOI:10.1016/S0022-3476(78)80282-0 (  0) 0) |
| [18] |
Gagliardi L, Bellù R, Zanini R, et al. Bronchopulmonary dysplasia and brain white matter damage in the preterm infant:a complex relationship[J]. Paediatr Perinat Epidemiol, 2009, 23(6): 582-590. DOI:10.1111/j.1365-3016.2009.01069.x (  0) 0) |
| [19] |
Natarajan G, Pappas A, Shankaran S, et al. Outcomes of extremely low birth weight infants with bronchopulmonary dysplasia:impact of the physiologic definition[J]. Early Hum Dev, 2012, 88(7): 509-515. DOI:10.1016/j.earlhumdev.2011.12.013 (  0) 0) |
| [20] |
van Pul C, Buijs J, Janssen MJ, et al. Selecting the best index for following the temporal evolution of apparent diffusion coefficient and diffusion anisotropy after hypoxic-ischemic white matter injury in neonates[J]. AJNR Am J Neuroradiol, 2005, 26(3): 469-481. (  0) 0) |
| [21] |
Pieterman K, Plaisier A, Govaert P, et al. Data quality in diffusion tensor imaging studies of the preterm brain:a systematic review[J]. Pediatr Radiol, 2015, 45(9): 1372-1381. DOI:10.1007/s00247-015-3307-y (  0) 0) |
| [22] |
Lee JM, Choi YH, Hong J, et al. Bronchopulmonary dysplasia is associated with altered brain volumes and white matter microstructure in preterm infants[J]. Neonatology, 2019, 116(2): 163-170. DOI:10.1159/000499487 (  0) 0) |
| [23] |
Boardman JP, Counsell SJ, Rueckert D, et al. Early growth in brain volume is preserved in the majority of preterm infants[J]. Ann Neurol, 2007, 62(2): 185-192. DOI:10.1002/ana.21171 (  0) 0) |
| [24] |
Thompson DK, Warfield SK, Carlin JB, et al. Perinatal risk factors altering regional brain structure in the preterm infant[J]. Brain, 2007, 130(Pt 3): 667-677. (  0) 0) |
| [25] |
Anjari M, Counsell SJ, Srinivasan L, et al. The association of lung disease with cerebral white matter abnormalities in preterm infants[J]. Pediatrics, 2009, 124(1): 268-276. DOI:10.1542/peds.2008-1294 (  0) 0) |
| [26] |
Durand M, Mcevoy C, Macdonald K. Spontaneous desaturations in intubated very low birth weight infants with acute and chronic lung disease[J]. Pediatr Pulmonol, 1992, 13(3): 136-142. DOI:10.1002/ppul.1950130303 (  0) 0) |
| [27] |
李文丽, 徐发林, 牛铭, 等. 不同程度支气管肺发育不良早产儿的临床特征及预后分析[J]. 中国当代儿科杂志, 2018, 20(4): 261-266. DOI:10.7499/j.issn.1008-8830.2018.04.002 (  0) 0) |
 2020, Vol. 22
2020, Vol. 22


