Tatton-Brown-Rahman综合征(Tatton-Brown-Rahman syndrome, TBRS, OMIM 615879),也被称为DNMT3A-过度生长综合征,是一种表现为过度生长和智力障碍的综合征。2014年Tatton-Brown等[1]首次报道了13例具有DNMT3A基因新发杂合变异的个体。随后,Tatton-Brown等[2]又新报道了42例TBRS患者。TBRS最常见的临床表现为智力障碍(中度居多)和过度生长(定义为身高和/或头围高于平均值的2 SD以上),同时也可伴有关节过度活动、肥胖、肌张力减退、行为/精神问题(以孤独症谱系障碍最常见)、脊柱侧弯和无热惊厥。此外,许多人都会有自己独特的面部特征,但在青春期之前可能很难发现。目前国内尚未见TBRS报道。现将我院儿科收治的1例DNMT3A基因新发杂合变异导致的TBRS患儿的临床资料及基因分析结果进行报道,并对相关文献进行复习,以提高临床医生对该病的认识,避免漏诊。
1 资料与方法 1.1 研究对象患儿,女,8个月14 d,因夜间哭闹2个月余,发现脑积水1个月入院。2个月前患儿无明显诱因出现夜间哭闹增多,难以安抚,无惊厥、屏气,无气促、发绀。1个月前患儿于外院就诊发现头围增大(具体数值不详),行头颅CT平扫考虑幕上脑积水并双侧侧脑室旁间质性水肿、小脑扁桃体下疝。患儿无抽搐、呕吐、神志不清及颈强直等表现,10 d前外院Gesell发育量表(8月龄)评估结果示粗大动作能发育商37(重度落后)、语言能发育商40(重度落后)、精细动作能发育商57(轻度落后)、应物能发育商60(轻度落后)、应人能发育商60(轻度落后)。患儿系第3胎第2产,38+2周因母亲“妊娠期高血压”剖宫产出生,出生体重2.9 kg;生后因“轻度窒息”在当地新生儿科住院治疗,诊断为“新生儿缺氧缺血性脑病”,病情好转后出院。2月龄复查头颅CT提示大脑发育不良。4月龄抬头,至今不能翻身、爬、坐。父母身体健康,非近亲婚配,有1个哥哥,7岁,身体健康。否认遗传代谢病家族史。
入院时体格检查:生长参数标准差参照中国儿童的生长参照标准生长数据计算[3]。体重6.5 kg(-2.5 SD),身长67 cm(-1.6 SD),头围48 cm(+3 SD),神志清楚,反应稍迟钝,前囟4 cm×3 cm,张力不高,头皮静脉无怒张,双眼追光反射灵敏,无眼震,瞳孔对光反射灵敏,面纹对称,心肺听诊无异常,肝脾肋下未扪及。脊柱活动度正常,无畸形。四肢活动自如,肌力、肌张力减低,关节无明显肿大、畸形,活动度正常。
辅助检查:血常规、肝肾功能、电解质、血气分析、空腹血糖、胰岛素、甲状腺功能及肾上腺皮质功能正常。
1.2 二代测序及Sanger测序验证采集患儿及其父母外周静脉血3 mL,EDTA抗凝,并用SolPure Blood DNA试剂盒(广州美基生物科技有限公司)提取基因组DNA,行临床医学外显子4000致病基因Panel检测,测序平台为Illumina Nextseq 500(Illumina公司,美国),由广州嘉检医学检测有限公司完成。该Panel包括4 047个相关基因,55 698个编码区,共含有11 781 176个碱基。参考美国医学遗传学与基因组学学会(American College of Medical Genetics and Genomics, ACMG)序列变异解读标准和指南[4]对变异位点进行致病性综合评估。根据二代测序结果,对患儿及其父母进行Sanger测序验证。
1.3 文献回顾以“Tatton-Brown-Rahman syndrome” “DNMT3A”“Tatton-Brown-Rahman综合征”和“DNMT3A基因”为检索词,分别检索PubMed(https://pubmed.ncbi.nlm.nih.gov/)、人类基因组突变数据库(HGMD, http://www.hgmd.cf.ac.uk)、在线人类孟德尔遗传数据库(OMIM, http://omim.org)、中国知网(CNKI)和万方数据库,检索时间为建库至2019年12月。收集资料信息完整患儿的临床和遗传学资料进行分析总结,包括基因突变类型、临床表现、实验室检查、影像学检查等。
本研究获得中山大学附属第六医院伦理委员会的批准(2017ZSLYEC-105),且获患儿父母知情同意。
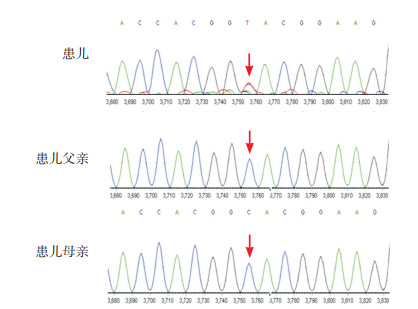
2 结果 2.1 基因检测结果及致病性分析基因结果发现该患儿DNMT3A基因存在杂合变异c.134C > T(p.A45V),经Sanger测序验证,其父母该位点为野生型(图 1)。变异所在区域是这个蛋白质的重要组成部分,不同物种的氨基酸序列高度保守(图 2)。该变异为新发变异,无家族史,符合PS2;该变异为ESP数据库(http://evs.gs.washington.edu/EVS/)、千人数据库(http://www.internationalgenome.org)、ExAC数据库(http://exac.broadinstitute.org)正常对照人群中未发现的变异(或隐性遗传病中极低频位点),符合PM2;经多种生物信息学软件预测该变异为有害的,符合PP3;因此该变异评级为可能致病性变异。
|
图 1 患儿及其父母Sanger测序图 患儿DNMT3A基因存在杂合变异c.134C > T(p.A45V),其父母该位点为野生型。箭头所示为突变位点。 |

|
图 2 氨基酸保守序列图 DNMT3A蛋白第45位氨基酸位点在哺乳动物中高度保守(方框所示)。 |
根据患儿临床表现、实验室检查及基因测序结果,诊断为TBRS,其中脑水肿症状考虑为小脑扁桃体下疝畸形引起,因小儿对手术耐受性差,术后并发症多,病死率高,且目前患儿神经系统症状并不严重,暂不需特别治疗,予出院随诊。随诊至2020年4月,患儿2岁9月龄,行走不稳,会叫爸爸、妈妈和3~4个字的短句,体重11.8 kg(-2 SD),身长89.6 cm(-1.8 SD),头围52 cm(+2.9 SD)。
2.3 文献回顾结果共12篇文献报道TBRS,均为国外文献[1-2, 5-14],国内未见报道。本例DNMT3A基因c.134C > T(p.A45V)杂合变异国内外尚未见报道。12篇文献共报道100例TBRS患者,其中85例(85%)患者有智力障碍,22例为轻度智力障碍,53例为中度智力障碍,10例为重度智力障碍;29例(29%)患者报告有行为/精神问题,其中最常见的是孤独症谱系障碍(21例);70例(70%)患者有出生后生长过度。其他主要临床特征包括关节过度活动(41例,41%)、肌张力减退(31例,31%)、脊柱侧弯(24例,24%)和无热抽搐(12例,12%);少见临床特征包括隐睾症(8例,8%)、脑室扩大(5例,5%)、小脑扁桃体下疝畸形(5例,5%)及急性髓细胞白血病(AML)(3例,3%)。在TBRS患者中,合并心脏异常(包括房间隔缺损、二尖瓣/三尖瓣关闭不全、动脉导管未闭、主动脉根部增大)有14例(14%)。TBRS患者经常出现面部畸形,包括眉毛下垂、眉毛粗大、上中切牙突出。本例患儿存在精神运动发育迟缓、肌张力减退、脑室扩大和小脑扁桃体下疝,与之前报道的TBRS病例症状相符。因处于婴儿期,面部特征尚无特殊,可能到青春期后才能明显表现出来。
虽然患儿入院时头围增大(48 cm,+3 SD),但也不能排除是脑积水、脑水肿所致,并且体重6.5 kg(-2.5 SD),身长67 cm(-1.6 SD),表明体格生长落后。然而目前确诊的病例中,绝大部分确诊时大于3岁,并且在既往史中,没有提及在婴儿期的生长速度;3岁以下有4例,其中3例都表现为过度生长,但最小的1.5岁确诊患儿生长落后[2]。可能本病在婴儿期的生长过度并不明显,需要进一步研究TBRS患儿在不同生长发育阶段的生长速度。
3 讨论TBRS是由DNMT3A基因变异引起的,通过常染色体显性遗传[7]。到目前为止已经报道了多种DNMT3A基因的致病性变异,包括33个错义变异,8个无义变异,7个移码变异和2个剪接变异,2个框内缺失和5个全基因缺失(包括一组同卵双胞胎)[1-2, 5-14]。在TBRS患者中,大多数被报道的DNMT3A基因致病性变异都是新发变异,但也有部分是家族遗传,其中有5个患儿从2个嵌合体亲本继承了致病性变异[6, 12],有2个患儿从先证者(患儿父亲)继承了致病性变异[10]。
DNMT3A是保守DNA甲基转移酶(DNMT)家族的5个成员之一,在胚胎发生和生殖细胞发育过程中负责建立DNA甲基化模式,它还与许多生理功能有关,包括细胞分化、学习和记忆形成,并且还与恶性疾病、心脏病有关[14-15]。DNMT3A包含3个功能域:一个脯氨酸-色氨酸-色氨酸-脯氨酸结构域(PWWP),一个ATRX-DNMT3A-DNMT3L型锌指结构域(ADD)和一个C端DNA甲基转移酶结构域。DNMT3A在CpG位点和非CpG位点均可进行甲基化,但对CpG位点具有高度特异性。DNMT3A有2种亚型,由母体储存的mRNA表达,因此主要在卵母细胞和植入前胚胎中表达[16]。而DNA甲基化是基因组中最重要的表观遗传编程事件之一,在调节基因表达、基因组印记和X染色体失活等方面起着关键作用,并且还与肿瘤发生有关[15, 17]。
Heyn等[18]发现功能获得性DNMT3A基因变异可能增加细胞分化,而既往有报道DNMT3A功能丧失可导致神经干细胞及造血干细胞的分化受损和多能基因的上调[19-21]。因此可以推测,TBRS相关的DNMT3A基因变异导致的过度生长,其机制可能是由于变异促进了干细胞/祖细胞池的增殖,从而导致了器官形态分化和生长期间细胞数量的过度增加。Jeffries等[10]研究发现大部分的TBRS患者存在DNA低甲基化现象,其中涉及形态发生、发育、分化及恶性肿瘤的过程,与此同时TBRS患者又表现出高度加速的DNA甲基化老化。最近,杂合子的功能获得性DNMT3A基因错义变异可影响DNMT3A的PWWP结构域,已被证实该变异可引起多梳蛋白调节区域的高甲基化,从而出现小头畸形、侏儒症[18]。
DNMT3A基因变异在过度生长综合征中的作用机制尚不完全清楚,但与其在恶性肿瘤中的作用机制有一些相似之处和不同之处[1-2]。已知的是,体细胞DNMT3A基因变异可导致成人AML和骨髓增生异常综合征的发生,其中体细胞的DNMT3A R882位点变异占半数以上[22-24]。TBRS病例中, 有3例AML是在儿童时期被诊断出来的[7, 9]。第1个病例携带DNMT3A基因c.2644C > T (p.Arg882Cys)变异,在15岁时发现患有AML[7]。第2个病例是5岁时发现携带DNMT3A基因c.2204A > C(p.Tyr735Ser)变异,12岁时发现患有AML[2]。第3个病例携带DNMT3A基因c.2645G > A (p.Arg882His)变异, 在6岁时发现患有AML[11]。虽然这些数据表明AML的发生可能与TBRS有关,但目前报道的TBRS合并AML的患者数量太少,无法准确量化TBRS中AML的发生风险,也无法确定这种潜在风险是否受DNMT3A基因型的影响。同时在TBRS患者中也有1例合并成神经管细胞瘤的报道,并且DNMT3A表达的改变在髓母细胞瘤中比在AML中更常见[13]。
根据文献中病例随访发现,大多数TBRS患者可以存活到成年,但DNMT3A基因变异对寿命的影响目前还需要进一步的研究和随访。TBRS患者成年后的生活能否自理主要取决于智力障碍的程度,但其行为/精神问题、脊柱侧弯和无热惊厥是TBRS可能的并发症,需要进行相应的监测和随访。此外,建议常规进行超声心动图,筛查是否存在心脏异常;对于存在肌张力减退和/或关节过度活动的患者,可进行康复治疗,并评估针对性的运动是否有益。目前缺乏TBRS与血液学恶性肿瘤相关性的研究与报道,我们建议临床警惕TBRS患者可能与血液学恶性肿瘤相关的症状,如易瘀伤、牙龈或鼻反复出血、持续疲劳和反复感染。
本例患儿是中国人群首次报道的DNMT3A基因变异导致的TBRS,其DNMT3A基因杂合变异c.134C > T(p.A45V)为新发变异,临床表现为精神运动发育迟缓、肌张力减退、脑室扩大和小脑扁桃体下疝畸形。TBRS在临床表现上与其他表现为过度生长和智力障碍的综合征有部分重叠,包括Sotos综合征(OMIM 117550)、Weave综合征(OMIM 277590)、Malan综合征(OMIM 614753)和CHD8基因变异引起的过度生长和智力障碍综合征[14]。临床上可以通过结合其他主要临床表现,并通过识别相关的面部特征和其他过度生长和智力障碍综合征面部形态来加以区分。在临床症状无法区分时,可选择进行全外显子组分析、微阵列比较基因组杂交和单核苷酸微阵列芯片协助诊断。
| [1] |
Tatton-Brown K, Seal S, Ruark E, et al. Mutations in the DNA methyltransferase gene DNMT3A cause an overgrowth syndrome with intellectual disability[J]. Nat Genet, 2014, 46(4): 385-388. DOI:10.1038/ng.2917 (  0) 0) |
| [2] |
Tatton-Brown K, Zachariou A, Loveday C, et al. The Tatton-Brown-Rahman syndrome: a clinical study of 55 individuals with de novo constitutive DNMT3A variants[J]. Wellcome Open Res, 2018, 3: 46. DOI:10.12688/wellcomeopenres.14430.1 (  0) 0) |
| [3] |
首都儿科研究所, 九市儿童体格发育调查协作组. 中国七岁以下儿童体重、身长/身高和头围的生长标准值及标准化生长曲线[J]. 中华儿科杂志, 2009, 47(3): 173-178. (  0) 0) |
| [4] |
Richards S, Aziz N, Bale S, et al. Standards and guidelines for the interpretation of sequence variants: a joint consensus recommendation of the American College of Medical Genetics and Genomics and the Association for Molecular Pathology[J]. Genet Med, 2015, 17(5): 405-424. DOI:10.1038/gim.2015.30 (  0) 0) |
| [5] |
Okamoto N, Toribe Y, Shimojima K, et al. Tatton-Brown-Rahman syndrome due to 2p23 microdeletion[J]. Am J Med Genet A, 2016, 170A(5): 1339-1342. (  0) 0) |
| [6] |
Tlemsani C, Luscan A, Leulliot N, et al. SETD2 and DNMT3A screen in the Sotos-like syndrome French cohort[J]. J Med Genet, 2016, 53(11): 743-751. DOI:10.1136/jmedgenet-2015-103638 (  0) 0) |
| [7] |
Lemire G, Gauthier J, Soucy JF, et al. A case of familial transmission of the newly described DNMT3A-overgrowth syndrome[J]. Am J Med Genet A, 2017, 173(7): 1887-1890. DOI:10.1002/ajmg.a.38119 (  0) 0) |
| [8] |
Hollink IHIM, van den Ouweland AMW, Beverloo HB, et al. Acute myeloid leukaemia in a case with Tatton-Brown-Rahman syndrome: the peculiar DNMT3A R882 mutation[J]. J Med Genet, 2017, 54(12): 805-808. DOI:10.1136/jmedgenet-2017-104574 (  0) 0) |
| [9] |
Kosaki R, Terashima H, Kubota M, et al. Acute myeloid leukemia-associated DNMT3A p.Arg882His mutation in a patient with Tatton-Brown-Rahman overgrowth syndrome as a constitutional mutation[J]. Am J Med Genet A, 2017, 173(1): 250-253. DOI:10.1002/ajmg.a.37995 (  0) 0) |
| [10] |
Jeffries AR, Maroofian R, Salter CG, et al. Growth disrupting mutations in epigenetic regulatory molecules are associated with abnormalities of epigenetic aging[J]. Genome Res, 2019, 29(7): 1057-1066. DOI:10.1101/gr.243584.118 (  0) 0) |
| [11] |
Shen W, Heeley JM, Carlston CM, et al. The spectrum of DNMT3A variants in Tatton-Brown-Rahman syndrome overlaps with that in hematologic malignancies[J]. Am J Med Genet A, 2017, 173(11): 3022-3028. DOI:10.1002/ajmg.a.38485 (  0) 0) |
| [12] |
Xin B, Cruz Marino T, Szekely J, et al. Novel DNMT3A germline mutations are associated with inherited Tatton-Brown-Rahman syndrome[J]. Clin Genet, 2017, 91(4): 623-628. (  0) 0) |
| [13] |
Sweeney KJ, Mottolese C, Belot A, et al. The first case report of medulloblastoma associated with Tatton-Brown-Rahman syndrome[J]. Am J Med Genet A, 2019, 179(7): 1357-1361. (  0) 0) |
| [14] |
Tatton-Brown K, Loveday C, Yost S, et al. Mutations in epigenetic regulation genes are a major cause of overgrowth with intellectual disability[J]. Am J Hum Genet, 2017, 100(5): 725-736. DOI:10.1016/j.ajhg.2017.03.010 (  0) 0) |
| [15] |
Zhang W, Xu J. DNA methyltransferases and their roles in tumorigenesis[J]. Biomark Res, 2017, 5: 1. DOI:10.1186/s40364-017-0081-z (  0) 0) |
| [16] |
Uysal F, Akkoyunlu G, Ozturk S. Dynamic expression of DNA methyltransferases (DNMTs) in oocytes and early embryos[J]. Biochimie, 2015, 116: 103-113. DOI:10.1016/j.biochi.2015.06.019 (  0) 0) |
| [17] |
Lyko F. The DNA methyltransferase family: a versatile toolkit for epigenetic regulation[J]. Nat Rev Genet, 2018, 19(2): 81-92. DOI:10.1038/nrg.2017.80 (  0) 0) |
| [18] |
Heyn P, Logan CV, Fluteau A, et al. Gain-of-function DNMT3A mutations cause microcephalic dwarfism and hypermethylation of polycomb-regulated regions[J]. Nat Genet, 2019, 51(1): 96-105. DOI:10.1038/s41588-018-0274-x (  0) 0) |
| [19] |
Wu H, Coskun V, Tao J, et al. Dnmt3a-dependent nonpromoter DNA methylation facilitates transcription of neurogenic genes[J]. Science, 2010, 329(5990): 444-448. DOI:10.1126/science.1190485 (  0) 0) |
| [20] |
Challen GA, Sun D, Jeong M, et al. Dnmt3a is essential for hematopoietic stem cell differentiation[J]. Nat Genet, 2011, 44(1): 23-31. (  0) 0) |
| [21] |
Jeong M, Park HJ, Celik H, et al. Loss of Dnmt3a immortalizes hematopoietic stem cells in vivo[J]. Cell Rep, 2018, 23(1): 1-10. (  0) 0) |
| [22] |
Yan XJ, Xu J, Gu ZH, et al. Exome sequencing identifies somatic mutations of DNA methyltransferase gene DNMT3A in acute monocytic leukemia[J]. Nat Genet, 2011, 43(4): 309-315. DOI:10.1038/ng.788 (  0) 0) |
| [23] |
Nikoloski G, van der Reijden BA, Jansen JH. Mutations in epigenetic regulators in myelodysplastic syndromes[J]. Int J Hematol, 2012, 95(1): 8-16. DOI:10.1007/s12185-011-0996-3 (  0) 0) |
| [24] |
Abdel-Wahab O, Levine RL. Mutations in epigenetic modifiers in the pathogenesis and therapy of acute myeloid leukemia[J]. Blood, 2013, 121(18): 3563-3572. DOI:10.1182/blood-2013-01-451781 (  0) 0) |
 2020, Vol. 22
2020, Vol. 22


