2020年初,我国暴发了极具传染性的病毒性肺炎,病原学明确为严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2, SARS-CoV-2),WHO将此病毒导致的疾病统称为2019冠状病毒病(coronavirus disease 2019, COVID-19)。该病传染性强,截至2020年9月中旬,全球188个国家地区共报告了超过2 928万例的COVID-19确诊病例[1]。世界卫生组织2020年2月16~24日于我国的调查研究结果显示18岁以下人群该病罹患率相对较低,仅占所有病例报告的2.4%,且无儿童传染成人情况[2]。随着SARS-CoV-2全球流行,儿童COVID-19问题越来越受到重视,在收集了国内外COVID-19儿童患者数据进行人口基线特征分析后,得出结论:与成人相比,儿童COVID-19具有高聚集性发病、临床症状轻、症状不典型、重症病例少的特点[3]。所有年龄儿童均有感染SARS-CoV-2的可能,无明显差异[4]。此外,患儿诊断的中位年龄是7岁,在性别方面COVID-19患儿数量无明显差异[5]。迄今为止没有直接证据表明SARS-CoV-2存在垂直传播的可能,但是对于可疑及确诊的COVID-19孕妇患者,应注意预防新生儿感染[6]。儿童与成人患者临床表现显著不同的原因目前尚不清楚,有研究推测可能与COVID-19感染细胞的关键受体—血管紧张素转换酶(angiotensin converting enzyme, ACE)2的表达水平有关[7-9],但缺乏证据支持。
呼吸道传播是SARS-CoV-2主要的传染途径,对死亡COVID-19患者进行尸体解剖后提示病变累及肺部,肺脏有不同程度实变,肺泡腔内水肿、渗出明显,支气管腔内见大量黏液栓堵塞,电镜下支气管上皮及肺泡上皮细胞均可见冠状病毒颗粒,且PCR结果阳性[10-11],以上提示肺部的气道上皮细胞表面的ACE2受体可能是病毒的主要侵入途径之一。因此,气道上皮细胞中ACE2受体的表达情况可能成为解释儿童与成人患者临床表现不同的机制之一。故亟需对不同发育时期肺部ACE2的表达情况进行探讨。但COVID-19儿童肺组织难以获得,因小鼠与人具有较高染色体同源性[12],本研究选用小鼠作为研究对象。本文旨在通过分析正常小鼠不同阶段肺组织内ACE2及其信号通路关键分子表达情况,为成人及儿童COVID-19发病特点不同是否与ACE2表达水平存在相关性提供实验证据,为明确儿童COVID-19发病机制及研究有效治疗措施提供思路。
1 材料与方法 1.1 实验动物40只SPF清洁级Balb/c小鼠均购于四川成都达硕生物科技有限公司,雄性8只,雌性32只,年龄均为12周,体重18~22 g,于IVC笼具的屏障通风系统中饲养,温度、湿度及光照恒定,由电脑计算控制。观察雌鼠阴道口出现温湿红肿及明显皱褶时为发情期,按雌雄4 : 1配对合笼交配,次日早晨检查雌鼠阴道,若发现阴栓,则确定为孕鼠并分笼单独喂养,计当日中午为受孕第0.5天,以此为时间点计算胎鼠胎龄,孕鼠娩出仔鼠后分笼,并计数仔鼠日龄。
1.2 动物分组根据Balb/c小鼠生长发育规律,取其胚胎期[孕(E)14.5 d、E18.5 d]、婴幼儿期[生后(P)0、3、7、14、21 d]、青少年期(P28 d、P42 d)、成年期(P84 d)共10个时间点。胚胎期肺组织是收取孕鼠的一窝胎鼠汇总得到的,每个时间点取4只孕鼠;婴幼儿期、青少年期、成年期每个时间点取4只小鼠。
1.3 小鼠肺组织获取、处理及总RNA提取孕鼠、新生鼠、幼鼠、成年鼠均称重后予1%戊巴比妥(60 mg/kg,四川成都麦克林公司)左下腹腔注射麻醉,约1~2 min后将麻醉小鼠固定于解剖板上分别取出胎鼠、新生鼠、幼鼠、成年鼠两侧肺组织,用冰上预冷的0.01 mol/L PBS漂洗3次,放入冻存管,标记编号,液氮或-80℃冰箱冻存。液氮中取出标本剪碎,加入1 mL TRIzol(美国Sigma公司),磨碎组织后静置使核酸蛋白质完全分离,离心后取上清液。上清液总RNA的抽提严格按照操作手册操作。
1.4 转录组测序样本处理按cBot User Guide标准流程进行处理,利用Illumination HiSeq 2000测序平台进行全转录组测序,测序过程由Illumina提供的data collection software进行控制,并进行实时数据分析,使用Fragments Per Kilobase Million(FPKM)数值表示肺组织中不同基因的相对表达量。质控标准:数据量约6G/样本,每项碱基质量大于20(Q20)的比例不小于90%。得到数据后,针对血管紧张素原(AGT)、ACE、ACE2、肾素(Renin)、血管紧张素Ⅱ1型受体a(Agtr1a)、血管紧张素Ⅱ1型受体b(Agtr1b)、血管紧张素Ⅱ2型受体(Agtr2)、Mas原生基因1(Mas1)基因的表达数据进行分析。
1.5 统计学分析采用SPSS 22.0统计软件对所有数据进行统计学分析,计量资料用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验,P < 0.05为差异有统计学意义。
2 结果 2.1 ACE2在不同时期小鼠肺组织中的表达情况不同时间点小鼠肺组织中ACE2表达比较差异有统计学意义(F=4.498,P < 0.05)。ACE2在小鼠出生时升高(E18.5 d vs P0 d,P < 0.05),于P3 d达到高峰(E18.5 d vs P3 d,P < 0.05),随后下降,于P14 d到达低点后又上升,成年期小鼠ACE2的表达与最高峰时比较差异无统计学意义(P3 d vs P84 d,P > 0.05),见图 1。

|
图 1 ACE2在不同时期小鼠肺组织中的表达变化 a示与E18.5 d比较,P < 0.05。 |
Mas1是ACE2通路下游受体。Mas1在小鼠不同发育时间一直处于低表达状态,不同时间点小鼠肺组织中Mas1表达比较差异无统计学意义(F=4.135,P > 0.05),见图 2。

|
图 2 Mas1在不同时期小鼠肺组织中的表达变化 |
AGT是肾素-血管紧张素系统(renin-angiotensin system, RAS)通路的初始作用底物。不同时间点小鼠肺组织中AGT表达比较差异有统计学意义(F=79.194,P < 0.05)。AGT在小鼠出生时迅速升高(E18.5 d vs P0 d,P < 0.05),于P7 d达到高峰(E18.5 d vs P7 d,P < 0.05),随后下降,在P21 d降至低限(P7 d vs P21 d,P < 0.05)。在小鼠整个发育期中,AGT表达量峰值出现在P7 d(P7 d vs P3 d,P < 0.05;P7 d vs P14 d,P < 0.05)。见图 3。

|
图 3 AGT在不同时期小鼠肺组织中的表达变化 a示与E18.5 d比较,P < 0.05;b示与P7 d比较,P < 0.05。 |
Renin是RAS通路的关键酶。在不同时期小鼠肺组织中Renin均呈低水平表达,峰值表达发生在胎鼠中,但表达量无明显波动,不同时间点小鼠肺组织中Renin表达比较差异无统计学意义(F=4.155,P > 0.05),见图 4。
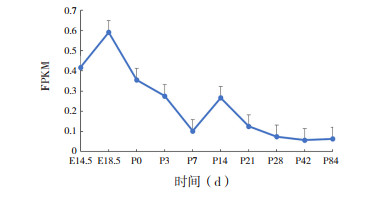
|
图 4 Renin在不同时期小鼠肺组织中的表达变化 |
对小鼠肺组织中ACE表达水平进行动态监测后得出,不同时间点的ACE表达水平比较差异有统计学意义(F=29.543,P < 0.05)。ACE表达量在生后迅速升高,生后第21天到达最高峰(P21 d vs P14 d,P < 0.05),随后维持在一定水平波动,见图 5。
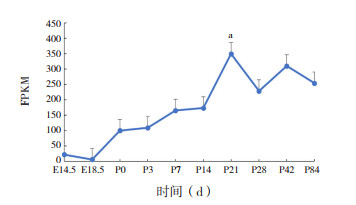
|
图 5 ACE在不同时期小鼠肺组织中的表达变化 a示与P14 d比较,P < 0.05。 |
血管紧张素1型受体(Agtr1)是RAS通路中的关键受体,可分为Agtr1a及Agtr1b两种亚型。Agtr1a在不同时间点表达水平比较差异有统计学意义(F=7.246,P < 0.05)。生后第21天Agtr1a表达到达最高峰水平(E18.5 d vs P21 d,P < 0.05),随后小幅度降低后维持在稳定水平。Agtr1b主要表达于肾上腺和脑垂体,在不同时期的小鼠肺组织中表达量比较差异无统计学意义(F=2.093,P > 0.05)。见图 6。
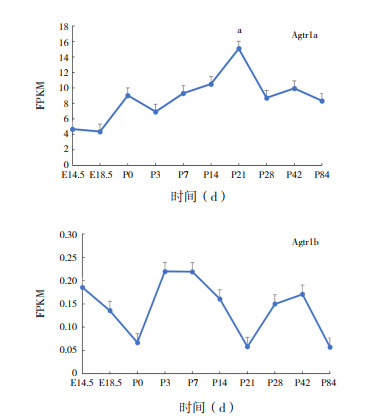
|
图 6 Agtr1在不同时期小鼠肺组织中的表达变化 a示与E18.5 d比较,P < 0.05。 |
Agtr2作为血管紧张素Ⅱ(AngⅡ)的另一类受体,表达水平略高于Agtr1,表达趋势不一致,各时间点表达水平比较差异无统计学意义(F=1.962,P > 0.05)。Agtr2在小鼠出生前表达量最高,出生后逐渐下降呈低水平表达,并维持在低限水平,见图 7。
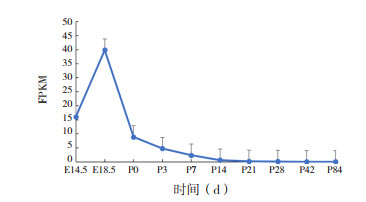
|
图 7 Agtr2在不同时期小鼠肺组织表达情况 |
SARS-CoV-2属于β冠状病毒属,Sarbecovirus亚属,直径60~140 nm,是一种有包膜、带正电荷的单链RNA病毒,也是目前发现感染人类的第7种冠状病毒[13]。SARS-CoV-2与SARS-CoV高度相似的病毒棘突蛋白编码序列,提示两者具有共同结合受体[14],即ACE2。SARS-CoV-2主要与气道肺泡上皮细胞ACE2受体结合,通过呼吸道传播,感染者多以咳嗽、流涕等呼吸道表现为起病症状,同时,密切接触、气溶胶及消化道也可传播[15]。
ACE2是RAS通路的重要成员之一。RAS是由一系列肽类激素及酶组成的体液调节系统,主要通过调节人体血压、水、电解质的平衡调控心血管及泌尿系统。正常生理情况下,肾脏球旁细胞分泌的Renin,可将AGT水解为血管紧张素Ⅰ(Ang Ⅰ),ACE以Ang Ⅰ为底物催化生成AngⅡ,Ang Ⅱ与血管平滑肌细胞膜上的Agtr1及Agtr2结合,发挥血管收缩、血管重构、增加血管通透性及诱导肺泡上皮细胞凋亡等效应[16]。ACE2作为ACE同源酶,首次在2000年被发现[17-18],其作用于ACE2/Ang 1~7/Mas轴,催化Ang I水解为无活性的Ang 1~9,进一步再水解为Ang 1~7;同时,还能催化Ang Ⅱ水解为Ang 1~7,后者作用于Mas受体,发挥舒张血管、减轻血管重构、抗炎、抗氧化应激等保护心脏作用。
ACE2基因敲除小鼠在急性肺损伤模型中表现出了更重的症状及更高的死亡率,注入重组ACE2的小鼠体内肺损伤情况较轻,提示ACE2在肺损伤中发挥一定程度肺保护作用[19],具体作用机制可能与ACE/AngⅡ/Agtr1与ACE2/Ang 1~7/Mas轴平衡有关。另外,动物模型研究发现ACE抑制剂(ACEI)、Agtr1拮抗剂(ARB)及Spike蛋白-ACE2结合阻滞剂均能减轻肺部炎症及肺损伤[20-22],提示ACE2及其作用轴上相关分子在肺部炎症发生及修复中发挥重要作用。
国内外研究集中探讨ACE2在新型冠状病毒肺炎发病、发展中的作用后,普遍认为ACE2作为人体RAS上的催化酶,一方面,病毒感染由肺组织上ACE2 Spike糖蛋白基团介导;另一方面,ACE2在ACE/AngⅡ/Agtr1与ACE2/Ang 1~7/Mas轴相互制衡中发挥重要作用,能起到一定的肺保护作用[23-24]。因此,对于在发育不同阶段肺部ACE2及其信号通路关键分子的表达情况的探讨,可能成为解释儿童与成人在病毒感染后不同临床表现的一个突破口。
本文探讨了小鼠不同发育阶段中ACE2,以及ACE/AngⅡ/Agtr1和ACE2/Ang 1~7/Mas轴关键分子AGT、ACE、Renin、Agtr1a、Agtr1b、Agtr2、Mas1表达情况,结果提示:ACE2作为拮抗ACE信号通路的分子,在小鼠不同发育时期,于肺组织中存在一定动态变化过程,分别在早期新生鼠及成年鼠中表达量较高,可能在不同肺发育时期发挥不同稳态调节作用。其他分子在RAS中起不同作用,表达也有各自趋势。AGT表达在P21 d降至最低值,可能与小鼠生后肺部通气和循环系统的改变有关;ACE的表达在出生后有两个峰值,提示在小鼠婴幼儿阶段ACE可能发挥不同作用;Agtr1a是ACE/AngⅡ/Agtr1轴AngⅡ的肺部主要受体,其表达量与ACE的表达情况有一定一致性;Agtr2在小鼠出生前表达量明显高于生后,且生后水平趋于零,提示在肺部其下游信号通路的主要作用可能是胚胎期;Mas1作为Ang1~7的主要受体,可能是因为其在肺部表达的细胞数量较少,一直处于低表达状态;Renin、Agtr1b由于产生部位不在肺组织,因此均呈低水平表达。在小鼠不同发育阶段,ACE2表达存在动态变化,且RAS通路上其他关键分子,包括底物、酶、受体也各有其表达趋势,因此小鼠实验提示儿童COVID-19临床症状轻、症状不典型、重症病例少等临床特点与ACE2表达水平可能存在一定的相关性。而ACE2作用机制不排除与ACE2结合力或受体功能等因素有关。此实验建立在小鼠模型上,因此结果有一定局限性,为明确儿童与成人患病风险差异的原因,需要进一步探索。
与此同时,SARS-CoV-2除感染肺泡上皮细胞外,可能侵及全身其他脏器。现有研究提示消化系统如食管、回结肠的肠上皮细胞中,ACE2有高水平表达[25],现有病例也证实儿童中SARS-CoV-2可经粪-口途径传播,且具有肠道排毒时间长,肛拭子核酸检测长时间阳性等特点[26]。因此,在后续的研究中,需要从多系统、多层面对COVID-19进行研究。
利益冲突声明:所有作者均声明不存在利益冲突。
| [1] |
COVID-19 Dashboard by the Center for Systems Science and Engineering (CSSE) at Johns Hopkins University (JHU)[EB/OL]. [2020-09-15]. https://gisanddata.maps.arcgis.com/apps/opsdashboard/index.html#/bda7594740fd40299423467b48e9ecf6.
(  0) 0) |
| [2] |
中华人民共和国国家卫生健康委员会疾病预防控制局. 《中国-世界卫生组织新型冠状病毒肺炎(COVID-19)联合考察报告》发布[EB/OL]. (2020-02-29)[2020-03-05]. http://www.nhc.gov.cn/jkj/s3578/202002/87fd92510d094e4b9bad597608f5cc2c.shtml.
(  0) 0) |
| [3] |
杨斌斌, 朱月玲. 儿童与成人新型冠状病毒肺炎的流行病学与治疗现状分析[J]. 西安交通大学学报(医学版), 2020, 41(4): 483-487. (  0) 0) |
| [4] |
中华人民共和国国家卫生健康委员会医政医管局.关于印发新型冠状病毒肺炎诊疗方案(试行第七版)的通知[EB/OL]. (2020-03-04)[2020-03-05]. http://www.nhc.gov.cn/yzygj/s7653p/202003/46c9294a7dfe4cef80dc7f5912eb1989.shtml.
(  0) 0) |
| [5] |
Dong Y, Mo X, Hu Y, et al. Epidemiology of COVID-19 among children in China[J]. Pediatrics, 2020, 145(6): e20200702. DOI:10.1542/peds.2020-0702 (  0) 0) |
| [6] |
She J, Liu L, Liu W. COVID-19 epidemic: disease characteris-tics in children[J]. J Med Virol, 2020, 92(7): 747-754. DOI:10.1002/jmv.25807 (  0) 0) |
| [7] |
Xu H, Zhong L, Deng J, et al. High expression of ACE2 receptor of 2019-nCoV on the epithelial cells of oral mucosa[J]. Int J Oral Sci, 2020, 12(1): 8. (  0) 0) |
| [8] |
Baig AM, Khaleeq A, Ali U, et al. Evidence of the COVID-19 virus targeting the CNS: tissue distribution, host-virus interaction, and proposed neurotropic mechanisms[J]. ACS Chem Neurosci, 2020, 11(7): 995-998. DOI:10.1021/acschemneuro.0c00122 (  0) 0) |
| [9] |
Kruse RL. Therapeutic strategies in an outbreak scenario to treat the novel coronavirus originating in Wuhan, China[J]. F1000Res, 2020, 9: 72. DOI:10.12688/f1000research.22211.2 (  0) 0) |
| [10] |
刘茜, 王荣帅, 屈国强, 等. 新型冠状病毒肺炎死亡尸体系统解剖大体观察报告[J]. 法医学杂志, 2020, 36(1): 21-23. (  0) 0) |
| [11] |
Xu Z, Shi L, Wang Y, et al. Pathological findings of COVID-19 associated with acute respiratory distress syndrome[J]. Lancet Respir Med, 2020, 8(4): 420-422. DOI:10.1016/S2213-2600(20)30076-X (  0) 0) |
| [12] |
王一平, 程在玉. 人与小鼠染色体的同源性及遗传病动物模型[J]. 国外医学(遗传学分册), 1988(2): 72-75. (  0) 0) |
| [13] |
Zhu N, Zhang D, Wang W, et al. A novel coronavirus from patients with pneumonia in China, 2019[J]. N Engl J Med, 2020, 382(8): 727-733. DOI:10.1056/NEJMoa2001017 (  0) 0) |
| [14] |
Wan Y, Shang J, Graham R, et al. Receptor recognition by the novel coronavirus from Wuhan: an analysis based on decade-long structural studies of SARS coronavirus[J]. J Virol, 2020, 94(7): e00127-20. (  0) 0) |
| [15] |
Guo YR, Cao QD, Hong ZS, et al. The origin, transmission and clinical therapies on coronavirus disease 2019 (COVID-19) outbreak - an update on the status[J]. Mil Med Res, 2020, 7(1): 11. (  0) 0) |
| [16] |
彭文艺, 甘雪晴, 谭艳, 等. 新型冠状病毒感染性疾病心血管系统损害机制与治疗进展[J]. 中华医院感染学杂志, 2020, 30(8): 1177-1182. (  0) 0) |
| [17] |
Donoghue M, Hsieh F, Baronas E, et al. A novel angiotensin-converting enzyme-related carboxypeptidase (ACE2) converts angiotensin I to angiotensin 1-9[J]. Circ Res, 2000, 87(5): E1-E9. (  0) 0) |
| [18] |
Tipnis SR, Hooper NM, Hyde R, et al. A human homolog of angiotensin-converting enzyme. Cloning and functional expression as a captopril-insensitive carboxypeptidase[J]. J Biol Chem, 2000, 275(43): 33238-33243. DOI:10.1074/jbc.M002615200 (  0) 0) |
| [19] |
Imai Y, Kuba K, Rao S, et al. Angiotensin-converting enzyme 2 protects from severe acute lung failure[J]. Nature, 2005, 436(7047): 112-116. DOI:10.1038/nature03712 (  0) 0) |
| [20] |
Boskabadi J, Askari VR, Hosseini M, et al. Immunomodulatory properties of captopril, an ACE inhibitor, on LPS-induced lung inflammation and fibrosis as well as oxidative stress[J]. Inflammopharmacology, 2019, 27(3): 639-647. DOI:10.1007/s10787-018-0535-4 (  0) 0) |
| [21] |
Yang P, Gu H, Zhao Z, et al. Angiotensin-converting enzyme 2 (ACE2) mediates influenza H7N9 virus-induced acute lung injury[J]. Sci Rep, 2014, 4: 7027. (  0) 0) |
| [22] |
Zhang L, Liu Y. Potential interventions for novel coronavirus in China: a systematic review[J]. J Med Virol, 2020, 92(5): 479-490. DOI:10.1002/jmv.25707 (  0) 0) |
| [23] |
孙美丽, 杨建民, 孙玉萍, 等. RAS抑制剂是治疗新型冠状病毒肺炎的可能选择之一[J]. 中华结核和呼吸杂志, 2020, 43(3): 219-222. (  0) 0) |
| [24] |
Hoffmann M, Kleine-Weber H, Schroeder S, et al. SARS-CoV-2 cell entry depends on ACE2 and TMPRSS2 and is blocked by a clinically proven protease inhibitor[J]. Cell, 2020, 181(2): 271-280.e8. DOI:10.1016/j.cell.2020.02.052 (  0) 0) |
| [25] |
Zhang H, Kang ZJ, Gong HY, et al. Digestive system is a potential route of COVID-19: an analysis of single-cell coexpression pattern of key proteins in viral entry process[J]. Gut, 2020, 69(6): 1010-1018. DOI:10.1136/gutjnl-2020-320953 (  0) 0) |
| [26] |
Chen W, Lan Y, Yuan X, et al. Detectable 2019-nCoV viral RNA in blood is a strong indicator for the further clinical severity[J]. Emerg Microbes Infect, 2020, 9(1): 469-473. DOI:10.1080/22221751.2020.1732837 (  0) 0) |
 2020, Vol. 22
2020, Vol. 22


