患儿,男,6月龄,因竖头不稳、全身松软、双手不知主动抓物入院。患儿系第1胎第1产,孕40+2周顺产出生。产时因胎儿宫内窘迫,给予胎头吸引术助产。羊水Ⅱ°污染,胎盘、脐带未诉异常。生后哭声弱,Apgar评分1 min 9分,5 min 10分。出生体重3.25 kg。生后未发现明显黄疸。生后喂养困难,4个月时发现发育落后,于当地医院诊断为“发育迟缓”,表现为不知追视、头控差、全身松软,康复治疗2月余,效果欠佳。既往存在反复上呼吸道感染病史。母孕期体健,否认毒物、放射线接触史。生后人工喂养,新生儿筛查结果正常。父亲28岁,母亲29岁,父亲体健,其母为“乙肝病毒携带者”,否认近亲婚配。否认家族中有遗传病史。
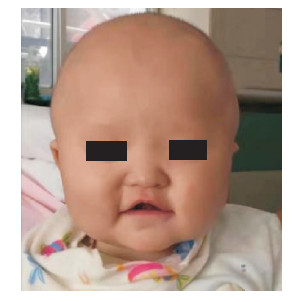
患儿首次就诊时体格检查:年龄6个月,头围41.0 cm,前囟平软,约1.5 cm×1.5 cm,体重8.5 kg。神志清,精神可,存在痛觉障碍,体格发育尚可,营养中等,皮肤白皙,心音可,律齐,胸骨左缘第二肋间及左锁骨下方可闻及连续性机械样杂音。肺、腹体格检查未见异常。表情稍呆,反应迟,眼距稍宽,内眦赘皮,稍内斜视,张口容貌,下唇唇红外翻,高腭弓,人中短,低位耳(图 1),双手通贯掌。寻声反应欠佳,偶能笑出声,注意力不集中,不认母亲,叫名无反应。头控制欠佳,双手不知主动抓物,坐位半前倾,扶立位双足外翻,双下肢支撑力欠佳,全身松软,四肢肌张力低,腱反射可引出,病理反射未引出。
|
图 1 患儿特殊面容 眼距稍宽,内眦赘皮,稍内斜视,张口容貌,人中短,低位耳。 |
辅助检查:血常规、肝肾功能、心肌酶谱、甲状腺功能、血氨、铜蓝蛋白、电解质检测、血同型半胱氨酸、神经元特异性烯醇化酶、血凝分析、氨基酸和酰基肉碱谱及先天性代谢缺陷尿筛查未见异常。心脏彩超示卵圆孔未闭、动脉导管未闭。头颅磁共振检查无异常。Gesell发育诊断评定示:适应性、大运动、精细动作、语言、个人-社交发育商分别为48、43、47、41、43。
使用血液基因组柱式中量提取试剂盒(北京天根生化科技有限公司)提取基因组DNA,操作按照试剂盒说明书进行。所提取DNA样本用Qubit 2.0型荧光计及0.8%的琼脂糖凝胶电泳对所提供的DNA样本进行质检,合格后继续后续步骤。采用IDT公司xGen® Exome Research Panel v1.0捕获探针与gDNA文库序列进行液体杂交,将目标区域DNA片段进行富集,构建全外显子文库,覆盖人基因组中19 396个基因的编码区及部分非编码区,捕获区间大小51 Mb。通过Illumina公司NovaSeq 6000系列测序仪进行高通量测序(PE150),目标序列测序覆盖度不低于99%。测序过程由智因东方转化医学研究中心完成。根据二代测序结果,对目标序列进行PCR后,提取患儿及其父母的外周血DNA进行ABI3730测序仪Sanger测序,验证CHAMP1基因突变,并经序列分析软件得到验证结果。
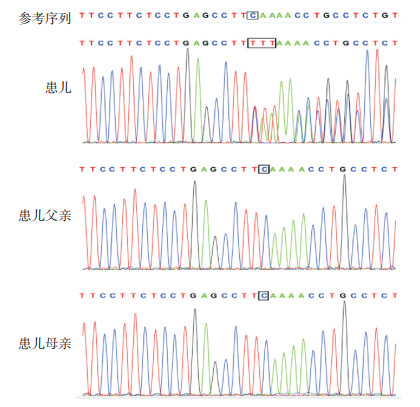
trio全基因组拷贝数变异检测示:(1)染色体非整倍体:受检者染色体为46, XY,染色体数目正常;(2)染色体微缺失或微重复:阴性。trio全外显子组测序检测发现CHAMP1基因(位于13号染色体)1个移码突变,根据美国医学遗传学与基因组学学会(ACMG)致病性等级评定为致病,位置为chr13:115089847,核酸改变为c.530delCinsTTT,导致氨基酸改变为p.S177Ffs*2。经Sanger测序验证,患儿父母均未携带该变异,提示该变异为新发突变(图 2)。该突变为移码突变,导致其编码的蛋白从第177位丝氨酸下游的第2号氨基酸变为终止密码子,形成截短型蛋白。根据临床特点及基因分析结果,该患儿诊断为常染色体显性智力障碍40型。
|
图 2 患儿及其父母CHAMP1基因外显子测序结果 患儿CHAMP1基因存在c.530delCinsTTT(p.S177Ffs*2)移码突变,患儿父母测序结果正常,均为野生型。 |
综合患儿临床特征及辅助检查,最终诊断为:(1)智力障碍,常染色体显性40型;(2)先天性心脏病。给予综合康复治疗2个疗程。随访至1岁时,患儿反应稍迟,表情稍呆,认生人欠佳,仅会无意识发“bu”音,不能听懂简单指令,不认识简单生活物品。双手动作笨拙,指腹捏物不能,独坐不稳,体位转换欠佳,不能四点支撑,不会腹爬,能扶站,不会扶物侧方移动,扶立位双足外翻,双下肢支撑力欠佳,四肢肌张力低,腱反射可引出,病理反射未引出。Gesell发育诊断评定示:适应性、大运动、精细动作、语言、个人-社交发育商分别为59、54、69、53、70。
讨论:以“CHAMP1基因”或“CHAMP1”为检索词在CNKI数据库、万方数据库、PubMed数据库、人类基因突变数据库(HGMD)及在线人类孟德尔遗传数据库(OMIM)进行检索,共检索到4篇文献[1-4],共17例CHAMP1突变致病患者,其中男7例,女10例,诊断年龄为3~23岁。该17例患者均为国外报道病例,通过全外显子测序技术发现17个致病突变点,其中10例为无义突变,7例为移码突变,本例患儿为国内首次报道的移码突变。患者主要临床表现包括婴儿期的喂养困难、早期的生长障碍、痛觉障碍、反复上呼吸道感染、运动障碍、语言障碍、智力障碍、行走迟、全身性肌张力低下、异常行为、癫痫、关节活动度过大、脐疝、斜视/远视,同时具有特殊面容,如张口容貌、高颚弓、下唇唇红外翻、尖下巴、人中短、低位耳、睑裂上斜/下斜、长脸、内眦赘皮、鼻孔前倾/鼻梁扁平、小头畸形。多数患者头颅影像学无特异性改变。
CHAMP1位于染色体13q34处,包含1个编码外显子及2个5'端内含子,编码包含812个氨基酸的锌指蛋白,在胎儿脑发育过程中表达,并在所有胎儿和成年组织中表达,包括特定的脑区域[5],首先在人胚胎肾293(human embryonic kidney 293)细胞中被鉴定为有丝分裂阻滞缺陷样2(mitotic arrest deficient-like 2, MAD2L2)蛋白中间因子。MAD2L2编码的锌指蛋白质是有丝分裂纺锤体装配检查点复合物的一个组成部分,该复合物通过监测有丝分裂中期板染色体的正确排列来调节后期的开始,已被认定为参与智力障碍的候选基因[6]。CHAMP1缺失导致染色体错位和染色体异常分离,可能导致有丝分裂停滞或有丝分裂错误,例如非整倍性。纺锤体定向缺陷和异常功能着丝粒蛋白,如着丝粒蛋白F,与神经系统和脑部疾病有关,包括无脑回畸形和原发性小头畸形,这也可以解释CHAMP1变异个体中观察到的小头畸形[7]。此外,它调节丝粒微管的附着,从而排列染色体正确的位置[8]。影响编码调节染色体排列或纺锤体装配的蛋白质基因的突变是多种综合征和非综合征发育障碍的公认原因,而CHAMP1仅仅是神经功能发育障碍的一个代表性的基因。
本例患儿存在典型的特殊面容,且经全外显子组测序检测及Sanger测序验证,确诊为CHAMP1 c.530delCinsTTT(p.S177Ffs*2),为新生杂合移码突变,结合临床表现及基因检测结果最终确诊为常染色体显性智力障碍40型。其父母有再生育的需求,经Sanger测序验证,患儿父母均未携带该变异,该变异为新发突变,提示该父母再次生育带有相同致病突变基因的孩子的概率较小,同时建议家属再生育时可根据本次基因检测结果进行遗传咨询与产前诊断。
CHAMP1基因是常染色体显性智力障碍40型的致病基因,所有患者均有智力障碍、运动发育障碍,尤其语言障碍是最为突出的问题[9]。尽管大部分患者婴儿期存在喂养困难、生长发育障碍的表现,但随着年龄的增长,喂养困难会逐渐改善,一般体格发育尚可,运动功能会逐渐改善,成年后患者的智力障碍及语言障碍是制约其回归社会的主要原因。因此在患者的康复治疗过程中,智力康复及言语康复始终应作为康复治疗的重点。随着年龄的增长,部分患者会出现行为异常,甚至被诊断为孤独症谱系障碍,因此在早期康复治疗中要定期评估患儿的行为问题,及时进行异常行为的康复治疗。
综上所述,CHAMP1基因突变是导致智力障碍的较罕见突变,常见的临床表现为婴儿期的喂养困难、运动发育迟缓、智力障碍、语言障碍、全身性肌张力低下、听视觉障碍等。对于不明原因智力障碍的患儿,尤其是存在全身性肌张力低下、严重语言障碍者,应考虑CHAMP1基因突变的可能,应尽早进行遗传学检测,明确病因,有助于患儿康复治疗的进行及预后的评估,同时能够为遗传咨询及产前诊断提供依据。
| [1] |
Isidor B, Küry S, Rosenfeld JA, et al. De novo truncating mutations in the kinetochore-microtubules attachment gene CHAMP1 cause syndromic intellectual disability[J]. Hum Mutat, 2016, 37(4): 354-358. (  0) 0) |
| [2] |
Hempel M, Cremer K, Ockeloen CW, et al. De novo mutations in CHAMP1 cause intellectual disability with severe speech impairment[J]. Am J Hum Genet, 2015, 97(3): 493-500. DOI:10.1016/j.ajhg.2015.08.003 (  0) 0) |
| [3] |
Okamoto N, Tsuchiya Y, Kuki I, et al. Disturbed chromosome segregation and multipolar spindle formation in a patient with CHAMP1 mutation[J]. Mol Genet Genomic Med, 2017, 5(5): 585-591. (  0) 0) |
| [4] |
Tanaka AJ, Cho MT, Retterer Kyle, et al. De novo pathogenic variants in CHAMP1 are associated with global developmental delay, intellectual disability, and dysmorphic facial features[J]. Cold Spring Harb Mol Case Stud, 2016, 2(1): a000661. DOI:10.1101/mcs.a000661 (  0) 0) |
| [5] |
Hawrylycz MJ, Lein ES, Guillozet-Bongaarts AL, et al. An anatomically comprehensive Atlas of the adult human brain transcriptome[J]. Nature, 2012, 489(7416): 391-399. DOI:10.1038/nature11405 (  0) 0) |
| [6] |
Gilissen C, Hehir-Kwa JY, Thung DT, et al. Genome sequencing identifies major causes of severe intellectual disability[J]. Nature, 2014, 511(7509): 344-347. DOI:10.1038/nature13394 (  0) 0) |
| [7] |
Waters AM, Asfahani R, Carroll P, et al. The kinetochore protein, CENPF, is mutated in human ciliopathy and microcephaly phenotypes[J]. J Med Genet, 2015, 52(3): 147-156. (  0) 0) |
| [8] |
Itoh G, Kanno S, Uchida KS, et al. CAMP (C13orf8, ZNF828) is a novel regulator of kinetochore-microtubule attachment[J]. EMBO J, 2011, 30(1): 130-144. (  0) 0) |
| [9] |
Deciphering Developmental Disorders Study. Large-scale discovery of novel genetic causes of developmental disorders[J]. Nature, 2015, 519(7542): 223-228. DOI:10.1038/nature14135 (  0) 0) |
 2020, Vol. 22
2020, Vol. 22

