治疗效益与风险的平衡是医生最为关注的问题。如何在提高药物治疗效果的同时管控或减少药物不良反应?在传统医学中,医者主要依靠师徒传授和个人积累的经验,并通过对病人表象辨证而选药施治。同时对所开的药方常作药或量的加减,以求在尝试中达到药效的优化,减少相应的药物不良反应。现代医学注重病原体和致病机制的探究,倡导什么病用什么药。药物用量是基于大规模临床三期试验的平均值,药效的预测也是以群体反应为基础。提高疗效和规避药物不良反应同样是以经验为基础,通过尝试、观察和调整模式来实现。随访和调整模式会导致时机的延误,使病人错过短暂而最佳的治疗窗口。未来医学是基于“组学”的大数据,为个体患者量身定制健康策略,而非取决于群体,后者大多数是由携带野生型基因个体而构成。个体化健康策略能在提高药物疗效和安全性的基础上回归到“合理的药物在恰当的时间用于合适的病人”的基点上,但其依据远非是单一的“号脉观象”,而是通过个体基因组的客观分析。
揭示并理解“个体与疾病、疾病与药物、药物与机体代谢”之间的关联是实现“以人为本”个性化治疗的必要前提。药物不良反应是指合格药品在正常用法用量下出现的与用药目的无关的有害反应,常可分为A型和B型两类。A型又称剂量相关的不良反应,是由药物本身的药理作用增强或延伸所致,常和剂量或合并用药有关。其特点是容易预测,停药或减量后症状减轻或消失,发生率高,病死率低。包括不良反应、毒性作用、后遗作用和停药反应。B型又称剂量不相关的不良反应,是一种和正常药理作用无关,与患者的特异体质有关的异常反应。其特点是常规药理学筛选难以发现,通常很难预测,发生率低,病死率高。其临床表现包括药物变态反应和特异反应等。
药物基因组学是研究基因组、遗传变异和药物反应之间的关系。其目的是通过对病人特异基因位点的检测来预测药物浓度、药物疗效和药物不良反应,以达到个体化治疗、改善人类健康的目的。相关基因可涉及药物动力学,即药物对人体的作用。亦可涉及药代动力学基因,与药物在体内的吸收、分布、代谢和排泄有关。据美国范德比尔特大学一项万余人的药物基因组学研究显示,91%以上的病人在5个检测基因中至少携带1个与药物反应相关的变异[1],其普遍性是不言而喻的。2001~2002年的一项英国研究显示,药物不良反应可占医院入院病例的6.5%[2]。因此,药物不良反应不仅给患者造成新的痛苦,还会增加住院周期,浪费社会医疗资源,已经成为当今一项严重的全球性公共卫生问题。药物基因组学是实施以预防为主的精准医学的重要一环,通过预测保障用药有效性和安全性,让药物治疗走出“同一个诊断,同一个处方”的框架,达到“因人而异” “量体裁衣”的药物干预作用。
1 因人而异,量体择药在日常生活中,我们可观察到人们饮酒后截然不同的反应。有人饮酒后不仅面不改色,而且渐入舒畅和飘逸佳境,而有人却不胜酒力,酒后产生潮红、头晕、头痛、嗜睡、恶心、呕吐和心悸等反应,甚至产生无畏状态。体内的酒精(乙醇)少量可通过呼吸排出,大部分在肝脏代谢。乙醇代谢成乙醛,随后在乙醛脱氢酶2(ALDH2)的作用下转换为乙酸而排出体外。ALDH2是一个自体四聚体蛋白,不同的单体成分可导致不同的酶活性。最常见的ALDH2基因变异发生在第504个氨基酸,即带负电荷的谷氨酸被带正电荷的赖氨酸替代(NM_000690.4:c.1510G > A, NP_000681.2:p.Glu504Lys; rs671),该变异可导致蛋白结构变化而降低酶的活性,杂合子和纯合子携带者的酶活性分别是非携带者的12%和4%[3],变异的ALDH2无法迅速将乙醛转化成乙酸,所有饮酒不适的经历都源于乙醛。在东亚群体中杂合子携带率高达21%~27%,纯合子为4%~6%,而该变异在黑人和白人中几乎不存在[4]。不同的人有不同的酒量,难道不同的人就应该在“千人一方”的框架使用相同药量,并被迫“享受”药物不良反应吗?
ALDH2的突变检测常被列入面向消费者的娱乐性“酒量测定”,实际上对医生来说该检测还有更深层次的临床意义。硝酸甘油是冠心病病人常备药物,在心绞痛发作时,从胸痛发作到获得乙酰水杨酸和硝酸甘油的时间是心脏患者存活的主要预测指标[5]。硝酸甘油抗缺氧作用必须依赖于线粒体ALDH2将硝酸甘油还原成一氧化氮而产生药效,在ALDH2 p.Glu504Lys杂合子冠心病患者中,硝酸甘油的作用仅仅是非携带者的60%[6]。而纯合子冠心病患者对硝酸甘油转化能力比正常人低10倍[7]。在紧急应用硝酸甘油静脉滴注治疗急性心肌缺血或高血压中风时,医生应该了解一下病人的酒量或查阅其ALDH2基因的检测结果,从而确认硝酸甘油是否有效。在为冠心病病人备硝酸甘油前,更应先考虑检测ALDH2基因变异。
晚期肿瘤的靶向治疗充分体现了“合理的药物、在恰当的时机、用于合适的病人”的精准原则。列夫·托尔斯泰有一句至理名言“幸福的家庭都是相似的,而不幸的家庭各有其独特之处”。同样,正常组织的生理功能都是类似的,而癌变的组织却各有其特殊之处。在主流医学中,解剖部位、肿瘤分型、淋巴结转移状况主宰了癌症的诊断和治疗,但这种主流模式完全忽视了癌细胞的基因改变,药物基因组学的实践正在推动肿瘤诊治模式的改变。通过对肿瘤核酸的全面分析,找到驱动性基因改变,展示关键性的肿瘤依赖,体现了合适的病人用特定的药物。在转移性结肠、直肠癌中,联合应用上皮细胞生长因子受体(EGFR) 单克隆抗体治疗是否合理取决于患者肿瘤细胞中RAS和BRAF基因的突变状况。只有在上述基因突变阴性患者中,EGFR单克隆抗体治疗方为合理[8]。在非小细胞性肺癌病人中,能否使用EGFR酪氨酸激酶抑制剂(EGFR TKI)的根据来源于病人是否携带EGFR激活性的驱动突变[9]。肿瘤细胞的DNA改变是体系突变,有别于胚系突变,处于一个动态的过程。随着治疗和病程的进展,患者会出现新的体系突变,如苏氨酸790蛋氨酸突变造成获得性的一代或二代EGFR TKIs耐药[9]。DNA检测能及时发现耐药突变,从而在恰当的时机提示药物更换,启用第三代EGFR TKI奥希替尼。
2 知己知彼,用药不殆此“己”是指我们医生通过临床资料选药和定量的自信,而“彼”则是对病人个体的全面了解,包括药物基因组学的特征。应用药物基因组学的精准工具能有效地指导药物用量。造成药物有效浓度差异的遗传因素可以是种族间的差异,也可以是个体单个和多个基因的变异。群体常规用药剂量基于正常代谢者(图 1),对于活性药物来说,几次服药后可达到疗效浓度,后续用药使药物维持在有效范围之内。在中间和低弱代谢者中,药物灭活功能偏低或低下,所谓常规剂量即可造成药物的迅速累积而超越疗效浓度,达到不良反应水平。而在快速和超快代谢者中,常规剂量很难达到或维持有效治疗浓度。应用硫唑嘌呤或6-巯基嘌呤是一个较为经典例子,该药是治疗儿童急性淋巴细胞白血病常用的基础药物[10-11]。在体内,硫唑嘌呤可转化为6-巯基嘌呤,继而在硫嘌呤甲基转移酶(TPMT)的作用下失活成为6-甲基巯基嘌呤。作为6-巯基嘌呤的代谢产物,硫鸟嘌呤核苷酸可造成核酸复制和转录的异常,其生物活性也受到TPMT活性的影响。在TPMT功能缺失患者中,由于无法及时灭活上述药物,相当于常规药物剂量被放大了10~15倍,从而会造成严重的药源性骨髓抑制[12]。相反,在TPMT超快代谢患者中,硫唑嘌呤常规剂量治疗难以达到预期的治疗目的,可增加白血病的复发率。
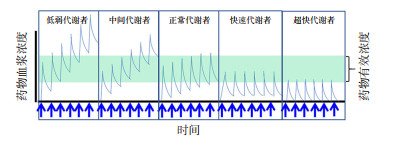
|
图 1 药物在体内经代谢而失活的个体差异 横轴是时间,每一箭头代表服药。纵轴为用药后的药物血浆浓度,绿色条带为药物有效浓度。 |
TPMT活性在欧裔群体中有90%的无效等位基因与3个单核苷酸变异(rs1800462、rs1800460和rs1142345)相关,这些等位基因杂合的患者具有中间酶活性,而纯合子或复合杂合患者则无酶活性[12]。虽然这3个变异在东亚群体中极为罕见[4],但是白细胞减少在东亚群体中同样是6-巯基嘌呤不耐受的主要原因。进一步研究发现,影响东亚群体硫唑嘌呤代谢的是Nudix水解酶15(NUDT15),它是硫嘌呤活化和毒性的负调节剂,其单核苷酸变异(NM_018283.4:c.415C > T、NP_060753.1:p.Arg139Cys、rs116855232)可导致硫嘌呤的代谢异常[10-12],约22%的巯基嘌呤耐受变量可归因于该变异[10]。在东亚群体中,该变异杂合子和纯合子携带率分别达10%和1.2%[4]。纯合子携带者对6-巯基嘌呤非常敏感,仅能耐受8%的标准剂量[12]。TPMT和NUDT15对硫唑嘌呤代谢的影响也提示不同种族会有特殊的药物基因改变,深入研究与祖先相关的基因变异可推动针对特殊族群的精准医学发展。
对非活性药物(前体药物)来说,低弱代谢者由于转化不足难以达到疗效浓度。超快代谢者可因转化过快而造成药物不良反应。可待因就是一种前体药物,它在体内经过细胞色素P450的CYP2D6酶的作用而生成吗啡并产生镇痛功能。CYP2D6具有丰富的基因剂量多态性,并影响众多的临床药物的代谢和生物激活。常见基因在个体中均携带两个拷贝(称双倍体),即来源父母的单倍体各一个。而CYP2C6基因除DNA序列突变外,其单倍体也可出现基因缺失、单个、两个或4个拷贝,从而造成个体表型的差异[13-14]。在个体双倍体CYP2D6基因缺失(全球频率0.4%~5.4%)和单个基因(全球频率0.4%~11%)低弱和中间代谢患者的体内,CYP2D6酶的活性评分分别为0和0.5。由于无法转化或转化减少使可待因难以达到预期的镇痛作用。而在个体携带3~5个或更多CYP2D6基因拷贝(全球频率1%~21%)的超快代谢者中(活性评分 > 2),可待因会过快地转化为吗啡。大剂量吗啡可造成呼吸抑制甚至死亡的严重后果[15]。在儿科领域,儿童会因阻塞性睡眠呼吸暂停综合征而进行扁桃体切除术,术后会使用可待因类药物。用药前如果不做药物基因组学检测,可能导致呼吸系统损害、呼吸抑制,甚至死亡[15-16]。美国FDA不建议在12岁以下或所有扁桃体切除术后的儿童应用可待因类药物[17]。同样,将可待因类药物用于哺乳期母亲时也必须考虑药物基因组学检测,CYP2D6基因超快代谢哺乳期母亲可将已被代谢成吗啡的可待因通过母乳被婴儿摄入,从而可造成婴儿中枢神经抑制,表现为睡眠时间过长、昏睡而遗忘进食、吸吮功能低下和体重增加不良等症状。通过母乳摄入的吗啡甚至可造成婴儿呼吸抑制[18]。
药物不良反应在儿科病人中会给家庭和患儿带来压力和不确定性,并可能对医生和患儿及家之间的关系产生负面影响。在药物治疗注意缺陷多动障碍(ADHD)和孤独症谱系障碍患儿领域,药物基因组学的知识应用已备受关注。儿茶酚胺氧甲基转移酶(COMT)是使循环儿茶酚胺失活的一种主要酶,其V158M变异(NM_000754.3:c.472G > A, NP_000745.1:p.Val158Met; rs4680)可降低40%酶活性[19],从而造成脑内突触儿茶酚胺含量升高。儿茶酚胺是青少年多动症药物治疗的靶点,在一些ADHD治疗研究中发现COMT V158M变异可预测治疗反应。变异携带者与中枢神经兴奋剂哌甲酯治疗反应降低有关[20-21]。在非中枢神经兴奋剂托莫西汀治疗ADHD时,CYP2D6的低弱代谢患儿虽然有显著的疗效,但由于高药物浓度使患儿更多地出现诸如心率加速、血压升高和体重增加减缓等不良反应[22]。通过药物基因组学检测来预测药物不良反应,有助于改善医患关系,并提高药物治疗的依从性和临床疗效。
3 研读解码,暗箭可防DNA测序技术的发展极大地降低了外显子组或全基因组测序的成本和时间,如何应用“组学”的大数据并结合临床需求对获得的DNA序列进行解读是临床医生面临的挑战,也是预防小概率但伴高致死率药物不良反应的关键。恶性高热就是一种潜在的、致命性的药物不良反应,通常是由吸入性麻醉剂(氟烷、恩氟烷等)或去极化肌肉松弛剂而诱发。病因是患者携带遗传易感基因,如兰尼碱受体(RYR1)突变。兰尼碱受体是存在于内质网和肌浆网上的一种钙释放通道,能迅速释放钙离子而产生一系列的生理功能。突变使钙离子通道无法正常关闭,而导致肌肉僵直、复合性的代谢和呼吸性酸中毒、体温升高、心动过速和心律失常、高钾血症、横纹肌溶解和恶性高热,若不及时干预可导致多脏器功能衰竭和死亡[23]。估计恶性高热易感基因携带率可高达1/400。在麻醉病人中,其发生率约万分之一至25万分之一[24-25]。虽然兰尼碱受体基因转录本长达15 000多个碱基,蛋白产物有5 038个氨基酸,但在大规模平行测序时代,麻醉前予以测序检测是可行的,通过研读解码相关序列,预防恶性高热发生是可能的。
目前预测非剂量相关(B型)药物不良反应的能力有限,但并非不可能。癫痫是一种以大脑神经元异常放电而引起反复和短暂发作为特征的慢性神经系统疾病,可影响0.5%~1%的儿童。在10岁时,癫痫的累计发病率可达0.66%,是儿童期最常见的神经系统疾病[26]。在世界范围内,卡马西平是用于控制局灶性癫痫发作的一线治疗药物,适用于大多数癫痫发作类型。同时卡马西平还用于缓解某些类型的神经痛(例如三叉神经痛)。然而,卡马西平可导致严重的不良反应,如重症多形红斑型药疹,又称史-约综合征(Stevens-Johnson syndrome, SJS)[27]。重症SJS患者的病情重、进展快,常由于继发感染,水、电解质紊乱,多脏器功能衰竭等危及生命。SJS可引起严重的结膜炎、虹膜炎、眼内发炎、角膜水泡和糜烂和角膜孔,其并发症可致残,造成视力丧失。因此,当选用卡马西平治疗时,尤其是汉族和东南亚儿童,应该做药物基因组学检测,避免用于高危组织相容性抗原HLA-B*15 : 02携带患儿。该类组织相容性抗原在亚裔群体中可高达6.88%,而欧裔群体中仅为0.04%,已知的高危组织相容性抗原还包括HLA-A*31 : 01和HLA-B*58:01[28]。高危相容性抗原是引起超敏反应的必要条件,但非充分条件。通过药物基因组学的检测选药,至少可以减少SJS的发生率[29]。
4 展望为了达到最佳药效、降低或规避药物的不良反应,临床医生首先应该勇于接纳迅速发展的精准医学,通过医学专业的职业后继续教育学习药物基因组学的知识,掌握药物基因组学的工具,让不同种族和不同个体差异植根于临床一线的实践。其次,探索自己所面对患者群体的种族和个体的基因组差异,开展真正的、亟需的临床研究,推动药物基因组学的发展。譬如,研发一组能指导常见病和慢性病用药的药物基因组合,在个体无病、无需用药的情况下提供所谓“先发制性的基因检测”[1],将有关药物基因组学结果存于云端数据库。在需要时,能让全国乃至全球医生拿到与药物治疗相关的遗传数据,迅速而准确地找到能让病人获益的特定药物。最后制定实施选药和择量的精准策略,让病人在有效的疾病控制的同时能免受药物不良反应的二次打击。
药效和药物不良反应的关系是相当复杂的,单基因变异只是冰山显露在水面上的一小部分,在水面下的冰山中还有许多未知部分。华法令的药效和药物不良反应正是药物动力学(CYP2C9和CYP4F2)和药代动力学(VKORC1)等多种基因交互作用的结果[30-31],据估计华法令有50%的用量差异是源于有关基因的遗传变异。目前的药物基因组学的检测和解读尚未达到尽善尽美的阶段,尤其在儿科病人中,药物吸收、分布、代谢和排泄及药物疗效还受到生长发育的影响[32]。如细胞色素P450 2C19活性在6个月时可达成人水平,在2~4岁时该酶的活性升至峰值,约为成人活性的1.5~1.8倍,然后在青春期后再回落至成人水平。同样,环境因素,如抽烟、抗酸药物和饮用可乐,都会影响EGFR酪氨酸激酶抑制剂的吸收、血浆药物浓度和抗癌效果[33],这些因素的参与可造成预测的偏移。因此,必需加强临床研究,充分利用所掌握的药物基因组学的知识,建立更有效的多因素算法、并与机器学习相结合,开发出一种对多基因、基因与基因、基因与环境等复杂的交互作用进行精准预测和预警方法,让患者能尽早地、更多地享受药物基因组学发展的成果。
| [1] |
Van Driest SL, Shi Y, Bowton EA, et al. Clinically actionable genotypes among 10, 000 patients with preemptive pharmaco-genomic testing[J]. Clin Pharmacol Ther, 2014, 95(4): 423-431. DOI:10.1038/clpt.2013.229 (  0) 0) |
| [2] |
Pirmohamed M, James S, Meakin S, et al. Adverse drug reactions as cause of admission to hospital: prospective analysis of 18 820 patients[J]. BMJ, 2004, 329(7456): 15-19. DOI:10.1136/bmj.329.7456.15 (  0) 0) |
| [3] |
Weiner H, Wei B, Zhou J. Subunit communication in tetrameric class 2 human liver aldehyde dehydrogenase as the basis for half-of-the-site reactivity and the dominance of the oriental subunit in a heterotetramer[J]. Chem Biol Interact, 2001, 130-132(1-3): 47-56. (  0) 0) |
| [4] |
gnomAD. Genome aggregation database[DB/OL]. [2020-06-01]. https://gnomad.broadinstitute.org/.
(  0) 0) |
| [5] |
O'Gara PT, Kushner FG, Ascheim DD, et al. 2013 ACCF/AHA guideline for the management of ST-elevation myocardial infarction: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines[J]. J Am Coll Cardiol, 2013, 61(4): e78-e140. DOI:10.1016/j.jacc.2012.11.019 (  0) 0) |
| [6] |
Mackenzie IS, Maki-Petaja KM, Mceniery CM, et al. Aldehyde dehydrogenase 2 plays a role in the bioactivation of nitroglycerin in humans[J]. Arterioscler Thromb Vasc Biol, 2005, 25(9): 1891-1895. DOI:10.1161/01.ATV.0000179599.71086.89 (  0) 0) |
| [7] |
Li Y, Zhang D, Jin W, et al. Mitochondrial aldehyde dehydro-genase-2 (ALDH2) Glu504Lys polymorphism contributes to the variation in efficacy of sublingual nitroglycerin[J]. J Clin Invest, 2006, 116(2): 506-511. DOI:10.1172/JCI26564 (  0) 0) |
| [8] |
Douillard JY, Oliner KS, Siena S, et al. Panitumumab-FOLFOX4 treatment and RAS mutations in colorectal cancer[J]. N Engl J Med, 2013, 369(11): 1023-1034. DOI:10.1056/NEJMoa1305275 (  0) 0) |
| [9] |
Westover D, Zugazagoitia J, Cho BC, et al. Mechanisms of acquired resistance to first- and second-generation EGFR tyrosine kinase inhibitors[J]. Ann Oncol, 2018, 29(suppl_1): i10-i19. (  0) 0) |
| [10] |
Yang JJ, Landier W, Yang W, et al. Inherited NUDT15 variant is a genetic determinant of mercaptopurine intolerance in children with acute lymphoblastic leukemia[J]. J Clin Oncol, 2015, 33(11): 1235-1242. DOI:10.1200/JCO.2014.59.4671 (  0) 0) |
| [11] |
Moriyama T, Nishii R, Perez-Andreu V, et al. NUDT15 polymorphisms alter thiopurine metabolism and hematopoietic toxicity[J]. Nat Genet, 2016, 48(4): 367-373. DOI:10.1038/ng.3508 (  0) 0) |
| [12] |
Relling MV, Schwab M, Whirl-Carrillo M, et al. Clinical pharmacogenetics implementation consortium guideline for thiopurine dosing based on TPMT and NUDT15 genotypes: 2018 update[J]. Clin Pharmacol Ther, 2019, 105(5): 1095-1105. DOI:10.1002/cpt.1304 (  0) 0) |
| [13] |
Hosono N, Kato M, Kiyotani K, et al. CYP2D6 genotyping for functional-gene dosage analysis by allele copy number detection[J]. Clin Chem, 2009, 55(8): 1546-1554. DOI:10.1373/clinchem.2009.123620 (  0) 0) |
| [14] |
Del Tredici AL, Malhotra A, Dedek M, et al. Frequency of CYP2D6 alleles including structural variants in the United States[J]. Front Pharmacol, 2018, 9: 305. DOI:10.3389/fphar.2018.00305 (  0) 0) |
| [15] |
Ciszkowski C, Madadi P, Phillips MS, et al. Codeine, ultrarapid-metabolism genotype, and postoperative death[J]. N Engl J Med, 2009, 361(8): 827-828. DOI:10.1056/NEJMc0904266 (  0) 0) |
| [16] |
Kelly LE, Rieder M, van den Anker J, et al. More codeine fatalities after tonsillectomy in North American children[J]. Pediatrics, 2012, 129(5): e1343-e1347. DOI:10.1542/peds.2011-2538 (  0) 0) |
| [17] |
Kuehn BM. FDA: no codeine after tonsillectomy for children[J]. JAMA, 2013, 309(11): 1100. (  0) 0) |
| [18] |
Kelly LE, Chaudhry SA, Rieder MJ, et al. A clinical tool for reducing central nervous system depression among neonates exposed to codeine through breast milk[J]. PLoS One, 2013, 8(7): e70073. DOI:10.1371/journal.pone.0070073 (  0) 0) |
| [19] |
Lachman HM, Papolos DF, Saito T, et al. Human catechol-O-methyltransferase pharmacogenetics: description of a functional polymorphism and its potential application to neuropsychiatric disorders[J]. Pharmacogenetics, 1996, 6(3): 243-250. DOI:10.1097/00008571-199606000-00007 (  0) 0) |
| [20] |
Froehlich TE, Epstein JN, Nick TG, et al. Pharmacogenetic predictors of methylphenidate dose-response in attention-deficit/hyperactivity disorder[J]. J Am Acad Child Adolesc Psychiatry, 2011, 50(11): 1129-1139.e2. DOI:10.1016/j.jaac.2011.08.002 (  0) 0) |
| [21] |
Kereszturi E, Tarnok Z, Bognar E, et al. Catechol-O-methyltransferase Val158Met polymorphism is associated with methylphenidate response in ADHD children[J]. Am J Med Genet B Neuropsychiatr Genet, 2008, 147B(8): 1431-1435. DOI:10.1002/ajmg.b.30704 (  0) 0) |
| [22] |
Michelson D, Read HA, Ruff DD, et al. CYP2D6 and clinical response to atomoxetine in children and adolescents with ADHD[J]. J Am Acad Child Adolesc Psychiatry, 2007, 46(2): 242-251. DOI:10.1097/01.chi.0000246056.83791.b6 (  0) 0) |
| [23] |
Gonsalves SG, Dirksen RT, Sangkuhl K, et al. Clinical pharmacogenetics implementation consortium (CPIC) guideline for the use of potent volatile anesthetic agents and succinylcholine in the context of RYR1 or CACNA1S genotypes[J]. Clin Pharmacol Ther, 2019, 105(6): 1338-1344. DOI:10.1002/cpt.1319 (  0) 0) |
| [24] |
Ording H. Investigation of malignant hyperthermia susceptibility in Denmark[J]. Dan Med Bull, 1996, 43(2): 111-125. (  0) 0) |
| [25] |
Litman RS, Rosenberg H. Malignant hyperthermia: update on susceptibility testing[J]. JAMA, 2005, 293(23): 2918-2924. DOI:10.1001/jama.293.23.2918 (  0) 0) |
| [26] |
Aaberg KM, Gunnes N, Bakken IJ, et al. Incidence and prevalence of childhood epilepsy: a nationwide cohort study[J]. Pediatrics, 2017, 139(5): e20163908. DOI:10.1542/peds.2016-3908 (  0) 0) |
| [27] |
Chung WH, Hung SI, Hong HS, et al. Medical genetics: a marker for Stevens-Johnson syndrome[J]. Nature, 2004, 428(6982): 486. DOI:10.1038/428486a (  0) 0) |
| [28] |
Phillips EJ, Sukasem C, Whirl-Carrillo M, et al. Clinical pharmacogenetics implementation consortium guideline for HLA genotype and use of carbamazepine and oxcarbazepine: 2017 update[J]. Clin Pharmacol Ther, 2018, 103(4): 574-581. DOI:10.1002/cpt.1004 (  0) 0) |
| [29] |
Chen P, Lin JJ, Lu CS, et al. Carbamazepine-induced toxic effects and HLA-B*1502 screening in Taiwan[J]. N Engl J Med, 2011, 364(12): 1126-1133. DOI:10.1056/NEJMoa1009717 (  0) 0) |
| [30] |
Johnson JA, Caudle KE, Gong L, et al. Clinical pharmacogenetics implementation consortium (CPIC) guideline for pharmacogenetics-guided warfarin dosing: 2017 update[J]. Clin Pharmacol Ther, 2017, 102(3): 397-404. DOI:10.1002/cpt.668 (  0) 0) |
| [31] |
Takeuchi F, Mcginnis R, Bourgeois S, et al. A genome-wide association study confirms VKORC1, CYP2C9, and CYP4F2 as principal genetic determinants of warfarin dose[J]. PLoS Genet, 2009, 5(3): e1000433. DOI:10.1371/journal.pgen.1000433 (  0) 0) |
| [32] |
van den Anker J, Reed MD, Allegaert K, et al. Developmental changes in pharmacokinetics and pharmacodynamics[J]. J Clin Pharmacol, 2018, 58(Suppl 10): S10-S25. (  0) 0) |
| [33] |
van Leeuwen RW, Peric R, Hussaarts KG, et al. Influence of the acidic beverage cola on the absorption of erlotinib in patients with non-small-cell lung cancer[J]. J Clin Oncol, 2016, 34(12): 1309-1314. DOI:10.1200/JCO.2015.65.2560 (  0) 0) |
 2020, Vol. 22
2020, Vol. 22

