2. 南京医科大学附属第四临床医学院, 江苏 南京 210000
新生儿高胆红素血症是一种常见的临床病症,大约60%的足月儿在生后1周内会出现临床可见的黄疸[1]。新生儿高胆红素血症的发生率逐年上升,过高的血清胆红素可以通过血脑屏障干扰神经细胞的正常代谢,造成神经系统功能紊乱引起胆红素脑病[2-3]。光疗是临床上新生儿高胆红素血症最常用的治疗方法,可有效降低血清未结合胆红素,预防胆红素脑病的发生。但光疗也存在不良反应,近期不良反应包括影响母婴互动、体温失衡、水分丢失和电解质紊乱、生理节律紊乱[4-5]及青铜婴儿综合征[6-7]等。此外,光疗可能与视网膜损伤、1型糖尿病和哮喘等远期不良反应相关[8]。因此使用光疗时,必须经过充分的考虑和有充足的理由[9]。
由于新生儿生后第1周肠道内细菌相对缺乏,结合胆红素转变为尿胆原和粪胆原的比例小,导致血清胆红素水平增高,这一方面与肠道内β-葡萄糖醛酸苷酶(β-glucuronidase, β-GD)的作用增加了胆红素的肠肝循环有关,另一方面与近端小肠弱碱性的pH值有关[10]。给予微生物制剂,比如益生菌,一方面可以降低肠道pH值,改善小肠有规律肌肉收缩的质量,增加肠细胞有丝分裂率,还可以调节肠道菌群限制β-GD的作用而减少肠肝循环[11]。
益生菌治疗对于研究者和临床工作者是一个新的领域,如果它对新生儿高胆红素血症患儿胆红素水平下降和光疗治疗效果的影响被确定,益生菌将会被用于该病的预防和治疗,对减少住院时间,减轻治疗的不良反应等可能有积极的作用。本研究旨在分析比较高胆红素血症新生儿光疗联合口服布拉氏酵母菌治疗前后肠道菌群分布特点和差异,观察治疗后新生儿胆红素水平下降及治疗后黄疸反复情况,并与单纯给予光疗治疗组进行比较,旨在探讨光疗联合口服布拉氏酵母菌治疗新生儿高胆红素血症的疗效,明确新生儿高胆红素血症与肠道微生态系统之间的关系,为相关菌群干预治疗的应用提供基础。
1 资料与方法 1.1 研究对象2018年1~12月入住江苏大学附属医院新生儿科的高胆红素血症新生儿作为研究对象。本研究已通过江苏大学附属医院伦理审查(审查号:SWYXLL20200429-4),并签署家属知情同意书。
参考《新生儿高胆红素血症诊断和治疗专家共识》中光疗指征确定纳入标准[12]:(1)新生儿母亲为初产妇,年龄20~35岁,无妊娠高血压综合征、肾病、贫血及糖尿病等妊娠合并症;(2) 胎儿经阴道分娩,出生时无产伤窒息,Apgar评分正常,出生体重2 500~4 000 g,胎龄37~42周,生后半小时开奶,纯母乳喂养;(3)生后3~5 d皮肤出现黄染,血清总胆红素超过Bhutani曲线第95百分位数,非结合胆红素占总胆红素的80%以上。出生时或生后伴有呼吸窘迫、头颅血肿、颅内出血、新生儿自然出血症、咽下综合征、感染性疾病等新生儿疾病者予以排除。最终有124例新生儿纳入本研究,利用电脑生成的顺序数随机分为2组:观察组(61例)和对照组(63例)。分组人员不参与新生儿的治疗和护理过程。
1.2 研究方法纳入研究的所有患儿入院后即给予光疗,当血清总胆红素水平降低到222 μmol/L(13 mg/dL)时停止光疗[12],高于该水平再次给予光疗。对于观察组患儿,除给予光疗外,同时给予布拉氏酵母菌散(法国百科达制药厂;进口药品注册证号:S20150051;每袋装药粉765 mg,含菌粉250 mg;每1 g药粉含活菌数不低于1.3×109 CFU)口服,每次1袋,加入1 mL蒸馏水混匀,每24 h 1次,直至出院。对照组除给予光疗外,予以安慰剂口服(蒸馏水,每24 h 1次,每次1 mL)。
测定治疗24、48、72 h后3个时间点血清胆红素水平,监测光疗的持续时间,以及需要再次给予光疗的患儿比例。
1.3 标本采集采集观察组和对照组患儿入组时及治疗24、48、72 h后的血标本进行肝功能检测。粪便标本于治疗后72 h采集,-80℃保存备用,以进行肠道菌群检测。
1.4 肠道菌群检测16s rRNA高通量测序:选用美国MoBio公司PowerSoil-htp 96 Well Soil DNA Isolation Kit试剂盒对样本的基因组DNA进行提取,之后采用Onedrop仪器和琼脂糖凝胶电泳检测DNA的纯度和浓度,V3~V4区扩增后利用Illumina Miseq测序平台测序,然后进行生物信息学分析。首先对原始数据进行拼滤,得到有效数据,然后基于有效数据进行Operational Taxonomic Units(OTUs)聚类和物种分类分析,并将OTUs和物种注释结合,从而得到每个样品的OTUs和分类谱系的基本分析结果,再对OTUs进行丰度分析。菌群属水平相对丰度=该菌的基因拷贝数/总拷贝数。
1.5 统计学分析采用SPSS 16.0统计学软件对数据进行统计学分析。非正态分布的计量资料以中位数(四分位数间距)[M(P25, P75)]表示,两组间比较采用Mann-Whitney U检验。组间所有样本菌群差异比较采用主成分分析(PCA)。正态分布的计量资料用均数±标准差(x±s)表示,组间比较采用两样本t检验。计数资料用例数和百分率(%)表示,组间比较采用卡方检验。P < 0.05为差异有统计学意义。
2 结果 2.1 两组一般资料的比较观察组61例新生儿中,男27例,女34例;对照组63例新生儿中,男29例,女34例。两组新生儿性别、胎龄、出生体重的比较差异均无统计学意义(P > 0.05),见表 1。
| 表 1 两组一般资料的比较 |
|
|
两组新生儿治疗前血清总胆红素水平的比较差异无统计学意义(P > 0.05);观察组治疗后24、48、72 h后血清总胆红素水平显著低于对照组(P < 0.05),见表 2。观察组光疗持续时间为(21±6)h,对照组为(26±9)h,两组比较差异无统计学意义(t=1.23,P=0.221)。观察组12例(20%)需要再次给予光疗,对照组为47例(75%),两组比较差异有统计学意义(χ2=44.173,P < 0.001)。治疗过程观察组新生儿均未发生益生菌可能引起的不良反应(胃肠道不耐受、腹胀、腹泻、呕吐、败血症等)。
| 表 2 治疗前后两组血清总胆红素水平的比较 |
|
|
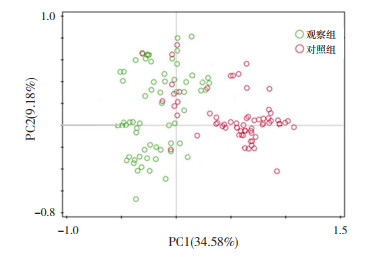
观察组和对照组治疗后72 h肠道菌群PCA分析显示,观察组和对照组新生儿肠道菌群存在明显差异,见图 1。
|
图 1 观察组和对照组肠道菌群的PCA分析 图中每个点代表一个样本,点间距离越小,肠道菌群越相似,点间距离越大,肠道菌群构成差异越明显。可看出两组新生儿肠道菌群组成差别很大。PC1表示第一主成分,34.58%表示第一主成分对样品差异的贡献值;PC2表示第二主成分,9.18%表示第二主成分对样品差异的贡献值。 |
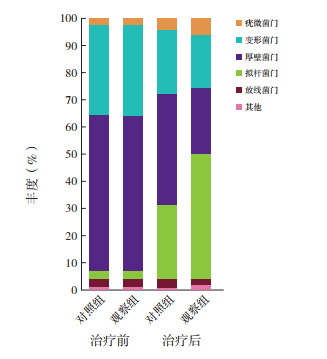
选取了条带数大于20 000的样本进行分析,观察组和对照组治疗前后肠道菌群均主要由厚壁菌门、变形菌门、拟杆菌门、放线菌门和疣微菌门这5门构成,见图 2。治疗72 h后两组新生儿肠道菌群在门水平上厚壁菌门和变形菌门相对丰度均降低,且观察组降低程度更明显,而拟杆菌门的丰度均增高,且观察组增高程度更明显(图 2)。属水平上观察组肠道内拟杆菌丰度较对照组高(P < 0.05),而大肠埃希菌和葡萄球菌丰度较对照组低(P < 0.05),见表 3。
|
图 2 治疗前后肠道菌群门水平相对丰度柱形图 |
| 表 3 对照组和观察组治疗后肠道菌群属水平丰度的比较 |
|
|
本研究显示,观察组和对照组两组治疗前的血清总胆红素水平比较差异无统计学意义;观察组治疗24、48、72 h后血清总胆红素水平显著低于对照组;观察组需再次给予光疗的比例显著低于对照组。这提示光疗联合布拉氏酵母菌对降低高胆红素血症新生儿血清胆红素水平的作用优于单独光疗,减少黄疸反复的效果也更显著。Liu等[13]将68例黄疸足月新生儿随机分为对照组和观察组,观察组采用光疗联合益生菌治疗,结果发现观察组较仅予以光疗的对照组降低血清胆红素水平的作用更显著。Serce等[14]在119例胎龄35周以上接受光疗的新生儿中进行的一项随机对照试验表明,布拉氏酵母菌对高胆红素血症的临床病程没有显著影响,光疗期间降低了血清胆红素水平,但结果没有统计学意义。
本研究肠道菌群分析表明,观察组和对照组新生儿在治疗72 h后肠道菌群存在明显差异,观察组拟杆菌属丰度较高,而大肠埃希氏菌属和葡萄球菌属丰度在对照组较高。新生儿出生早期由于胃肠道菌群的延迟和不充分定居,参与胆红素代谢的微生物群相对较少,非结合胆红素在肠道内积累经历了持续的肠肝循环和肠内循环导致血清胆红素水平增高。有研究报道,早期新生儿阶段的肠道富含氧气,最先定植的是需氧菌和兼性厌氧菌,如大肠杆菌、葡萄球菌等[15-16]。随着时间的推移,婴儿肠道内菌群种类由需氧菌和兼性厌氧菌向厌氧菌转变,如双歧杆菌、乳酸杆菌等[17-18]。高胆红素血症的发病机制除了胆红素生成过多[19],肠道内β-GD含量和活性增高也是一个重要因素。β-GD在肠道内可将结合胆红素转变成未结合胆红素,由肠黏膜吸收,重新回到肝脏,导致血清胆红素水平增高。布拉氏酵母菌属于兼性厌氧菌,在胃肠道不被吸收,同时天然耐胃酸和胆汁,摄入后布拉氏酵母菌分布于整个消化道。布拉氏酵母菌是一种需氧菌,具有抗菌作用,可以直接吸附具有鞭毛的细菌,还能够消耗肠道内氧气,使得大肠埃希菌属[20-21]和葡萄球菌属[22-23]这类需氧和兼性需氧菌在肠道内含量下降,而拟杆菌属这类专性厌氧的小杆菌在肠道内含量增加[24-25]。Wallace等[26]发现这些肠道菌群在体内产生的β-GD酶分为两种类型:具有完整细胞环的β-GD酶(L-β-GD)和不具有完整细胞环的β-GD酶(NL-β-GD)。大肠埃希菌属在门水平上属于变形杆菌,葡萄球菌在门水平上属于厚壁菌门,这两种在对照组肠道内丰度相比观察组增高的细菌在体内产生L-β-GD,而观察组新生儿肠道内优势菌拟杆菌属于拟杆菌门,在体内产生NL-β-GD。L-β-GD具有完整的细菌环,能够发挥酶的作用,能够分解胆红素-葡萄糖醛酸酯之间连接的酯链,使肠道内的结合胆红素转化为未结合胆红素,而未结合胆红素是一种脂溶性的非极性物质,易于在小肠部位重新吸收进入肠肝循环,使得血清中胆红素水平增高[27]。β-GD数量和结构的差异影响了肠肝循环和血清胆红素水平;布拉氏酵母菌散可降低肠道内pH值,直接降低肠道内β-GD活性,减少肠道中结合胆红素的分解;另外,布拉氏酵母菌散能调节肠道蠕动,增加大便次数,起到促进胆红素代谢,降低胆红素水平的作用[28]。因此,我们认为,布拉氏酵母菌散可能通过调节肠道菌群,改变了肠道内β-GD的含量和活性,影响了胆红素的肠肝循环,从而引起血清胆红素水平的变化。
综上,光疗联合布拉氏酵母菌治疗对于降低高胆红素血症新生儿胆红素水平及预防黄疸退而复现有较好的疗效。布拉氏酵母菌散可能通过调节肠道菌群影响了胆红素的肠肝循环,从而引起血清胆红素水平的变化。但是,光疗中添加益生菌如何造成菌群差异及差异肠道菌群如何在肠道内作用导致血清胆红素水平变化的机制仍需要进一步深入研究。后期将通过宏基因组测序和代谢组学等方法分析肠道微生态的具体作用机制,有望在单一肠道菌群的研究和设计合成菌上取得一定突破,对于新生儿高胆红素血症更加有效的治疗具有指导意义。
利益冲突声明:所有作者均声明不存在利益冲突。
| [1] |
Bhutani VK, Vilms RJ, Hamerman-Johnson L. Universal bilirubin screening for severe neonatal hyperbilirubinemia[J]. J Perinatol, 2010, 30(Suppl 1): S6-S15. (  0) 0) |
| [2] |
Najati N, Gharebaghi MM, Mortazavi F. Underlying etiologies of prolonged icterus in neonates[J]. Pak J Biol Sci, 2010, 13(14): 711-714. (  0) 0) |
| [3] |
Henny-Harry C, Trotman H. Epidemiology of neonatal jaundice at the University Hospital of the West Indies[J]. West Indian Med J, 2012, 61(1): 37-42. (  0) 0) |
| [4] |
Dollberg S, Atherton HD, Hoath SB. Effect of different phototherapy lights on incubator characteristics and dynamics under three modes of servocontrol[J]. Am J Perinatol, 1995, 12(1): 55-60. (  0) 0) |
| [5] |
Maayan-Metzger A, Yosipovitch G, Hadad E, et al. Transepidermal water loss and skin hydration in preterm infants during phototherapy[J]. Am J Perinatol, 2001, 18(7): 393-396. (  0) 0) |
| [6] |
Kopelman AE, Brown RS, Odell GB. The "bronze" baby syndrome: a complication of phototherapy[J]. J Pediatr, 1972, 81(3): 466-472. (  0) 0) |
| [7] |
Rubaltelli FF, Jori G, Reddi E. Bronze baby syndrome: a new porphyrin-related disorder[J]. Pediatr Res, 1983, 17(5): 327-330. (  0) 0) |
| [8] |
Aspberg S, Dahlquist G, Kahan T, et al. Is neonatal phototherapy associated with an increased risk for hospitalized childhood bronchial asthma?[J]. Pediatr Allergy Immunol, 2007, 18(4): 313-319. (  0) 0) |
| [9] |
Martin CR, Cloherty JP. Neonatal hyperbilirubinemia[M]// Cloherty JP, Eichenwald EC, Stark AR. Manual of Neonatal Care. 6th ed. Philadelphia PA: Lippincott Williams and Wilkins, 2008: 201.
(  0) 0) |
| [10] |
Singh M. Jaundice: Care of the Newborn[M]. 7th ed. New Delhi: Sagar Publication, 2010: 254-274.
(  0) 0) |
| [11] |
Demirel G, Celik IH, Erdeve O, et al. Impact of probiotics on the course of indirect hyperbilirubinemia and phototherapy duration in very low birth weight infants[J]. J Matern Fetal Neonatal Med, 2013, 26(2): 215-218. (  0) 0) |
| [12] |
中华医学会儿科学分会新生儿学组, 《中华儿科杂志》编辑委员会. 新生儿高胆红素血症诊断和治疗专家共识[J]. 中华儿科杂志, 2014, 52(10): 745-748. (  0) 0) |
| [13] |
Liu W, Liu H, Wang T, et al. Therapeutic effects of probiotics on neonatal jaundice[J]. Pak J Med Sci, 2015, 31(5): 1172-1175. (  0) 0) |
| [14] |
Serce O, Gursoy T, Ovali F, et al. Effects of Saccharomyces boulardii on neonatal hyperbilirubinemia: a randomized controlled trial[J]. Am J Perinatol, 2015, 30(2): 137-142. (  0) 0) |
| [15] |
Jiménez E, Marín ML, Martín R, et al. Is meconium from healthy newborns actually sterile?[J]. Res Microbiol, 2008, 159(3): 187-193. (  0) 0) |
| [16] |
Palmer C, Bik EM, DiGiulio DB, et al. Development of the human infant intestinal microbiota[J]. PLoS Biol, 2007, 5(7): e177. (  0) 0) |
| [17] |
Leser TD, Amenuvor JZ, Jensen TK, et al. Culture-independent analysis of gut bacteria: the pig gastrointestinal tract microbiota revisited[J]. Appl Environ Microbiol, 2002, 68(2): 673-690. (  0) 0) |
| [18] |
Dave M, Higgins PD, Middha S, et al. The human gut microbiome: current knowledge, challenges, and future directions[J]. Transl Res, 2012, 160: 246-257. (  0) 0) |
| [19] |
陈昌辉, 吴青, 李茂军. 新生儿黄疸的诊治及其相关问题[J]. 实用儿科临床杂志, 2011, 26(14): 1132-1136. (  0) 0) |
| [20] |
Foster TJ, Geoghegan JA, Ganesh VK, et al. Adhesion, invasion and evasion: the many functions of the surface proteins of Staphylococcus aureus[J]. Nat Rev Microbiol, 2014, 12(1): 49-62. (  0) 0) |
| [21] |
Winstel V, Missiakas D, Schneewind O. Staphylococcus aureus targets the purine salvage pathway to kill phagocytes[J]. Proc Natl Acad Sci U S A, 2018, 115(26): 6846-6851. (  0) 0) |
| [22] |
Creech CB, Frenck RW, Sheldon EA, et al. Safety, tolerability and immunogenicity of a single dose 4-antigen or 3-antigen Staphylococcus aureus vaccine in healthy older adults[J]. Open Forum Infect Di, 2015, 2(Suppl 1): 746. (  0) 0) |
| [23] |
Lee E, Kim BJ, Kang MJ, et al. Dynamics of gut microbiota according to the delivery mode in healthy Korean infants[J]. Allergy Asthma Immunol Res, 2016, 8(5): 471-477. (  0) 0) |
| [24] |
Rocha ER, Smith CJ. Ferritin-like family proteins in the anaerobe Bacteroides fragilis: when an oxygen storm is coming, take your iron to the shelter[J]. Biometals, 2013, 26(4): 577-591. (  0) 0) |
| [25] |
Wexler AG, Goodman AL. An insider's perspective: Bacteroides as a window into the microbiome[J]. Nat Microbiol, 2017, 2: 17026. (  0) 0) |
| [26] |
Wallace BD, Roberts AB, Pollet RM, et al. Structure and inhibition of microbiome β-glucuronidases essential to the alleviation of cancer drug toxicity[J]. Chem Biol, 2015, 22(9): 1238-1249. (  0) 0) |
| [27] |
Pollet RM, D'agostino EH, Walton WG, et al. An Atlas of β-glucuronidases in the human intestinal microbiome[J]. Structure, 2017, 25(7): 967-977.e1-e5. (  0) 0) |
| [28] |
Madan A, MacMahon JR, Stevenson DK. Neonatal hyperbilirubinemia[M]//Taeusch HV, Ballard RA, Gleason CA. Avery's Diseases of the Newborn. 8th ed. Philadelphia, PA: Elsevier Publication, 2005: 1226-1256.
(  0) 0) |
 2020, Vol. 22
2020, Vol. 22


