新生儿败血症是威胁新生儿生命的重大疾病,其在存活新生儿中的发病率为4.5‰~9.7‰[1]。据世界卫生组织报道,全球每年约有160万新生儿死于感染[2]。不同国家新生儿败血症发病率及病因各不相同[3-6]。新生儿败血症分为早发型败血症(early-onset sepsis,EOS,发病时间≤3日龄)和晚发型败血症(late-onset sepsis,LOS,发病时间 > 3日龄)[7-8]。EOS患儿临床表现很不典型,常导致治疗不及时,预后差。在新生儿感染性疾病的诊断中,尽管有研究报道血液学指标如白细胞(WBC)计数、不成熟中性粒细胞/总中性粒细胞(I/T)、血小板(PLT)计数等,阳性预测价值有限[7],但因为其快捷、性价比高,是一项常规检查。而对于WBC计数,由于灵敏度较低,其诊断应用价值颇受争议,但又因其具有较高阴性预测价值,在临床上仍被广泛应用。然而在判定WBC计数诊断上限界值方面,2003年《新生儿败血症诊疗方案》(简称2003年版诊疗方案)中为≥25×109/L[9],《新生儿败血症诊断及治疗专家共识(2019年版)》(简称2019年版专家共识)中则为≥30×109/L[8]。因此,本研究通过分析新生儿EOS患儿的WBC计数,进一步评价其临床应用价值,探讨其合适的诊断上限界值。
1 资料与方法 1.1 研究对象回顾性选取2019年1月至2020年3月于重庆医科大学附属儿童医院新生儿科住院、无外院诊治经历、并诊断为新生儿EOS的306例患儿为研究对象,诊断均符合2019年版专家共识中新生儿EOS临床诊断或确诊诊断标准[8],且根据该共识,将EOS患儿分为临床诊断组(n=225)和确定诊断组(n=81)。3日龄内有临床异常表型,同时满足血液非特异性检查≥2项阳性为临床诊断;有临床异常表型,血培养阳性为确定诊断。
同时采用简单随机抽样法选取同期诊断为新生儿黄疸等非感染性疾病的580例新生儿为对照组。
1.2 研究方法两组患儿均在入院后、抗生素治疗前,无菌采集外周静脉血进行血常规、C反应蛋白(CRP)、降钙素原(PCT)检测,同时送血培养。现有文献报道,通过比较Mouzinho图表和Schmutz图表的中性粒细胞参考范围,EOS中性粒细胞达到高峰时龄分别为生后6 h、18~20 h[10],故本研究拟将所有新生儿按采血时间分为生后 < 6 h、6 h~、20~72 h进行分析。
1.3 统计学分析应用SPSS 23.0统计学软件对数据进行处理分析。不符合正态分布的计量资料以中位数(四分位数间距)[M(P25, P75)]表示,多个独立样本间比较采用Kruskal-Wallis H检验,组间两两比较采用Nemenyi检验。计数资料用率(%)表示,组间比较采用χ2检验,组间两两比较采用Bonferroni校正。采用受试者工作特征(ROC)曲线和曲线下面积(AUC)分析WBC计数对EOS的诊断价值。采用Z检验比较各项指标的AUC。P < 0.05为差异有统计学意义。
2 结果 2.1 一般资料确定诊断组和临床诊断组出生胎龄、出生体重、采血时龄均大于对照组(P < 0.05);临床诊断组双胎比例低于确定诊断组和对照组(P < 0.0167);确定诊断组胎膜早破比例高于对照组,而临床诊断组胎膜早破比例低于对照组(P < 0.0167);临床诊断组羊水污染比例高于对照组(P < 0.0167);确定诊断组和临床诊断组顺产、孕母产前发热的比例高于对照组(P < 0.0167)。3组间性别、孕母B族链球菌(GBS)阳性率差异无统计学意义(P > 0.05)。见表 1。
| 表 1 3组新生儿一般资料比较 |
|
|
根据采血时龄不同,按生后 < 6 h、6 h~、20~72 h进行比较。当采血时龄 < 6 h时,确定诊断组WBC计数低于对照组(P < 0.05);3个采血时龄下,临床诊断组WBC计数均高于对照组和确定诊断组(P < 0.05)。见表 2。
| 表 2 不同采血时龄WBC计数比较 |
|
|
根据2019年版专家共识,以WBC≥30×109/L或 < 5×109/L为阳性,EOS患儿阳性率为32.0%,对照组为1.4%。根据2003年版诊疗方案,以WBC≥25×109/L或 < 5×109/L为阳性,EOS患儿阳性率为51.3%,对照组为6.7%。2003年版诊疗方案阳性率、阴性预测值均高于2019年版专家共识(P < 0.05),其特异度、阴性预测值低于2019年版专家共识(P < 0.05)。见表 3。
| 表 3 2019年版专家共识与2003年版诊疗方案WBC计数诊断界值对EOS诊断的比较 |
|
|
根据两个方案对所有新生儿进行诊断,以是否有EOS为结局变量,绘制不同诊断标准WBC计数的ROC曲线。经过ROC曲线分析,2003年版诊疗方案的WBC计数对EOS的诊断价值高于2019年版专家共识(Z=4.06,P < 0.001)。2003年版诊疗方案诊断标准中,WBC计数在诊断EOS时灵敏度为51.5%,高于2019年版专家共识(45.1%)(χ2=8.21,P < 0.05),提示2003年版诊疗方案诊断标准比2019年版专家共识准确度更高。见表 4、图 1。
| 表 4 2019年版专家共识与2003年版诊疗方案WBC计数诊断界值对EOS的诊断价值 |
|
|
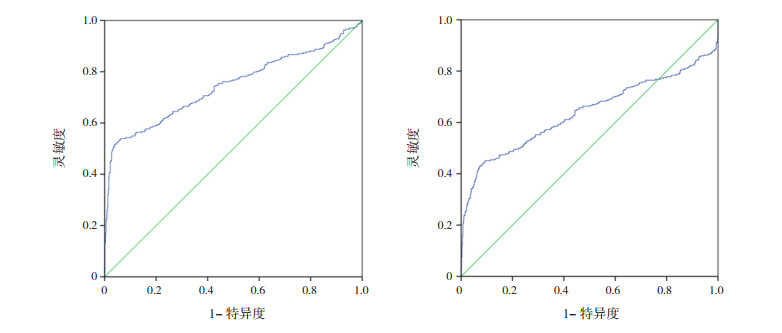
|
图 1 两个方案中WBC计数诊断界值的ROC曲线 左图为根据2003年版诊疗方案中WBC诊断界值绘制;右图为根据2019年版专家共识中WBC计数诊断界值绘制。 |
新生儿败血症目前依然严重威胁新生儿生存,美国新生儿败血症病死率在足月儿中为1.5%,在极低出生体重儿中高达40%~60%[11]。法国NICU住院患儿中新生儿败血症的病死率高达40%[12]。由于其高发病率及高病死率,寻找特异性生物标志物一直是相关研究的热点[13-14]。
本研究发现双胎、羊水污染、顺产、孕母产前发热、出生胎龄、出生体重在不同组间比较差异均有统计学意义;同时,采血时龄不同,各组间WBC计数存在显著性差异。本研究结果提示不论采血时龄多少,临床诊断组及对照组间WBC计数差异均有统计学意义,表明在EOS的诊断中,WBC计数有一定的临床价值。
由于WBC计数对败血症的阳性预测值较差,国内外单纯针对WBC计数的研究相对缺乏。国外各版本诊疗方案或筛查方案中,WBC计数诊断上限界值被设定为30×109/L~40×109/L[15-17],而我国WBC计数诊断上限界值从2003年版诊疗方案的25×109/L调整为2019年版专家共识的30×109/L,这一区别和调整,考虑可能与我国围生期管理的加强、流行病学的改变等有关。
由于2003年版诊疗方案与2019年版专家共识在WBC计数诊断界值上有不同,本研究就两版方案分别对WBC阳性率进行了对比,结果显示,不同方案中,WBC阳性率均较低(分别为51.3%和32.0%),经ROC曲线分析显示AUC分别为0.745和0.638,但特异度均较高(分别为96.2%和90.7%),结果提示2003年版诊疗方案WBC计数上限界值标准放宽增加了灵敏度,且特异度并没有显著减少。比较两种诊断方案WBC计数升高的标准,以2003年版诊疗方案提出的WBC≥25×109/L更合理。
本研究也有其局限性,首先本研究为单中心资料,样本数量较少,若有多中心大样本量研究支持本结论,则更具有说服力。其次,本研究中并未将WBC < 5×109/L的部分单独进行讨论,可能会对研究结果产生影响。此外,国内外多项研究均发现,非特异性指标联合应用时更有助于明确诊断[18-20],而本研究仅单纯讨论了WBC计数这一项实验室非特异性指标,后续可进一步将其他非特异性指标纳入讨论。
综上所述,单一WBC计数的诊断上限界值判断以≥25×109/L更为合理,其阳性率及阴性预测价值更高。
| [1] |
Fleischmann-Struzek C, Goldfarb DM, Schlattmann P, et al. The global burden of paediatric and neonatal sepsis: a systematic review[J]. Lancet Respir Med, 2018, 6(3): 223-230. DOI:10.1016/S2213-2600(18)30063-8 (  0) 0) |
| [2] |
Al-Shamahy HA, Sabrah AA, Al-Robasi AB, et al. Types of bacteria associated with neonatal sepsis in Al-Thawra University Hospital, Sana'a, Yemen, and their antimicrobial profile[J]. Sultan Qaboos Univ Med J, 2012, 12(1): 48-54. DOI:10.12816/0003087 (  0) 0) |
| [3] |
Vergnano S, Menson E, Kennea N, et al. Neonatal infections in England: the NeonIN surveillance network[J]. Arch Dis Child Fetal Neonatal Ed, 2011, 96(1): F9-F14. DOI:10.1136/adc.2009.178798 (  0) 0) |
| [4] |
Kohli-Kochhar R, Omuse G, Revathi G. A ten-year review of neonatal bloodstream infections in a tertiary private hospital in Kenya[J]. J Infect Dev Ctries, 2011, 5(11): 799-803. DOI:10.3855/jidc.1674 (  0) 0) |
| [5] |
Sgro M, Shah PS, Campbell D, et al. Early-onset neonatal sepsis: rate and organism pattern between 2003 and 2008[J]. J Perinatol, 2011, 31(12): 794-798. DOI:10.1038/jp.2011.40 (  0) 0) |
| [6] |
Morioka I, Morikawa S, Miwa A, et al. Culture-proven neonatal sepsis in Japanese neonatal care units in 2006-2008[J]. Neonatology, 2012, 102(1): 75-80. DOI:10.1159/000337833 (  0) 0) |
| [7] |
Hornik CP, Benjamin DK, Becker KC, et al. Use of the complete blood cell count in early-onset neonatal sepsis[J]. Pediatr Infect Dis J, 2012, 31(8): 799-802. DOI:10.1097/INF.0b013e318256905c (  0) 0) |
| [8] |
中华医学会儿科学分会新生儿学组, 中国医师协会新生儿科医师分会感染专业委员会. 新生儿败血症诊断及治疗专家共识(2019年版)[J]. 中华儿科杂志, 2019, 57(4): 252-257. (  0) 0) |
| [9] |
中华医学会儿科学分会新生儿学组, 中华医学会中华儿科杂志编辑委员会. 新生儿败血症诊疗方案[J]. 中华儿科杂志, 2003, 41(12): 897-899. (  0) 0) |
| [10] |
Wang J, Yu J, Fan J, et al. Evaluation of altitude-appropriate reference ranges for neutrophils in diagnosis of sepsis in very low birth weight infants: a multicenter retrospective study[J]. PLoS One, 2017, 12(2): e0171571. DOI:10.1371/journal.pone.0171571 (  0) 0) |
| [11] |
Weston EJ, Pondo T, Lewis MM, et al. The burden of invasive early-onset neonatal sepsis in the United States, 2005-2008[J]. Pediatr Infect Dis J, 2011, 30(11): 937-941. DOI:10.1097/INF.0b013e318223bad2 (  0) 0) |
| [12] |
Stoll BJ, Hansen NI, Sánchez PJ, et al. Early onset neonatal sepsis: the burden of group B streptococcal and E. coli disease continues[J]. Pediatrics, 2011, 127(5): 817-826. DOI:10.1542/peds.2010-2217 (  0) 0) |
| [13] |
Meem M, Modak JK, Mortuza R, et al. Biomarkers for diagnosis of neonatal infections: a systematic analysis of their potential as a point-of-care diagnostics[J]. J Glob Health, 2011, 1(2): 201-209. (  0) 0) |
| [14] |
Mussap M, Noto A, Cibecchini F, et al. The importance of biomarkers in neonatology[J]. Semin Fetal Neonatal Med, 2013, 18(1): 56-64. DOI:10.1016/j.siny.2012.10.006 (  0) 0) |
| [15] |
Resch B, B R, N H. Comparison between pathogen associated laboratory and clinical parameters in early-onset sepsis of the newborn[J]. Open Microbiol J, 2016, 10: 133-139. DOI:10.2174/1874285801610010133 (  0) 0) |
| [16] |
Gerdes JS. Diagnosis and management of bacterial infections in the neonate[J]. Pediatr Clin North Am, 2004, 51(4): 939-ix. DOI:10.1016/j.pcl.2004.03.009 (  0) 0) |
| [17] |
Odabasi IO, Bulbul A. Neonatal sepsis[J]. Sisli Etfal Hastan Tip Bul, 2020, 54(2): 142-158. (  0) 0) |
| [18] |
尹运堂, 龚放, 余加林, 等. 联合非特异性指标对新生儿败血症早期诊断的价值研究[J]. 重庆医学, 2015, 44(33): 4624-4626. (  0) 0) |
| [19] |
Yang AP, Liu J, Yue LH, et al. Neutrophil CD64 combined with PCT, CRP and WBC improves the sensitivity for the early diagnosis of neonatal sepsis[J]. Clin Chem Lab Med, 2016, 54(2): 345-351. (  0) 0) |
| [20] |
Al-Zahrani AKh, Ghonaim MM, Hussein YM, et al. Evaluation of recent methods versus conventional methods for diagnosis of early-onset neonatal sepsis[J]. J Infect Dev Ctries, 2015, 9(4): 388-393. DOI:10.3855/jidc.5950 (  0) 0) |
 2020, Vol. 22
2020, Vol. 22


