新生儿呼吸窘迫综合征(respiratory distress syndrome, RDS)是新生儿最常见的呼吸系统疾病之一,也是引起新生儿呼吸衰竭和死亡最常见原因之一。氧疗是治疗新生儿RDS的重要方法,经鼻持续气道正压通气(nasal continuous positive airway pressure, nCPAP)是新生儿RDS最常用的无创通气方式[1],其疗效已被证实[2],但易导致新生儿鼻损伤和哭闹,故其耐受性和依从性较差。高流量鼻导管吸氧(high-flow nasal cannula, HFNC)是一种新兴的无创呼吸支持技术,通过输送加温湿化的空氧混合气体,可冲刷鼻咽部解剖无效腔,提高呼吸道传导性,减少上呼吸道吸气阻力,从而提高肺换气率[3]。多项系统评价显示,在比较使用HFNC与nCPAP作为新生儿RDS呼吸支持方法时,两者取得同样的治疗效果,均为有效的呼吸支持方法[4-5]。然而有学者认为HFNC可延长患者气管插管时间,增加并发症的发生,增加患者病死率[6-7]。针对HFNC是否作为新生儿RDS的主要疗法尚未达成共识[8]。由于上述研究结果不一致,为进一步系统评价HFNC和nCPAP对新生儿RDS呼吸支持的有效性与安全性,故纳入最新的相关随机对照试验(RCT)进行Meta分析。
1 资料与方法 1.1 文献纳入标准(1) 研究类型:RCT;(2)研究对象:诊断为RDS的新生儿;(3)干预措施:试验组采用加热加湿的HFNC治疗,对照组采用nCPAP治疗。
1.2 文献排除标准(1) 非中、英文文献或无全文且获取数据失败的文献;(2)随机方法不当或文献质量差的文献;(3)对于同一医学中心数据重复文献,保留样本量最多的文献,余予以排除。
1.3 结局指标使用气管插管-肺表面活性物质-拔管(intubation-surfactant-extubation, INSURE)技术注入肺表面活性物质,可能掩盖两种呼吸支持模式之间的疗效差异,故行亚组分析,包括初始治疗和拔管后治疗两个亚组。初始治疗为入组时患儿未接受机械通气和INSURE技术;拔管后治疗为入组时患儿已行机械通气或INSURE技术。
初始治疗的结局指标包括:(1)治疗失败率。治疗失败是指有下列情况之一:治疗72 h内血气分析显示PaCO2 > 60 mm Hg,pH < 7.20;严重或反复性呼吸暂停;吸入氧浓度≥0.4;试验组使用HFNC后不能维持治疗,需要升级呼吸支持使用nCPAP或气管插管进行机械通气;对照组使用nCPAP后不能维持治疗,需要有创机械通气。(2)有创机械通气率。(3)肺表面活性物质使用率。(4)病死率。(5)并发症发生率,包括鼻损伤、气漏综合征、支气管肺发育不良(bronchopulmonary dysplasia, BPD)、坏死性小肠结肠炎(necrotizing enterocolitis, NEC)、动脉导管未闭(patent ductus arteriosus, PDA)、脑室内出血(intraventricular hemorrhage, IVH)、早产儿视网膜病(retinopathy of prematurity, ROP)、败血症。
拔管后治疗的结局指标包括:(1)治疗失败率;(2)重新插管率;(3)总用氧时间;(4)病死率;(5)并发症发生率,包括鼻损伤、气漏综合征、BPD、NEC、PDA、IVH、ROP、败血症。
1.4 文献检索策略采用主题词与自由词相结合的方式检索PubMed、Embase、Cochrane Library、Web of Science、中国知网、中国生物医学文献数据库、维普数据库、万方数据库等中英文数据库,检索时间均从建库至2020年4月1日,同时手工检索纳入文献及相关综述的参考文献。英文检索词包括:“infant”“newborn”“premature”“low birth weight”“high flow nasal cannula”“high flow nasal cannula oxygen therapy”“HFNC”“respiratory distress syndrome”“RDS”“randomized controlled trial”等。中文检索词包括:“新生儿”“早产儿”“低体重”“出生体重”“未成熟儿”“低出生质量”“高流量”“呼吸窘迫综合征”“RDS”等。
1.5 文献筛选和数据提取由两人独立筛选文献,有分歧时讨论解决或第三人确认。提取资料包括:第一作者、出版年份、研究国家、研究设计类型和RCT偏倚风险评价、研究对象的样本量、分组、基线资料、干预措施、结局指标等。必要时联系文献的作者,以获得更多数据。
1.6 文献偏倚风险评价由2名研究者独立按照Cochrane协作网工作手册推荐的RCT偏倚风险评估工具[9],评价所纳入研究的偏倚风险:随机序列生成、分配隐藏、对研究者和受试者的施盲、研究结局盲法评价、结局数据的完整性、选择性报告和其他偏倚,并依据偏倚风险评估标准对每个条目做出低风险、高风险或不清楚的判定。同时采用改良的Jadad评分法[10]对纳入的文献进行质量评价,1~3分为低质量研究,4~7分为高质量研究。意见不统一时与第三位研究者讨论,协商解决意见分歧。
1.7 统计学分析采用RevMan5.3软件进行Meta分析。二分类变量以风险比(RR)为效应指标,连续性变量以标准化均数差(SMD)为效应指标,各效应量均以95%CI 表示,并给出其点估计值。文献异质性的判断采用χ2检验。当P > 0.1、I2≤50%时,采用固定效应模型合并;P≤0.1、I2 > 50%时,分析异质性来源,在排除明显临床异质性的影响后,采用随机效应模型合并,或进行亚组分析以评估异质性的来源,且均进行敏感性分析。Meta分析的检验水准设为α=0.05。
2 结果 2.1 文献检索情况文献筛选流程见图 1,初步检索到文献1 036篇,最终纳入12篇RCT[11-22]。共纳入2 861例新生儿(胎龄:25~40周),其中≥28周2 698例(94.30%),< 28周163例(5.70%);HFNC组1 423例[胎龄(31.7±2.0)周],nCPAP组1 438例[胎龄(31.8±2.2)周]。9篇RCT[11-13, 15-19, 22]比较HFNC和nCPAP在RDS患儿初始治疗中的应用,4篇RCT[14, 20-22]比较HFNC和nCPAP在RDS患儿拔管后治疗中的应用,其中1篇RCT[22]同时包括初始治疗和拔管后治疗。纳入文献的基本特征见表 1。
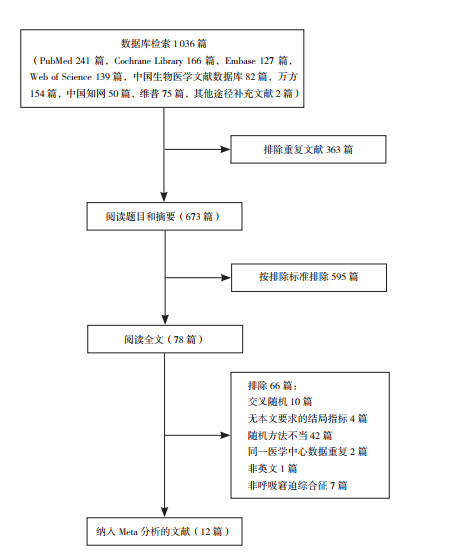
|
图 1 文献筛选流程图 |
| 表 1 纳入研究的基本特征 |
|
|
纳入研究文献的Jadad评分为3~7分,其中9篇[11, 13, 15-19, 21-22]为高质量文献。12篇RCT均报告了随机序列的产生方法;10篇RCT[11, 13, 15-22]采用密闭不透明信封,3篇RCT[12, 14, 20]未提及分配隐藏;仅有1篇RCT[13]对临床医生施盲,其余11篇未对研究者采用盲法,可能存在解读偏倚;3篇RCT[13-14, 20]未报告撤出或退出的理由;11篇[11, 13-22] RCT在试验前注册,报告了预先设计的结局测量;12篇RCT结果数据报告完整。偏倚风险评价见图 2。
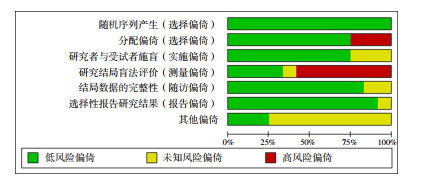
|
图 2 纳入文献偏倚风险评价 |
(1) 治疗失败率的比较:纳入7篇RCT[11, 15-19, 22]。HFNC组和nCPAP组治疗失败率分别为22.30%(242/1 085)和12.06%(133/1 103)。根据异质性检验结果(I2=35%,P=0.16),采用固定效应模型合并数据,显示两组治疗失败率差异有统计学意义(RR=1.86,95%CI:1.53~2.25,P < 0.001),见图 3。
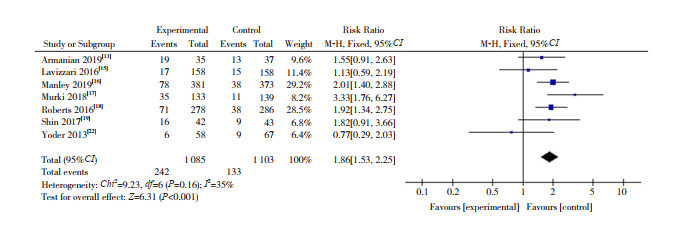
|
图 3 初始呼吸支持两组治疗失败率的比较 |
(2) 有创机械通气率的比较:纳入8篇RCT[11, 12, 15-19, 22]。HFNC组和nCPAP组有创机械通气率分别为12.47%(142/1 139)和11.42% (132/1 156)。根据异质性检验结果(I2=0%,P=0.46),采用固定效应模型合并数据,显示两组有创机械通气率差异无统计学意义(RR=1.10,95%CI:0.88~1.36,P=0.40),见图 4。
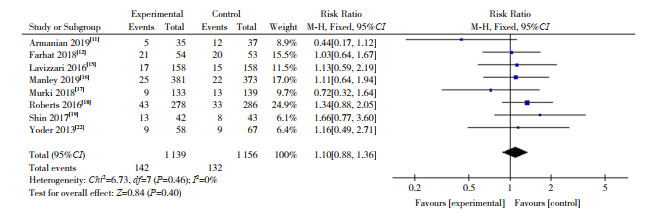
|
图 4 初始呼吸支持两组有创机械通气率的比较 |
(3) 病死率的比较:7项研究[11-12, 15-18, 22]提供了HFNC组和nCPAP组院内病死率数据。两组患儿院内病死率分别为1.55%(17/1 097)和2.34%(26/1 113)。根据异质性检验结果(I2=0%、P=0.61),采用固定效应模型合并数据,显示两组患儿病死率比较差异无统计学意义(RR=0.69,95%CI:0.39~1.21,P=0.20)。
(4) 肺表面活性物质使用率的比较:6篇RCT[11-12, 16-19]报告了肺表面活性物质的应用情况。HFNC组和nCPAP组肺表面活性物质使用率分别为19.4%(179/923)和19.2%(179/931)。根据异质性检验结果(I2=4%,P=0.39),采用固定效应模型合并数据,显示两组肺表面活性物质使用率差异无统计学意义(RR=1.02,95%CI:0.87~1.21,P=0.77)。
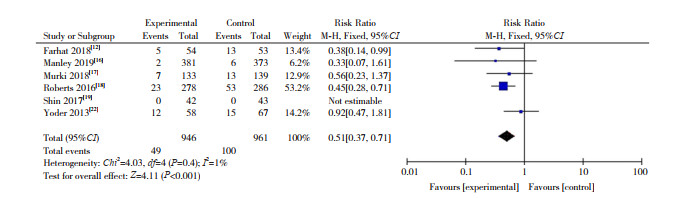
(5) 鼻损伤发生率的比较:纳入6篇RCT[12, 16-19, 22]。HFNC组和nCPAP组鼻损伤发生率分别为5.2%(49/946)和10.4%(100/961)。根据异质性检验结果(I2=1%,P=0.40),采用固定效应模型合并数据,显示两组鼻损伤发生率的比较差异有统计学意义(RR=0.51,95%CI:0.37~0.71,P < 0.001),见图 5。
|
图 5 初始呼吸支持两组鼻损伤发生率的比较 |
(1) 治疗失败率的比较:仅纳入1篇RCT[22]。HFNC组和nCPAP组治疗失败率分别为10.3%(11/107)和7.6%(9/119),两组治疗失败率差异无统计学意义(RR=1.36,95%CI:0.59~3.15,P=0.47)。
(2) 重新插管率的比较:4篇RCT[14, 20-22]报告了两组重新插管率数据。HFNC组和nCPAP组重新插管率分别为12.6%(27/215)和8.0%(18/226)。根据异质性检验结果(I2=38%,P=0.18),采用固定效应模型合并数据,显示两组重新插管率差异无统计学意义(RR=1.57,95%CI:0.91~2.72,P=0.18)。
(3) 病死率的比较:仅纳入2篇RCT[14, 22]。HFNC组和nCPAP组病死率分别为0%(0/144)和1.4%(2/146)。两组病死率差异无统计学意义(RR=0.20,95%CI:0.01~4.21,P=0.30)。
(4) 总用氧时间的比较:4篇RCT[14, 20-22]报告了HFNC组和nCPAP组总用氧时间的比较。根据异质性检验结果(P=0.48,I2=0%), 采用固定效应模型合并数据,显示两组总用氧时间差异无统计学意义(SMD=0.08,95%CI:-0.11~0.27,P=0.41)。
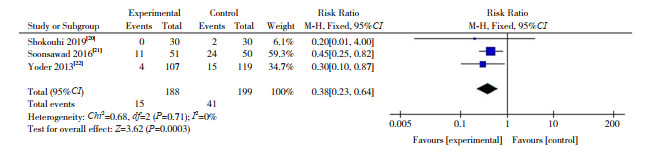
(5) 鼻损伤发生率的比较:3篇RCT[20-22]报告了两组鼻损伤发生率的比较。HFNC组和nCPAP组鼻损伤发生率分别为8.0%(15/188)和20.6%(41/199)。根据异质性检验结果(P=0.71,I2=0%),采用固定效应模型合并数据,显示两组鼻损伤发生率差异有统计学意义(RR=0.38,95%CI: 0.23~0.64,P=0.0003),见图 6。
|
图 6 拔管后呼吸支持两组鼻损伤发生率的比较 |
其他并发症包括气漏综合征、BPD、NEC、PDA、IVH、ROP、败血症。在初始呼吸支持和拔管后呼吸支持中,HFNC组和nCPAP组这些并发症的发生率的比较差异均无统计学意义(P > 0.05),见表 2。
| 表 2 两组其他并发症发生率比较的亚组分析结果 |
|
|
为判断本Meta分析统计模型是否稳定,在各个结局指标中,逐个剔除所有纳入RCT中的一项进行敏感性分析,结果显示,剩余文献排除前后结果未发生方向性改变,提示该Meta分析结果较为稳定可靠。
3 讨论HFNC作为新生儿RDS呼吸支持的有效性与安全性尚不确定[23]。欧洲新生儿RDS防治指南指出,在撤离呼吸机时HFNC可作为nCPAP的替代选择,但不用于初始治疗[24];而我国最新共识建议,无创通气以nCPAP为首选,可根据情况选用HFNC[1]。Morris等[25]研究表明,2 080例住院患儿中,HFNC在用于初始呼吸支持时有559例(26.9%)发生治疗失败,年龄越小、计划外入院、入院时病情严重程度越重是HFNC治疗失败的独立危险因素。一项大型、多中心RCT拟比较HFNC与nCPAP作为胎龄≥28周新生儿RDS的初始治疗疗效,但由于许多患儿初始用HFNC治疗发生呼吸暂停或严重呼吸性酸中毒后,需要改为nCPAP或有创机械通气进行挽救治疗而使该试验早期终止[17]。
本Meta分析显示,在初始呼吸支持中,与nCPAP比较,HFNC可降低鼻损伤发生率,但治疗失败率明显增加,这与Conte等[26]的系统评价分析结果一致。同时本研究结果显示HFNC未减少患儿的有创机械通气率、病死率、肺表面活性物质使用率及BPD、NEC、PDA、IVH、ROP、败血症、气漏综合征的发生率。HFNC治疗失败率高于nCPAP,考虑与HFNC产生的气道压力不稳定有关。HFNC治疗患儿时由于鼻塞与鼻腔间存在间隙,气流泄漏易产生通气不足[27]。此外,动物研究显示,HFNC设置流量6 L/min产生的呼气末食管压力约为3~3.5 cm H2O[28];Mazmanyan等[29]对26名新生儿的生理试验表明,HFNC设置流量8 L/min时,产生的气道压力不超过2 cm H2O;而nCPAP鼻塞与鼻腔紧密贴合,产生更高(5~8 cm H2O)且恒定的气道压力,在保持肺扩张和防止呼气末肺泡塌陷方面优于HFNC。HFNC除了有降低鼻损伤发生的优势外,在有效性与安全性方面并无明显优势,因此,在新生儿RDS初始治疗时不建议使用HFNC。
在拔管后呼吸支持中,Meta分析结果显示两组患儿治疗失败率、重新插管率、总用氧时间的比较差异均无统计学意义,同时HFNC能降低鼻损伤发生率,且不增加病死率及并发症发生的风险,提示其安全性良好。这与其预防早产儿拔管失败的有关Meta分析的结论基本一致[30]。此外,欧洲新生儿RDS防治指南指出,在撤离呼吸机时HFNC可作为nCPAP的替代选择[24],结合本研究结果,可以考虑使用HFNC作为拔管后过渡时期的呼吸维持以预防新生儿RDS拔管失败。
本Meta的局限性:(1)尽管各研究间统计学异质性较小,但纳入的各研究间一些特征有所不同,包括胎龄及使用的设备型号、参数设置不同,可能影响结论的可靠性;(2)纳入研究间HFNC初始流速的设置不一致,因此无法进行亚组分析以探索最佳流量治疗新生儿RDS;(3)在进行亚组分析时,拔管后治疗部分纳入文献较少;(4)由于在纳入文献中出生胎龄 < 28周的新生儿例数较少,本Meta分析的结论可能不适用于胎龄 < 28周的早产儿,无论是作为初始呼吸支持还是拔管呼吸支持,HFNC在该人群中的应用证据尚不充分。
综上所述,基于现有临床证据,与nCPAP比较,在出生胎龄≥28周RDS新生儿的初始治疗中,HFNC可降低鼻损伤发生风险,但未降低病死率及相关疾病的发生率,反而增加治疗失败的风险,因此不建议在RDS初始治疗时使用;在出生胎龄≥28周RDS新生儿的拔管后治疗中,HFNC具有鼻损伤较小的优势,且其他疗效无显著差异,在撤机阶段可以考虑使用HFNC替代nCPAP进行辅助呼吸支持。上述研究仍需后期进一步临床研究以明确效果,未来的研究还应探索HFNC最佳初始流速设置的标准,以及探讨HFNC治疗的临床适应证与禁忌证。
| [1] |
中国医师协会新生儿科医师分会. 早产儿呼吸窘迫综合征早期防治专家共识[J]. 中华实用儿科临床杂志, 2018, 33(6): 438-440. (  0) 0) |
| [2] |
曾健生, 钱素云. 促进儿童无创正压通气的临床应用[J]. 中华儿科杂志, 2017, 55(5): 321-323. (  0) 0) |
| [3] |
Nielsen KR, Ellington LE, Gray AJ, et al. Effect of high-flow nasal cannula on expiratory pressure and ventilation in infant, pediatric, and adult models[J]. Respir Care, 2018, 63(2): 147-157. DOI:10.4187/respcare.05728 (  0) 0) |
| [4] |
罗俊, 徐芬, 詹媛丽, 等. 加温湿化高流量鼻塞通气初始治疗轻-中度新生儿呼吸窘迫综合征的有效性:meta分析[J]. 中华围产医学杂志, 2017, 20(11): 818-823. (  0) 0) |
| [5] |
Zivanovic S, Scrivens A, Panza R, et al. Nasal high-flow therapy as primary respiratory support for preterm infants without the need for rescue with nasal continuous positive airway pressure[J]. Neonatology, 2019, 115(2): 175-181. DOI:10.1159/000492930 (  0) 0) |
| [6] |
Hegde S, Prodhan P. Serious air leak syndrome complicating high-flow nasal cannula therapy:a report of 3 cases[J]. Pediatrics, 2013, 131(3): e939-e944. DOI:10.1542/peds.2011-3767 (  0) 0) |
| [7] |
Kang BJ, Koh Y, Lim CM, et al. Failure of high-flow nasal cannula therapy may delay intubation and increase mortality[J]. Intensive Care Med, 2015, 41(4): 623-632. DOI:10.1007/s00134-015-3693-5 (  0) 0) |
| [8] |
Yoder BA, Manley B, Collins C, et al. Consensus approach to nasal high-flow therapy in neonates[J]. J Perinatol, 2017, 37(7): 809-813. DOI:10.1038/jp.2017.24 (  0) 0) |
| [9] |
Higgins JPT, Green S. Cochrane Handbook for Systematic Reviews of Interventions (Version 5.1.0)[EB/OL]. (2011-03-20)[2020-04-10]. https://handbook-5-1.cochrane.org/.
(  0) 0) |
| [10] |
Jadad AR, Moore RA, Carroll D, et al. Assessing the quality of reports of randomized clinical trials:is blinding necessary?[J]. Control Clin Trials, 1996, 17(1): 1-12. (  0) 0) |
| [11] |
Armanian AM, Iranpour R, Parvaneh M, et al. Heated humidified high flow nasal cannula (HHHFNC) is not an effective method for initial treatment of respiratory distress syndrome (RDS) versus nasal intermittent mandatory ventilation (NIMV) and nasal continuous positive airway pressure (NCPAP)[J]. J Res Med Sci, 2019, 24: 73. DOI:10.4103/jrms.JRMS_2_19 (  0) 0) |
| [12] |
Farhat AS, Mohammadzadeh A, Mamuri GA, et al. Comparison of nasal non-invasive ventilation methods in preterm neonates with respiratory distress syndrome[J]. Iran J Neonatol, 2018, 9(4): 53-60. (  0) 0) |
| [13] |
Glackin SJ, O'Sullivan A, George S, et al. High flow nasal cannula versus NCPAP, duration to full oral feeds in preterm infants:a randomised controlled trial[J]. Arch Dis Child Fetal Neonatal Ed, 2017, 102(4): F329-F332. DOI:10.1136/archdischild-2016-311388 (  0) 0) |
| [14] |
Kadivar M, Mosayebi Z, Razi N, et al. High flow nasal cannulae versus nasal continuous positive airway pressure in neonates with respiratory distress syndrome managed with INSURE method:a randomized clinical trial[J]. Iran J Med Sci, 2016, 41(6): 494-500. (  0) 0) |
| [15] |
Lavizzari A, Colnaghi M, Ciuffini F, et al. Heated, humidified high-flow nasal cannula vs nasal continuous positive airway pressure for respiratory distress syndrome of prematurity:a randomized clinical noninferiority trial[J]. JAMA Pediatr, 2016, E1-E7. (  0) 0) |
| [16] |
Manley BJ, Arnolda GRB, Wright IMR, et al. Nasal high-flow therapy for newborn infants in special care nurseries[J]. N Engl J Med, 2019, 380(21): 2031-2040. DOI:10.1056/NEJMoa1812077 (  0) 0) |
| [17] |
Murki S, Singh J, Khant C, et al. High-flow nasal cannula versus nasal continuous positive airway pressure for primary respiratory support in preterm infants with respiratory distress:a randomized controlled trial[J]. Neonatology, 2018, 113(3): 235-241. DOI:10.1159/000484400 (  0) 0) |
| [18] |
Roberts CT, Owen LS, Manley BJ, et al. Nasal high-flow therapy for primary respiratory support in preterm infants[J]. N Engl J Med, 2016, 375(12): 1142-1151. DOI:10.1056/NEJMoa1603694 (  0) 0) |
| [19] |
Shin J, Park K, Lee EH, et al. Humidified high flow nasal cannula versus nasal continuous positive airway pressure as an initial respiratory support in preterm infants with respiratory distress:a randomized, controlled non-inferiority trial[J]. J Korean Med Sci, 2017, 32(4): 650-655. DOI:10.3346/jkms.2017.32.4.650 (  0) 0) |
| [20] |
Shokouhi M, Basiri B, Sabzehei MK, et al. Efficacy and complications of humidified high-flow nasal cannula versus nasal continuous positive airway pressure in neonates with respiratory distress syndrome after surfactant therapy[J]. Iran Red Crescent Med J, 2019, 21(2): e83615. (  0) 0) |
| [21] |
Soonsawad S, Tongsawang N, Nuntnarumit P. Heated humidified high-flow nasal cannula for weaning from continuous positive airway pressure in preterm infants:a randomized controlled trial[J]. Neonatology, 2016, 110(3): 204-209. DOI:10.1159/000446063 (  0) 0) |
| [22] |
Yoder BA, Stoddard RA, Li M, et al. Heated, humidified high-flow nasal cannula versus nasal CPAP for respiratory support in neonates[J]. Pediatrics, 2013, 131(5): e1482-e1490. DOI:10.1542/peds.2012-2742 (  0) 0) |
| [23] |
Manley BJ, Owen LS. High-flow nasal cannula:mechanisms, evidence and recommendations[J]. Semin Fetal Neonatal Med, 2016, 21(3): 139-145. DOI:10.1016/j.siny.2016.01.002 (  0) 0) |
| [24] |
Sweet DG, Carnielli V, Greisen G, et al. European consensus guidelines on the management of respiratory distress syndrome-2019 update[J]. Neonatology, 2019, 115(4): 432-450. DOI:10.1159/000499361 (  0) 0) |
| [25] |
Morris JV, Kapetanstrataki M, Parslow RC, et al. Patterns of use of heated humidified high-flow nasal cannula therapy in PICUs in the United Kingdom and Republic of Ireland[J]. Pediatr Crit Care Med, 2019, 20(3): 223-232. DOI:10.1097/PCC.0000000000001805 (  0) 0) |
| [26] |
Conte F, Orfeo L, Gizzi C, et al. Rapid systematic review shows that using a high-flow nasal cannula is inferior to nasal continuous positive airway pressure as first-line support in preterm neonates[J]. Acta Paediatr, 2018, 107(10): 1684-1696. DOI:10.1111/apa.14396 (  0) 0) |
| [27] |
Liew Z, Fenton AC, Harigopal S, et al. Physiological effects of high-flow nasal cannula therapy in preterm infants[J]. Arch Dis Child Fetal Neonatal Ed, 2020, 105(1): 87-93. DOI:10.1136/archdischild-2018-316773 (  0) 0) |
| [28] |
Frizzola M, Miller TL, Rodriguez ME, et al. High-flow nasal cannula:impact on oxygenation and ventilation in an acute lung injury model[J]. Pediatr Pulmonol, 2011, 46(1): 67-74. DOI:10.1002/ppul.21326 (  0) 0) |
| [29] |
Mazmanyan P, Darakchyan M, Pinkham MI, et al. Mechanisms of nasal high flow therapy in newborns[J]. J Appl Physiol (1985), 2020, 128(4): 822-829. DOI:10.1152/japplphysiol.00871.2019 (  0) 0) |
| [30] |
李文星, 唐军, 陈超, 等. 预防早产儿拔管失败:加温湿化高流量鼻导管通气与经鼻持续气道正压通气效果比较的Meta分析[J]. 中华妇幼临床医学杂志(电子版), 2019, 15(2): 171-179. (  0) 0) |
 2020, Vol. 22
2020, Vol. 22


