急性白血病(acute leukemia, AL)患儿在进行标准诱导及巩固化疗时常导致严重而持久的中性粒细胞减少,易合并感染,甚至危及生命。重组人粒细胞集落刺激因子(recombinant human granulocyte colony-stimulating factor, rhG-CSF)已广泛应用于化疗所致中性粒细胞减少症的防治[1-3]。rhG-CSF的半衰期较短(约3.5 h),需每日注射以维持有效血药浓度[4]。这给家长和儿童肿瘤患者带来极大的不便和痛苦。聚乙二醇化重组人粒细胞刺激因子(pegylated recombinant human granulocyte colony-stimulating factor, PEG-rhG-CSF)是一种长效的粒细胞集落刺激因子(granulocyte colony-stimulating factor, G-CSF),每个治疗周期只需注射一次,且升高白细胞作用平稳,可避免反复注射带来的痛苦[5-7]。目前PEG-rhG-CSF在成人的药代动力学机制已有报道[8-9]。但PEG-rhG-CSF在我国儿童肿瘤患者中的药代动力学特征尚不明确。为明确PEG-rhG-CSF在儿童急性淋巴细胞白血病(acute lymphoblastic leukemia, ALL)患者中的药代动力学特征,为PEG-rhG-CSF的临床用药剂量、用药间隔等提供理论依据,本研究在儿童ALL患者中进行了PEG-rhG-CSF的药代动力学研究,同时与rhG-CSF进行疗效对比,为儿科患者化疗后G-CSF的选择提供临床数据。
1 资料与方法 1.1 研究对象前瞻性纳入2015年11月至2016年4月计划接受环磷酰胺(CTX)联合阿糖胞苷(Ara-C)及6-巯基嘌呤(6-MP)组成的CAM方案巩固治疗儿童或青少年ALL患者。入组标准为:(1)年龄 < 18岁;(2)经骨髓病理及MICM诊断与分型确诊的ALL低危或中危患儿;(3)计划接受CAM化疗方案的患儿;(4)卡氏评分(Karnofsky Performance Status, KPS)≥60分;(5)预计生存期3个月以上;(6)化疗前无粒细胞减少或缺乏,无出血倾向;(7)无心功能障碍或代谢性疾病;(8)丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、总胆红素(TBIL)在正常值上限2.5倍以内;(9)血尿素氮(BUN)、肌酐(Cr)、尿酸(UA)在正常值上限1.5倍以内;(10)受试者或其法定代理人/监护人自愿受试并签署知情同意书,能遵守试验用药及血样采集规程。排除标准:(1)目前有难以控制的感染,体温≥38.0℃者;(2)对G-CSF或其他基因工程大肠杆菌来源的生物制品过敏者;(3)研究者判断不适宜参与者。本研究获得中国医学科学院血液病医院伦理委员会批准(IIT2015011-EC-2)。该研究已在美国临床试验数据库(http://clinicaltrials.gov)注册(NCT02953730)。
1.2 分组及治疗方案所有患儿按家长意愿分为PEG-rhG-CSF组和rhG-CSF组,两组患儿均接受1周期CAM方案化疗:CTX 1 000 mg/m2,静脉滴注,第1天;Ara-C 50 mg/m2,每12 h 1次,静脉滴注,第1~7天;6-MP 60 mg/(m2 · d),口服,第1~7天。
PEG-rhG-CSF组患儿化疗结束后48 h后皮下注射PEG-rhG-CSF [津优力,石药集团百克(山东)生物制药股份有限公司] 1次,剂量为100 μg/kg(最大剂量为6 mg)。分别在注射PEG-rhG-CSF前即0 h及给药后6 h、12 h、24 h、48 h、72 h、120 h、168 h、216 h、288 h、336 h和408 h采集外周静脉血检测血药浓度和血常规。
rhG-CSF组患儿化疗结束后48 h后皮下注射rhG-CSF [津恤力,石药集团百克(山东)生物制药股份有限公司],每日5 μg/kg,直到血常规检查中性粒细胞绝对计数(ANC)≥1.0×109/L。分别在首次注射rhG-CSF前即0 h及给药后第1、2、3、5、7、9、11、13、15、17天采集外周静脉血检测血常规,由于rhG-CSF组不需要进行药代动力学测定,因此采血点较PEG-rhG-CSF组稀疏。
1.3 血药浓度测定采用ELISA法测定血清中PEG-rhG-CSF的浓度,并分析其体内过程,提供药代动力学参数。在样品测定过程中,每次均设置空白血清样品(无PEG-rhG-CSF)。绘制PEG-rhG-CSF标准曲线,浓度分别为39、78、156、312、625、1 250和2 500 pg/mL,质控浓度分别为100、500和2 000 pg/mL。
1.4 观察指标药代动力学指标:药峰浓度(Cmax)、消除半衰期(t1/2)、表观分布容积(Vd)、总清除率(CL)、药时曲线下面积(AUC)、达峰时间(Tmax)及平均滞留时间(MRT)等。
疗效指标为:中性粒细胞缺乏伴发热(febrile neutropenia, FN)的发生率、Ⅲ/Ⅳ度粒细胞缺乏发生率、Ⅳ度粒细胞缺乏持续时间、ANC最低点、ANC恢复时间(从化疗第1天开始到ANC≥2×109/L)、感染发生情况及住院天数(从化疗第1天至ANC≥0.5×109/L)。不良事件的评价参照《常见不良事件评价标准(CTCAE)》4.0版[10]。
1.5 统计学分析采用Office 2007和OriginPro 8.0进行数据处理和制图。药代动力学参数采用Phoenix WinNonlin 6.3软件,以非房室模型进行计算,包括t1/2、Tmax、Cmax、AUC、Vd、CL、MRT。计数资料以例数和百分率(%)表示,组间比较采用Fisher确切概率法;计量资料以中位数(范围)表示,组间比较采用Wilcoxon秩和检验。P < 0.05为差异有统计学意义。
2 结果 2.1 患儿基本情况共纳入ALL患儿17例,PEG-rhG-CSF组9例,rhG-CSF组8例,两组患儿的年龄、性别、身高、体重、ALL危险度、免疫表型差异均无统计学意义(P > 0.05),见表 1。所有入组患儿均接受了1周期研究药物治疗,并构成完整的分析数据集。PEG-rhG-CSF组患儿中位用药剂量为2.8(范围1.6~5.5)mg,rhG-CSF组患儿中位用药剂量和中位用药天数分别为502(范围210~2 813)μg和4.5(范围3~10)d。
| 表 1 两组患儿临床特征比较 |
|
|
PEG-rhG-CSF组9例患儿共采集并测定了108个血清样品。PEG-rhG-CSF血药浓度呈现单峰趋势,药物浓度随时间先升后降,不同个体趋势相同。当ANC较低时,PEG-rhG-CSF清除较慢,ANC稳定性升高;当ANC恢复正常时,PEG-rhG-CSF清除加快,与中性粒细胞介导清除机制相符(图 1)。PEG-rhG-CSF组的药代动力学参数详见表 2。
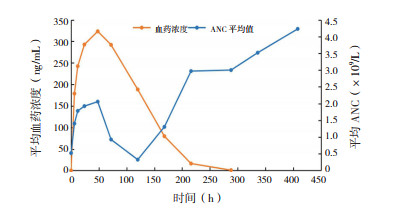
|
图 1 PEG-rhG-CSF血药浓度(对数)与ANC变化曲线 |
| 表 2 PEG-rhG-CSF组药代动力学参数 |
|
|
PEG-rhG-CSF组患儿中位ANC最低点为0.03(范围0.01~0.99)×109/L,rhG-CSF组为0.06(范围0~0.29)×109/L,两组间差异无统计学意义(P=0.469)。PEG-rhG-CSF组患儿从化疗第1天开始到ANC恢复正常(≥2×109/L)的时间比rhG-CSF组更短[18(16~21)d vs 22(18~26)d,P=0.021](图 2)。
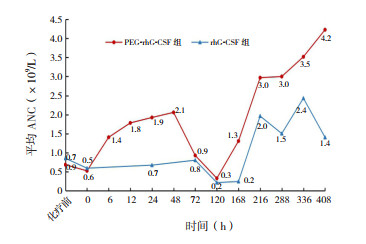
|
图 2 两组患儿ANC变化曲线 |
PEG-rhG-CSF组有6例(67%)发生FN,rhG-CSF组有5例(62%)发生FN,两组间差异无统计学意义(P=0.999)。两组患儿在Ⅲ/Ⅳ度粒细胞缺乏发生率、Ⅳ度粒细胞缺乏持续时间、感染发生情况及住院时间方面差异均无统计学意义(P > 0.05)。见表 3。
| 表 3 PEG-rhG-CSF组与rhG-CSF组患儿临床疗效比较 |
|
|
PEG-rhG-CSF组与rhG-CSF组患儿均未发生骨骼、肌肉酸痛。
3 讨论PEG-rhG-CSF是在rhG-CSF的氨基酸N端共价结合一个20 kDa的聚乙二醇链,虽然其分子量(38.8 kDa)低于肾小球滤过的界值(通常认为是70 kDa),但其流体动力学半径阻止其通过肾小球。因此,PEG-rhG-CSF在肾脏的清除大幅度下降,主要由中性粒细胞介导机制清除,使其t1/2延长,每个治疗周期只需注射1次。
一项PEG-rhG-CSF(100 μg/kg)在成人非小细胞肺癌中的药代动力学研究结果显示,患者的主要药代参数:Cmax为114(范围58.1~203)ng/mL,Tmax为72.0(范围24.0~96.0)h,t1/2为33.2(范围30.3~53.8)h,AUC0-∞为7 150(范围6 320~24 100)ng · h/mL[11]。我国一项PEG-rhG-CSF(100 μg/kg)在非小细胞肺癌和乳腺癌中的药代动力学研究结果显示,患者的主要药代参数:t1/2为(45.7±9.6)h[12]。本研究中ALL患儿在接受单次PEG-rhG-CSF(100 μg/kg)注射后,主要药代参数:Cmax为348.2(范围114.7~552.0)ng/mL,Tmax为48.0(范围12.0~72.0)h,t1/2为14.1(范围11.1~18.1)h,AUC0-∞为38 504.2(范围11 470.4~75 027.2)ng · h/mL。与成人相比,儿童ALL患者PEG-rhG-CSF的Cmax较大,Tmax和t1/2更短,推测可能与儿童的新陈代谢旺盛、吸收速度快、循环时间短、对药物排泄较快有关。此外,儿童ALL患者PEG-rhG-CSF的中位AUC0-∞远远大于成年人[38 504(范围11 470~75 027)ng · h/mL vs 7 150(范围6 320~24 100)ng · h/mL] [11],推测这可能与儿童对PEG-rhG-CSF的吸收程度更好有关。
Spunt等[12]在儿童肉瘤患者中单次应用PEG-rhG-CSF(100 μg/kg)的研究显示,主要药代参数:Cmax为(205±146)ng/mL,Tmax为24(范围24~144)h,AUC0-∞为(22 000±13 100)ng · h/mL。与上述研究相比,本研究中PEG-rhG-CSF在儿童ALL患者中相应参数数值更高,推测是由于瘤种不同和化疗方案骨髓抑制程度不同所致。肉瘤患者的研究中使用化疗方案为VDC(长春新碱、阿霉素和环磷酰胺)和IE(依托泊苷和异环磷酰胺),而本研究的化疗方案为CAM。
杨晟等[13]研究结果显示,PEG-rhG-CSF(津优力)血药浓度在化疗周期中ANC开始下降至最低点期间一直维持在较高水平;随着ANC水平恢复达高峰,PEG-rhG-CSF的血药浓度开始迅速下降,符合中性粒细胞介导的清除机制。本研究中,当ANC较低时,PEG-rhG-CSF的清除较慢,ANC稳定性升高;当ANC恢复正常时,PEG-rhG-CSF清除加快,同样符合中性粒细胞介导的清除机制。
Spunt等[12]在儿童肉瘤患者中的研究结果显示PEG-rhG-CSF组与rhG-CSF组ANC恢复时间均为14 d。本研究中PEG-rhG-CSF组与rhG-CSF组患儿中位ANC恢复时间分别为18 d、22 d。本研究中ANC恢复时间与既往研究不同,这可能与两研究定义的恢复标准不同有关,文献中ANC恢复标准为≥0.5×109/L,而本研究的ANC恢复标准为≥2×109/L。同时,本研究中PEG-rhG-CSF组较rhG-CSF组ANC恢复更快。
另一项儿童和青年肉瘤患者的研究显示,化疗后单次注射PEG-rhG-CSF(100 μg/kg)在严重中性粒细胞减少的持续时间、FN发生率及感染率方面与注射rhG-CSF差异无统计学意义[14]。与既往研究结果一致,本研究结果显示PEG-rhG-CSF组与rhG-CSF组患儿相比在FN发生率、Ⅲ/Ⅳ度粒细胞缺乏发生率、Ⅳ度粒细胞缺乏持续时间、感染发生情况及住院时间方面差异均无统计学意义,且两组患儿均未发生骨骼、肌肉酸痛。
综上所述,与成人患者相比,PEG-rhG-CSF在接受化疗的儿童ALL患者中吸收和排泄速度较快,吸收程度也比成人更好。PEG-rhG-CSF的清除机制与成人一样,符合中性粒细胞介导的清除。使用PEG-rhG-CSF,中性粒细胞恢复更快,并且在每个化疗周期中只需注射1次,避免了rhG-CSF反复注射带来的痛苦,更适合儿科患者。
利益冲突声明:所有作者均不存在利益冲突关系。本研究得到石药集团百克(山东)生物制药股份有限公司的资金支持。
| [1] |
Welte K, Gabrilove J, Bronchud MH, et al. Filgrastim (r-metHuG-CSF):the first 10 years[J]. Blood, 1996, 88(6): 1907-1929. DOI:10.1182/blood.V88.6.1907.bloodjournal8861907 (  0) 0) |
| [2] |
Ozer H, Armitage JO, Bennett CL, et al. 2000 update of recommendations for the use of hematopoietic colony-stimulating factors:evidence-based, clinical practice guidelines. American Society of Clinical Oncology Growth Factors Expert Panel[J]. J Clin Oncol, 2000, 18(20): 3558-3585. DOI:10.1200/JCO.2000.18.20.3558 (  0) 0) |
| [3] |
Lally J, Malik S, Whiskey E, et al. Clozapine-associated agranulocytosis treatment with granulocyte colony-stimulating factor/granulocyte-macrophage colony-stimulating factor:a systematic review[J]. J Clin Psychopharmacol, 2017, 37(4): 441-446. DOI:10.1097/JCP.0000000000000715 (  0) 0) |
| [4] |
Kuwabara T, Kobayashi S, Sugiyama Y. Pharmacokinetics and pharmacodynamics of a recombinant human granulocyte colony-stimulating factor[J]. Drug Metab Rev, 1996, 28(4): 625-658. DOI:10.3109/03602539608994020 (  0) 0) |
| [5] |
Green MD, Koelbl H, Baselga J, et al. A randomized double-blind multicenter phase III study of fixed-dose single-administration pegfilgrastim versus daily filgrastim in patients receiving myelosuppressive chemotherapy[J]. Ann Oncol, 2003, 14(1): 29-35. DOI:10.1093/annonc/mdg019 (  0) 0) |
| [6] |
Kubo K, Miyazaki Y, Murayama T, et al. A randomized, double-blind trial of pegfilgrastim versus filgrastim for the management of neutropenia during CHASE(R) chemotherapy for malignant lymphoma[J]. Br J Haematol, 2016, 174(4): 563-570. DOI:10.1111/bjh.14088 (  0) 0) |
| [7] |
Brito M, Esteves S, André R, et al. Comparison of effectiveness of biosimilar filgrastim (NivestimTM), reference Amgen filgrastim and pegfilgrastim in febrile neutropenia primary prevention in breast cancer patients treated with neo(adjuvant) TAC:a non-interventional cohort study[J]. Support Care Cancer, 2016, 24(2): 597-603. DOI:10.1007/s00520-015-2818-2 (  0) 0) |
| [8] |
Yang BB, Kido A. Pharmacokinetics and pharmacodynamics of pegfilgrastim[J]. Clin Pharmacokinet, 2011, 50(5): 295-306. DOI:10.2165/11586040-000000000-00000 (  0) 0) |
| [9] |
Yang BB, Savin MA, Green M. Prevention of chemotherapy-induced neutropenia with pegfilgrastim:pharmacokinetics and patient outcomes[J]. Chemotherapy, 2012, 58(5): 387-398. DOI:10.1159/000345626 (  0) 0) |
| [10] |
National Cancer Institute. Common terminology criteria for adverse events (CTCAE) version 4.0[EB/OL]. (2009-05-28)[2020-04-20]. https://evs.nci.nih.gov/ftp1/CTCAE/CTCAE_4.03/Archive/CTCAE_4.0_2009-05-29_QuickReference_8.5x11.pdf.
(  0) 0) |
| [11] |
Johnston E, Crawford J, Blackwell S, et al. Randomized, dose-escalation study of SD/01 compared with daily filgrastim in patients receiving chemotherapy[J]. J Clin Oncol, 2000, 18(13): 2522-2528. DOI:10.1200/JCO.2000.18.13.2522 (  0) 0) |
| [12] |
Spunt SL, Irving H, Frost J, et al. Phase II, randomized, open-label study of pegfilgrastim-supported VDC/IE chemotherapy in pediatric sarcoma patients[J]. J Clin Oncol, 2010, 28(8): 1329-1336. DOI:10.1200/JCO.2009.24.8872 (  0) 0) |
| [13] |
杨晟, 石远凯, 刘鹏, 等. 注射用聚乙二醇化重组人粒细胞集落刺激因子Ⅰ期临床药效学[J]. 中国医学科学院学报, 2006, 28(3): 339-344. (  0) 0) |
| [14] |
Fox E, Widemann BC, Hawkins DS, et al. Randomized trial and pharmacokinetic study of pegfilgrastim versus filgrastim after dose-intensive chemotherapy in young adults and children with sarcomas[J]. Clin Cancer Res, 2009, 15(23): 7361-7367. DOI:10.1158/1078-0432.CCR-09-0761 (  0) 0) |
 2020, Vol. 22
2020, Vol. 22


