意识障碍是儿童重症监护室(PICU)中常见危重症之一,可由神经系统感染、自发性丘脑出血、中毒、外伤、心脏骤停等多种疾病及意外伤害(如溺水)引起。判定意识障碍患儿病情严重程度和预测其预后成为临床工作者关注的重点。振幅整合脑电图(amplitude-integrated electroencephalogram, aEEG)是由常规脑电图经振幅压缩整合而成,具有床边实时监测、结果易判读等优点。近年来多用于新生儿缺氧缺血性脑病预后评估、脑成熟度判定、昏迷患者脑损伤程度及预后评估等[1-2]。全面无反应性量表(Full Outline of Unresponsiveness, FOUR)是Wijdicks等[3]在2005年发布的一个新评分系统,从眼睛反应、运动反应、脑干反射和呼吸模式4个方面评估神经功能,每个方面0~4分,总分0~16分。与传统的格拉斯哥昏迷评分(Glasgow Coma Scale, GCS)相比,FOUR新增了呼吸类型及脑干反射的判定,删除了临床上不易判断的语言项目,对睁眼反应、运动反应项目进行了优化改进。既往研究已证实FOUR优于或等同于GCS的预测能力[4-5]。现有临床研究多为单独应用aEEG或FOUR进行预后评价,评价结果的客观性和准确性具有一定局限性,目前尚未有针对意识障碍患儿应用多种方法联合评估的相关报道。本研究旨在分析aEEG联合FOUR对儿童非创伤性意识障碍预后的评估能力,现报道如下。
1 资料与方法 1.1 研究对象选择2017年6月至2019年6月入住苏州大学附属儿童医院PICU的非创伤性意识障碍患儿164例为研究对象。纳入标准:(1)年龄29 d至18岁,病程72 h以内;(2)非创伤性疾病导致的各种程度的意识障碍患儿,GSC≤14分。排除标准:(1)患儿存在可能影响脑功能判断的因素,如低血糖、内分泌疾病、休克、低温等;(2)脑电图检查前6 h内应用过严重影响脑电活动的药物(苯二氮卓类、巴比妥类等)者;(3)既往明确有神经系统病变,并已有后遗症者;(4)脑电图有明显干扰伪迹者;(5)失访患儿;(6)外伤及脑电监测前因病情需要行头部手术的患儿;(7)严重眼眶周围的水肿和颜面部创伤,以及伤及眼球或视神经、动眼神经等情况的患儿。
1.2 aEEG检查入PICU第1天及第5天进行16导联aEEG监测,监测时长 > 8 h。导联位置按照10~20标准法放置16个头皮电极(Fp1~Fp2、F3~F4、F7~F8、T3~T4、T5~T6、C3~C4、P3~P4、O1~O2)。根据振幅上下边界及有无癫痫样电活动,参考Naqeeb分类法将aEEG监测结果分为3种[6]:(1)正常aEEG(1级):振幅正常(波谱上边界 > 10 μV,下边界 > 5 μV);(2)轻度异常aEEG(2级):振幅轻度异常(波谱上边界 > 10 μV,下边界 < 5 μV,或波谱上边界 < 10 μV,下边界 > 5 μV),或振幅正常但伴癫痫样电活动;(3)重度异常aEEG(3级):振幅重度异常(波谱上边界 < 10 μV,下边界 < 5 μV)伴或不伴癫痫样电活动,或振幅轻度异常但伴癫痫样电活动。由2名经过培训的PICU医师完成aEEG结果判读。
1.3 FOUR及GCS评分在入PICU第1天及第5天由2名医师分别进行评估。FOUR包括眼部反应(0~4分)、运动反应(0~4分)、脑干反射(0~4分)、呼吸(0~4分),总分0~16分[3]。GCS包括眼部反应(1~4分)、运动反应(1~6分)、语言反应(1~5分),总分3~15分[7]。
1.4 预后判断以出院后3个月或者3个月内死亡时间为随访终点。格拉斯哥预后评分(Glasgow Outcome Scale, GOS)[8]:1分为死亡;2分为植物状态,无意识,有心跳和呼吸,偶有睁眼、吸吮、哈欠等局部运动反应;3分为严重残疾,有意识,但认知、语言、躯体运动有严重残疾,24 h均需他人照顾;4分为中度残疾,有认知、行为、性格障碍,有轻度偏瘫、共济失调、言语困难等残疾,在日常生活、家庭与社会活动中尚能勉强独立;5分为能重新进入正常社交活动,但可有各种新后遗症。1~3分为预后不良,4~5分为预后良好。
1.5 统计学分析应用SPSS 22.0统计软件进行数据分析。非正态分布计量资料采用中位数(四分位数间距)[M(P25, P75)]表示。不同预后患儿第1天及第5天aEEG分级、FOUR及GCS比较采用配对样本的Wilcoxon符号秩检验。aEEG分级、FOUR、GCS与预后的相关性分析采用Spearman秩相关分析。应用MedCalc 19.1统计软件描绘受试者工作特征(ROC)曲线,根据曲线下面积(AUC)大小,应用Z检验比较各评估方法预测不良预后的AUC差异。当AUC < 0.5时无预测价值,AUC为0.5~0.7时预测准确性较低,AUC为0.7~0.9时预测准确性较好,AUC > 0.9时预测准确性高。P < 0.05为差异有统计学意义。
2 结果 2.1 一般资料164例非创伤性意识障碍患儿中,男97例(59.1%),女67例(40.9%),中位月龄为27.0(6.6,75.7)个月。病种包括颅内感染56例(34.1%),中毒性脑病32例(19.5%),癫痫26例(15.9%),缺氧缺血性脑病15例(9.1%),急性中毒11例(6.7%),遗传代谢性疾病9例(5.5%),重症手足口病5例(3.0%),其他10例(6.1%,包括自身免疫性脑炎5例、自发性脑出血2例、暴发性心肌炎3例)。
2.2 aEEG、FOUR、GCS结果与预后的比较164例患儿中,预后良好111例(67.7%),预后不良53例(32.3%)。第1天aEEG检查表现为重度异常者33例(20.1%),其中31例预后不良;检查正常者83例(50.6%),其中79例预后良好;轻度异常者48例(29.3%),其中30例预后良好。预后良好组第5天aEEG正常分级者增加,重度异常者减少;预后不良组第5天已无aEEG正常分级者,重度异常者增加,两组患儿随病程变化,第1天及第5天aEEG分级差异均有统计学意义(P < 0.05)。预后良好组第5天FOUR、GCS评分呈升高趋势(P < 0.05),预后不良组第5天FOUR、GCS评分呈降低趋势(P < 0.05)。见表 1。
| 表 1 不同预后患儿第1天及第5天aEEG、FOUR、GCS结果 [例或M(P25, P75)] |
|
|
分析第1天aEEG、FOUR、GCS与预后的关系可见aEEG与预后呈正相关(r=0.698,P < 0.001),aEEG分级越高,发生不良预后的可能性越大;FOUR、GCS与预后呈负相关(分别r=-0.655、-0.554,均P < 0.001),FOUR、GCS分值越低,发生不良预后的可能性越大。见表 2。
| 表 2 aEEG、FOUR、GCS之间及其与预后的相关关系 |
|
|
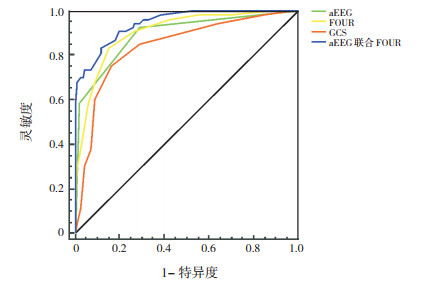
以患儿的实际预后不良作为金标准,引入第1天aEEG、FOUR、GCS、aEEG联合FOUR构建ROC曲线,比较3种单项评估方式的AUC,aEEG与FOUR的AUC、aEEG与GCS的AUC、FOUR与GCS的AUC比较差异均无统计学意义(分别Z=0.276、1.643、1.836,分别P=0.782、0.100、0.067),说明3种评估方法之间,预测价值相仿。aEEG联合FOUR的AUC为0.945(95%CI:0.898~0.974),高于各单项指标的AUC(分别Z=3.410、2.202、3.448,P < 0.001)。见图 1、表 3。
|
图 1 aEEG、FOUR、GCS及aEEG联合FOUR预测不良预后的ROC曲线 |
| 表 3 aEEG、FOUR、GCS及aEEG联合FOUR预测预后的比较 |
|
|
皮质和皮质下结构的损伤是非创伤性意识障碍的主要病理基础,严重程度及预后很大程度上取决于病因及损伤程度[9]。评估患儿病情进展及预后走向,成为临床工作关注的重点。aEEG通过上下边界判读背景活动,非神经电生理学专业人员亦能判读,并且具有床边实时监测、长时间评估等优点,受到各级PICU的青睐,aEEG对大脑缺血、缺氧有较高特异度、灵敏度及预测价值,当患儿出现脑损伤时,aEEG可辅助诊断及判断预后,从而达到早期干预与治疗的目的[2, 10]。对于成人患者亦有一定的评估作用,Rundgren等[11]首次评估了aEEG对成人患者预后的预测价值,在心脏骤停后8 h以内监测aEEG,发现初始连续aEEG模式和在常温下恢复到连续模式与更高的存活率和更好的意识恢复相关,而平坦波、暴发抑制或癫痫持续状态aEEG对不良结果有很强的预测力。在治疗过程中及时发现亚临床癫痫发作和非惊厥性癫痫状态,并加以早期干预,可提高生存率及改善生存质量[12]。本研究中随aEEG严重程度增加,预后不良率升高,呈正相关,异常aEEG预测不良预后的灵敏度和特异度分别为0.924和0.711,AUC为0.894,有较高的预测价值;并且对比aEEG第5天与第1天结果,可见若脑电分级无改善或异常程度加重者,预后较差,结果与先前的报道一致[2],即aEEG背景模式与神经系统预后相关。
GCS评分已应用于临床数十年,可简单快速地评估意识水平状态,但对于经口气管插管、闭锁综合征、失语症等患者,GCS语言评估已不再适用,并且儿童患者存在发育水平参差不齐、配合度低等现象,可能减低GCS评估的准确性。与GCS相比,FOUR量表有如下特点[13]:(1)对于睁眼、运动反应评分进行细化评估;(2)删除了可信度及可行性较低的语言功能评价,可用于插管患儿;(3)增加了对脑干反射及呼吸类型的评价。Jamal等[4]研究结果显示,医护经培训后能很快掌握FOUR,并且应用于近期预后及病死率评估,效力等同于GCS。
本研究显示FOUR、GCS评分结果与预后呈负相关,则评分降低可预测不良预后。FOUR与GCS的AUC差异无统计学意义。为验证联合评估方法的意义,以最佳截断值为aEEG轻度异常、FOUR≤8分、GCS≤9分别计算灵敏度及特异度,发现aEEG灵敏度高而特异度较低,FOUR灵敏度和特异度均高于GCS,aEEG联合FOUR的AUC高于3项单独评价AUC,说明aEEG联合FOUR可提高评估预后的准确性。
对于意识障碍患儿的预后评价,除有效的评估方法外,时间点亦值得探讨,本研究中病例均在发病72 h内接受评估,入PICU第1天内完成aEEG监测,第5天进行二次评估。有学者提出为了排除在昏迷早期可能影响aEEG记录的潜在因素,建议将昏迷后7 d(7~14 d)的患者纳入研究[14]。此时,患者的临床情况更稳定,aEEG记录更稳定,且疾病过程中重复多次进行相应昏迷评分,亦能提高评估准确性。多次评估及时间点的选择,应在日后的更多研究中进一步证实。
综上所述,对于非创伤性意识障碍的患儿,aEEG能够客观评价预后状态,对于临床决策及医患沟通起到重要作用。FOUR为较新的临床评估量表,较GCS更具有实用性,aEEG联合FOUR进行评估,具有更高的预测价值,可以指导临床及时纠正可逆性,提高患儿生存质量。
| [1] |
Bruns N, Dransfeld F, Hüning B, et al. Comparison of two common aEEG classifications for the prediction of neurodevelopmental outcome in preterm infants[J]. Eur J Pediatr, 2017, 176(2): 163-171. DOI:10.1007/s00431-016-2816-5 (  0) 0) |
| [2] |
Zubler F, Koenig C, Steimer A, et al. Prognostic and diagnostic value of EEG signal coupling measures in coma[J]. Clin Neurophysiol, 2016, 127(8): 2942-2952. DOI:10.1016/j.clinph.2015.08.022 (  0) 0) |
| [3] |
Wijdicks EF, Bamlet WR, Maramattom BV, et al. Validation of a new coma scale:the FOUR score[J]. Ann Neurol, 2005, 58(4): 585-593. DOI:10.1002/ana.20611 (  0) 0) |
| [4] |
Jamal A, Sankhyan N, Jayashree M, et al. Full Outline of Unresponsiveness score and the Glasgow Coma Scale in prediction of pediatric coma[J]. World J Emerg Med, 2017, 8(1): 55-60. (  0) 0) |
| [5] |
Zeiler FA, Lo BWY, Akoth E, et al. Predicting outcome in subarachnoid hemorrhage (SAH) utilizing the Full Outline of Unresponsiveness (FOUR) score[J]. Neurocrit Care, 2017, 27(3): 381-391. DOI:10.1007/s12028-017-0396-5 (  0) 0) |
| [6] |
邵肖梅, 刘登礼, 程国强. 新生儿振幅整合脑电图图谱[M]. 上海: 上海科技教育出版社, 2011: 15-18.
(  0) 0) |
| [7] |
王荃, 钱素云. 儿童意识水平及脑功能障碍的常用评估方法[J]. 中华实用儿科临床杂志, 2013, 28(18): 1367-1370. (  0) 0) |
| [8] |
Beers SR, Wisniewski SR, Garcia-Filion P, et al. Validity of a pediatric version of the Glasgow Outcome Scale-Extended[J]. J Neurotrauma, 2012, 29(6): 1126-1139. DOI:10.1089/neu.2011.2272 (  0) 0) |
| [9] |
Pignat JM, Mauron E, Jöhr J, et al. Outcome prediction of consciousness disorders in the acute stage based on a complementary motor behavioural tool[J]. PLoS One, 2016, 11(6): e0156882. DOI:10.1371/journal.pone.0156882 (  0) 0) |
| [10] |
Kadivar M, Mosayebi Z, Badoo RS, et al. Evaluation of the efficacy of amplitude-integrated electroencephalography in the screening of newborns with metabolic disorder admitted to the NICU[J]. BMC Med Imaging, 2018, 18(1): 33. (  0) 0) |
| [11] |
Rundgren M, Westhall E, Cronberg T, et al. Continuous amplitude-integrated electroencephalogram predicts outcome in hypothermia-treated cardiac arrest patients[J]. Crit Care Med, 2010, 38(9): 1838-1844. DOI:10.1097/CCM.0b013e3181eaa1e7 (  0) 0) |
| [12] |
Schettler KF, Heineking B, Fernandez-Rodriguez S, et al. Guiding antiepileptic therapy in a pediatric patient with severe meningoencephalitis and decompressive craniectomy with the use of amplitude-integrated electroencephalography[J]. J Pediatr Intensive Care, 2017, 6(2): 136-141. (  0) 0) |
| [13] |
Wijdicks EF, Kramer AA, Rohs T Jr, et al. Comparison of the Full Outline of Unresponsiveness score and the Glasgow Coma Scale in predicting mortality in critically ill patients*[J]. Crit Care Med, 2015, 43(2): 439-444. DOI:10.1097/CCM.0000000000000707 (  0) 0) |
| [14] |
You W, Tang Q, Wu X, et al. Amplitude-integrated electroencephalography predicts outcome in patients with coma after acute brain injury[J]. Neurosci Bull, 2018, 34(4): 639-646. DOI:10.1007/s12264-018-0241-7 (  0) 0) |
 2020, Vol. 22
2020, Vol. 22


