2. 苏州大学附属儿童医院儿科临床研究院, 江苏 苏州 215025;
3. 苏州市小儿内科临床医学中心, 江苏 苏州 215025
缺氧缺血性脑病(hypoxic-ischemic encephalo-pathy, HIE)常导致新生儿死亡或严重的、不可逆的神经功能缺损[1-2]。迄今为止,HIE的治疗仍以支持疗法及亚低温疗法等为主,但其疗效有待提高。因此,进一步明确HIE的发病机制,有助于寻找HIE新的治疗方法。
缺氧缺血性脑损伤(hypoxic-ischemic brain damage, HIBD)是HIE的病理过程,常导致大量神经元死亡,从而不可避免地引发炎症,这种炎症主要由小胶质细胞介导,小胶质细胞是中枢神经系统中唯一的固有免疫细胞[3]。脑损伤后,小胶质细胞是发生反应最早的细胞,并且常导致不利后果,如激活星形胶质细胞形成胶质疤痕[4]。目前,研究发现小胶质细胞介导的炎症反应在HIBD、脑中风和创伤性脑损伤中扮演着重要角色[5-8]。
焦亡(pyroptosis)是近年来新发现的一种与炎症反应相关的细胞程序性死亡方式[9-10]。相较于其他细胞死亡类型具有明显的特殊性,从形态学上讲,焦亡兼具坏死和凋亡的双重特征,同时伴随炎症反应。焦亡在早期表现出染色质浓缩、DNA片段化及TUNEL染色阳性等凋亡的特征;随后细胞的细胞膜上会形成众多1~2 nm大小的孔隙,使细胞膜失去完整性,呈坏死样表现;最终细胞肿胀和膜破裂并释放大量细胞内容物,引发级联放大的瀑布式炎症反应[11]。NOD样受体热蛋白结构域3(NOD-like receptor pyrin domain containing 3,NLRP-3)/半胱氨酸天冬氨酸蛋白酶-1(caspase-1)/Gasdermin D(GSDMD)轴构成经典焦亡通路。研究发现,GSDMD是细胞焦亡的直接效应器,在被上游因素激动后,Gasdermin D蛋白N端(GSDMD-N)结构域从其C端结构域释放出来,靶向结合脂质膜,并且聚合成一个中空的环状低聚物,形成非选择性孔道致细胞肿胀,从而诱导细胞焦亡的发生,引发局部乃至全身的炎症反应[12]。最新研究发现,小胶质细胞焦亡在HIBD的病理生理学中扮演着重要的角色[13]。
因此,本研究拟通过体外实验初步探讨小胶质细胞焦亡在HIBD中的作用。
1 材料与方法 1.1 实验细胞及分组大鼠小胶质细胞系购于上海酶联生物科技有限公司细胞库。(1)将培养好的大鼠小胶质细胞系根据处理方式的不同,分为正常对照组和氧糖剥夺再灌注组(OGD/R组),OGD/R组再分为0、1、3、6、12、24 h组。(2)慢病毒转染大鼠小胶质细胞系,分为正常对照组和慢病毒转染组,慢病毒转染组再分为阴性对照组(慢病毒空载)、LV-sh_GSDMD 1组(慢病毒沉默GSDMD序列1)、LV-sh_GSDMD 2组(慢病毒沉默GSDMD序列2)、LV-sh_GSDMD 3组(慢病毒沉默GSDMD序列3)。(3)将培养好的大鼠小胶质细胞系根据处理方式的不同,分为正常培养组和OGD/R 24 h组,两组分别再分为正常对照组、阴性对照组、LV-sh_GSDMD组。
1.2 主要试剂O2(浓度 < 1%)+CO2(浓度5%)+N2(浓度95%)混合气体(苏州市金宏气体有限公司);DMEM/HIGH GLUCOSE培养基、不含葡萄糖的厄尔平衡盐缓冲溶液(EBSS)(Gibco,美国);胎牛血清(Biological Industries,以色列);青霉素-链霉素溶液(上海碧云天生物技术有限公司);兔抗caspase-1、GSDMD、IL-1β(Abcam,英国);鼠抗β-actin抗体(杭州联科生物技术股份有限公司);慢病毒空载、慢病毒沉默GSDMD序列1、GSDMD序列2及GSDMD序列3(上海吉凯基因化学技术有限公司);CCK-8试剂盒(日本同仁化学科技研究所);LDH试剂盒(南京建成生物工程研究所)。
1.3 大鼠小胶质细胞系的培养大鼠小胶质细胞系的培养基是89% DMEM/HIGH GLUCOSE+10%胎牛血清+1%青霉素-链霉素溶液,于37℃、饱和湿度5%CO2孵箱中培养。
1.4 构建大鼠小胶质细胞系OGD/R模型细胞种板培养,待细胞丰度达到80%,吸出原有培养基,用1×PBS清洗2次后,更换为EBSS后放入细胞缺氧舱(O2浓度 < 1%,CO2浓度5%,N2浓度95%)中2 h后取出,立即换成原培养基(89% DMEM/HIGH GLUCOSE+10%胎牛血清+1%青霉素-链霉素溶液)[13]。将上述操作全部完成的时间点设定为0 h,并且另外设定1、3、6、12及24 h,共6个时间点,培养箱继续培养至相应时间点进行收样检测。正常对照组不进行OGD/R处理。实验独立重复3次。
1.5 Western blot法检测蛋白表达将每个样品在蛋白裂解缓冲液中进行溶解和匀浆,并提取总蛋白。将收集好的待检测的样品使用蛋白试剂盒调成相同浓度,然后按照比例向其中加入5×蛋白上样缓冲液并且在涡旋震荡器上混匀,置于沸水浴中(100℃)煮沸使蛋白充分变性10 min。使用微量加样器将各组样品及marker按顺序进行上样。上样完成后连接电源进行电泳,先用60 V电压,当蛋白进入至浓缩胶和分离胶的交界处时改为90 V电压继续电泳,当marker移动至快接近分离胶底端时停止电泳。将分离胶取下来,转膜前自下而上按照黑板-三张滤纸-分离胶-PVDF膜-三张滤纸-白板的顺序进行叠放,PVDF膜预先用甲醇浸泡预处理1 min以打开孔径,叠放完成后放入置有碎冰的转移槽缓冲液中,以230 mA、60 min恒流进行转膜,操作结束后取出PVDF膜。取出的膜置于5%脱脂牛奶中常温摇床封闭2 h,封闭结束后,使用1× TBST漂洗3次,每次10 min,加入caspase-1(1 : 1 000)、GSDMD(1 : 1 000)、IL-1β(1 : 1 000)、GSDMD-N(1 : 1 000)、β-actin(1 : 10 000)一抗,摇床上常温摇1 h后置于4℃摇床过夜。次日弃去一抗溶液,使用1× TBST漂洗3次,每次10 min;之后分别加入鼠二抗β-actin(1 : 5 000),其余均为兔二抗(1 : 5 000),并且置于摇床上摇1 h;弃去二抗溶液,使用1× TBST洗膜3次,每次10 min。使用ECL显影液试剂盒和蛋白显影仪进行显影,所获得的图像的灰度值分析采用Image J软件进行。
1.6 慢病毒转染大鼠小胶质细胞系将细胞接种于24孔板中,待细胞丰度至80%时进行慢病毒转染实验。将冻存于-80℃冰箱中的慢病毒取出后置于冰上融化,使用离心机稍微离心使病毒液完全沉于离心管底部。根据预实验中已确认的感染复数(MOI)值(MOI=100)及病毒滴度(9×108/mL)计算慢病毒使用量并且将其稀释到无血清培养基中[慢病毒的使用量=(MOI×细胞数目)/病毒滴度],吸取病毒液(慢病毒沉默GSDMD序列1、GSDMD序列2、GSDMD序列3或慢病毒空载)并将其分别加入各组细胞中,将细胞放入37℃ CO2培养箱中培养,感染约12 h,更换新鲜的培养基。72 h后利用免疫荧光和Western blot以判断转染效率,带绿色荧光的是转染上的目的细胞,转染效率在90%以上,提示可用于后续实验。实验独立重复3次。
1.7 CCK-8法检测细胞活力将大鼠小胶质细胞系以1×104细胞/孔的密度接种在96孔板上,并且每孔的培养基为100 μL。经过OGD/R后24 h,吸出培养基,将每个孔中的培养基换成100 μL培养基+10 μL CCK-8,并且于37℃ CO2培养箱中孵育2 h,2 h后取出,使用96孔板酶标仪在450 nm处测量样品的吸光度(OD)。实验独立重复3次。
1.8 LDH试剂盒法检测细胞LDH漏出率将大鼠小胶质细胞系以1×104细胞/孔的密度接种在96孔板上,并且每孔的培养基为100 μL。经过OGD/R后24 h,从每孔中收集50 μL上清液,并且按照LDH试剂盒操作步骤进行加样操作,混匀后室温放置5 min,使用酶标仪在450 nm处测定各样品OD值,计算LDH漏出率。实验独立重复3次。
1.9 统计学分析采用GraphPad Prism 5统计软件对数据进行统计学分析。计量资料采用均数±标准差(x±s)表示,OGD/R前后比较采用配对t检验;多组间比较用单因素方差分析,组间两两比较采用SNK-q检验。P < 0.05为差异有统计学意义。
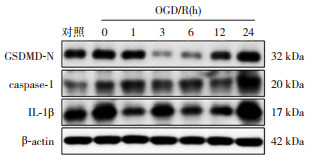
2 结果 2.1 OGD/R处理后的大鼠小胶质细胞系内焦亡相关蛋白caspase-1、GSDMD-N、IL-1β水平的时程变化Western blot结果显示,OGD/R处理后0 h起小胶质细胞内焦亡相关蛋白caspase-1、GSDMD-N、IL-1β的表达水平即发生了上调,并且在24 h这个时间点达到高峰(表 1,图 1)。结果提示,OGD/R后小胶质细胞内激活了焦亡相关蛋白表达。
| 表 1 OGD/R后小胶质细胞中caspase-1、GSDMD-N、IL-1β的表达变化 (n=3,x±s) |
|
|
|
图 1 Western blot法检测各时间点小胶质细胞中caspase-1、GSDMD-N和IL-1β表达电泳图 |
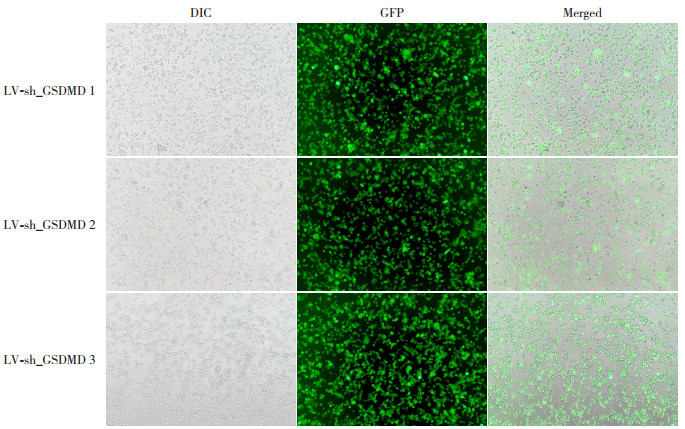
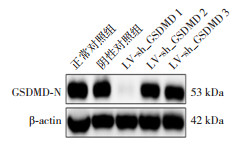
用慢病毒构建带有绿色荧光的沉默GSDMD序列(LV-sh_GSDMD-GFP)转染小胶质细胞,72 h后利用荧光显微镜观察。免疫荧光结果显示,LV-sh_GSDMD 1组、LV-sh_GSDMD 2组和LV-sh_GSDMD 3组均有效地转染小胶质细胞(图 2)。为进一步验证LV-sh_GSDMD的干扰效率,采用Western blot检测结果显示,正常对照组、阴性对照组、LV-sh_GSDMD 1组、LV-sh_GSDMD 2组和LV-sh_GSDMD 3组的GSDMD蛋白表达量分别为0.852±0.013、0.846±0.009、0.137±0.002、0.828±0.013、0.844±0.015,各组比较差异有统计学意义(F=2 302,P < 0.0001)。与正常对照组相比,LV-sh_GSDMD 1组降低了GSDMD蛋白表达量(P < 0.001)(图 3)。提示LV-sh_GSDMD 1组转染小胶质细胞成功,且对GSDMD蛋白表达的干扰效率最高,可用于后续实验。
|
图 2 慢病毒沉默GSDMD转染小胶质细胞荧光图(×100) 慢病毒构建带有绿色荧光的沉默GSDMD序列1(LV-sh_GSDMD 1)、序列2(LV-sh_GSDMD 2)、序列3(LV-sh_GSDMD 3)均成功转染进入小胶质细胞内。 |
|
图 3 Western blot法检测各组细胞中GSDMD表达电泳图 结果提示GSDMD序列1(LV-sh_GSDMD 1)对GSDMD蛋白表达的干扰效率最高。 |
实验结果显示,在正常培养条件下,正常对照组、阴性对照组、LV-sh_GSDMD组小胶质细胞活性比较差异无统计学意义(P > 0.05)。OGD/R 24 h时,与正常对照组相比,LV-sh_GSDMD组细胞活性升高(P < 0.05),阴性对照组差异无统计学意义(P > 0.05)。OGD/R处理小胶质细胞后24 h,正常对照组和阴性对照组小胶质细胞活性均较正常培养时降低(P < 0.05)。结果提示,LV-sh_GSDMD可提高OGD/R后小胶质细胞活性。见表 2。
| 表 2 各组细胞活性比较 (n=3,x±s) |
|
|
通过检测小胶质细胞LDH漏出率反映细胞毒性,细胞LDH漏出率越高,细胞毒性越强。实验结果显示,在正常培养条件下,正常对照组、阴性对照组和LV-sh_GSDMD组的细胞毒性比较差异无统计学意义(P > 0.05)。OGD/R 24 h时,与正常对照组相比,LV-sh_GSDMD组细胞毒性降低(P < 0.05),阴性对照组差异无统计学意义(P > 0.05)。OGD/R处理小胶质细胞后24 h,正常对照组和阴性对照组细胞毒性均较正常培养时升高(P < 0.05)。结果提示,LV-sh_GSDMD可降低OGD/R后小胶质细胞毒性。见表 3。
| 表 3 各组LDH漏出率情况比较 (n=3,x±s) |
|
|
Western blot结果显示,在正常培养条件下,正常对照组、阴性对照组和LV-sh_GSDMD组小胶质细胞内caspase-1、IL-1β蛋白水平比较差异无统计学意义(P > 0.05),LV-sh_GSDMD组GSDMD-N蛋白水平低于正常对照组(P < 0.05)。OGD/R 24 h时,与正常对照组相比,LV-sh_GSDMD组小胶质细胞内caspase-1、IL-1β、GSDMD-N蛋白水平降低(P < 0.05),阴性对照组上述指标差异无统计学意义(P > 0.05)。OGD/R处理小胶质细胞后24 h,正常对照组和阴性对照组小胶质细胞内caspase-1、IL-1β、GSDMD-N蛋白水平均较正常培养时升高(P < 0.05)。结果提示,LV-sh_GSDMD可降低OGD/R后24 h小胶质细胞内caspase-1、IL-1β、GSDMD-N蛋白水平。见表 4,图 4。
| 表 4 各组细胞焦亡相关蛋白水平比较 (n=3,x±s) |
|
|

|
图 4 Western blot法检测慢病毒沉默GSDMD转染小胶质细胞OGD/R模型建立后24 h焦亡相关蛋白GSDMD-N、caspase-1、IL-1β表达电泳图 |
迄今为止,HIE仍然缺乏有效的治疗手段。针对HIE导致的严重后遗症的预防仍是临床工作中难以攻克的难题。理论上,针对急性缺血细胞损伤的神经保护剂可以保护脑细胞,提高对HIBD的耐受性,从目前的研究结果看,在动物实验中具有疗效的药物,在临床试验中往往以失败告终。因此,发现HIE新的发病机制,对于HIE的治疗有重要的意义。本研究采用OGD/R模型模拟了体内缺氧缺血情况,观察小胶质细胞焦亡在HIBD中的作用。
近年来研究发现,细胞焦亡是一种由炎症性caspase诱发的细胞程序性死亡方式[14]。在分子水平上,细胞焦亡主要包括caspase-1依赖的经典途径和涉及caspase-4/5/11的非经典途径[15]。NLRP-3/caspase-1炎性小体作为经典途径细胞焦亡通路的核心,目前已被研究得比较清楚[16]。在识别病原体及内源性危险信号后,NLRP-3主要通过胞内的钾离子外流、溶酶体裂解及活性氧簇(reactive oxygen species, ROS)释放等途径活化,随后通过与凋亡相关点样蛋白及pro-caspase-1结合从而组装成NLRP-3/caspase-1炎性小体。caspase-1的激活如何触发焦亡?有研究发现[12],GSDMD可作为caspase-1激活细胞焦亡的关键性底物。GSDMD大约有480个氨基酸,分为N端结构域和C端结构域,二者由一长环连接。激活caspase-1可有效地切割GSDMD连接环位点。GSDMD在被上游因素激动后,使其活性N端结构域自C端结构域上释放出来,靶向结合脂质膜,并聚合成一个中空的环状低聚物,形成非选择性孔道,最终导致细胞肿胀,释放出大量成熟的IL-1β、IL-18促炎因子,从而诱发细胞焦亡[12, 17]。
细胞焦亡一般发生在巨噬细胞中,但也可发生在小胶质细胞中[18-19]。细胞焦亡可参与多种疾病的进展,在HIBD过程中扮演了重要角色,例如炎性小体与HIBD有着密切的联系,其可通过多种途径增加促炎因子IL-1β、IL-18前体的生成及分泌,并通过caspase-1的多样化效应,诱导脑缺血神经胶质细胞的焦亡[20]。
在本研究中,首先通过对大鼠小胶质细胞系OGD/R模型制备后各时间点焦亡相关蛋白GSDMD-N、caspase-1、IL-1β表达情况进行观察,发现在OGD/R模型制备完成后的0 h即有GSDMD-N、caspase-1、IL-1β表达升高,并且在24 h时间点达到高峰。提示小胶质细胞焦亡参与了HIBD的病理生理过程。随后利用慢病毒沉默GSDMD转染大鼠小胶质细胞系并且进行OGD/R实验,发现沉默GSDMD的大鼠小胶质细胞系在OGD/R损伤后,其细胞中焦亡相关蛋白GSDMD-N、caspase-1、IL-1β的表达水平发生了下调,伴有CCK-8检测发现细胞活性升高,以及LDH检测发现细胞毒性降低。这些结果提示,小胶质细胞焦亡加重HIBD。但是具体分子机制需有待进一步验证,后续我们也将进行进一步地研究。
| [1] |
de Vries LS, Jongmans MJ. Long-term outcome after neonatal hypoxic-ischaemic encephalopathy[J]. Arch Dis Child Fetal Neonatal Ed, 2010, 95(3): F220-F224. DOI:10.1136/adc.2008.148205 (  0) 0) |
| [2] |
Perlman M, Shah PS. Hypoxic-ischemic encephalopathy:challenges in outcome and prediction[J]. J Pediatr, 2011, 158(2 Suppl): e51-e54. (  0) 0) |
| [3] |
Hanisch UK, Kettenmann H. Microglia:active sensor and versatile effector cells in the normal and pathologic brain[J]. Nat Neurosci, 2007, 10(11): 1387-1394. DOI:10.1038/nn1997 (  0) 0) |
| [4] |
Adams KL, Gallo V. The diversity and disparity of the glial scar[J]. Nat Neurosci, 2018, 21(1): 9-15. (  0) 0) |
| [5] |
Donat CK, Scott G, Gentleman SM, et al. Microglial activation in traumatic brain injury[J]. Front Aging Neurosci, 2017, 9: 208. DOI:10.3389/fnagi.2017.00208 (  0) 0) |
| [6] |
Loane DJ, Kumar A. Microglia in the TBI brain:the good, the bad, and the dysregulated[J]. Exp Neurol, 2016, 275(Pt 3): 316-327. (  0) 0) |
| [7] |
Navarro V, Sanchez-Mejias E, Jimenez S, et al. Microglia in Alzheimer's disease:activated, dysfunctional or degenerative[J]. Front Aging Neurosci, 2018, 10: 140. DOI:10.3389/fnagi.2018.00140 (  0) 0) |
| [8] |
Liu F, Mccullough LD. Inflammatory responses in hypoxic ischemic encephalopathy[J]. Acta Pharmacol Sin, 2013, 34(9): 1121-1130. DOI:10.1038/aps.2013.89 (  0) 0) |
| [9] |
Bergsbaken T, Fink SL, Cookson BT. Pyroptosis:host cell death and inflammation[J]. Nat Rev Microbiol, 2009, 7(2): 99-109. DOI:10.1038/nrmicro2070 (  0) 0) |
| [10] |
Broz P, Dixit VM. Inflammasomes:mechanism of assembly, regulation and signalling[J]. Nat Rev Immunol, 2016, 16(7): 407-420. DOI:10.1038/nri.2016.58 (  0) 0) |
| [11] |
Nyström S, Antoine DJ, Lundbäck P, et al. TLR activation regulates damage-associated molecular pattern isoforms released during pyroptosis[J]. EMBO J, 2013, 32(1): 86-99. (  0) 0) |
| [12] |
Liu X, Zhang Z, Ruan J, et al. Inflammasome-activated gasdermin D causes pyroptosis by forming membrane pores[J]. Nature, 2016, 535(7610): 153-158. DOI:10.1038/nature18629 (  0) 0) |
| [13] |
Huang S, Gong T, Zhang T, et al. Zhongfenggao protects brain microvascular endothelial cells from oxygen-glucose deprivation/reoxygenation-induced injury by angiogenesis[J]. Bio Pharm Bull, 2019, 42(2): 222-230. DOI:10.1248/bpb.b18-00650 (  0) 0) |
| [14] |
Van Opdenbosch N, Lamkanfi M. Caspases in cell death, inflammation, and disease[J]. Immunity, 2019, 50(6): 1352-1364. DOI:10.1016/j.immuni.2019.05.020 (  0) 0) |
| [15] |
Ruan J, Wang S, Wang J. Mechanism and regulation of pyroptosis-mediated in cancer cell death[J]. Chem Biol Interact, 2020, 323: 109052. DOI:10.1016/j.cbi.2020.109052 (  0) 0) |
| [16] |
Martín-Sánchez F, Martínez-García JJ, Muñoz-García M, et al. Lytic cell death induced by melittin bypasses pyroptosis but induces NLRP3 inflammasome activation and IL-1β release[J]. Cell Death Dis, 2017, 8(8): e2984. DOI:10.1038/cddis.2017.390 (  0) 0) |
| [17] |
He WT, Wan H, Hu L, et al. Gasdermin D is an executor of pyroptosis and required for interleukin-1β secretion[J]. Cell Res, 2015, 25(12): 1285-1298. DOI:10.1038/cr.2015.139 (  0) 0) |
| [18] |
Galluzzi L, Vitale I, Aaronson SA, et al. Molecular mechanisms of cell death:recommendations of the Nomenclature Committee on Cell Death 2018[J]. Cell Death Differ, 2018, 25(3): 486-541. DOI:10.1038/s41418-017-0012-4 (  0) 0) |
| [19] |
McKenzie BA, Mamik MK, Saito LB, et al. Caspase-1 inhibition prevents glial inflammasome activation and pyroptosis in models of multiple sclerosis[J]. Proc Natl Acad Sci U S A, 2018, 115(26): E6065-E6074. DOI:10.1073/pnas.1722041115 (  0) 0) |
| [20] |
王幽梦, 鲁利群, 屈艺. 细胞焦亡与缺氧缺血性脑损伤[J]. 实用医学杂志, 2017, 33(23): 3998-4001. (  0) 0) |
 2020, Vol. 22
2020, Vol. 22


