脓毒症是由多种病原菌感染引起的全身炎症反应综合征,肝脏是脓毒症最容易累及的重要脏器之一,而肝细胞线粒体损伤是脓毒症介导急性肝损伤的主要机制之一[1-3]。罗汉果皂苷Ⅵ(mogroside Ⅵ, MⅥ)是罗汉果中的主要活性成分之一,目前对于MⅥ作用的报道中,Niu等[4]发现,罗汉果皂苷Ⅵ B(mogroside ⅥB, MⅥB)是一种从罗汉果粗提物中分离得到的葫芦糖苷,对过氧化物酶增殖激活受体γ辅助激活物1α(PGC-1α)的转录有激活作用,而PGC-1α在线粒体生物合成中起着主导作用,可以启动线粒体生物合成,调控线粒体DNA(mtDNA)的复制和转录[5]。由此推测,MⅥ可能通过促进PGC-1α的表达及活化在脓毒症致急性肝损伤中发挥肝保护作用。本研究拟探讨MⅥ对脓毒症致急性肝损伤小鼠肝组织的保护作用及其可能作用机制,以期为MⅥ的临床应用和脓毒症致急性肝损伤的防治提供新的思路和理论依据。
1 材料与方法 1.1 实验动物SPF级雄性C57BL/6小鼠60只,体重(20±2)g,由湖南省动物实验中心提供,动物合格证编号:SCXK(湘)2018-0010。饲养条件为温度22~24℃,湿度40%~60%,12 h/12 h明暗交替,术前禁食12 h,不禁水。
1.2 主要试剂及仪器MⅥ(纯度≥98%)购自上海纯优生物科技有限公司;PGC-1α抑制剂SR-18292购自美国MedChemExpress公司;丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、丙二醛(MDA)、超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-Px)试剂盒购于南京建成生物工程研究所;RIPA裂解液、BCA蛋白定量试剂盒和苏木精-伊红(HE)染色液购于上海碧云天生物技术有限公司;RNA提取试剂盒、实时荧光定量PCR试剂盒购自日本TaKaRa公司;PGC-1α、核呼吸因子1(NRF-1)、线粒体转录因子A(TFAM)多克隆抗体及GAPDH抗体购于美国Abcam公司;线粒体DNA(mtDNA)提取试剂盒购于德国QIAGEN公司。酶标仪购于美国Bio-Rad公司;凝胶成像仪购于美国Thermo Fisher Science公司;Image-Pro Plus 6.0图像分析系统购于美国Media Cybernetics公司。
1.3 动物造模及分组处理将60只小鼠适应性饲养1周后,随机分成假手术组、模型组、MⅥ低剂量组(低剂量组,25 mg/kg)、MⅥ高剂量组(高剂量组,100 mg/kg)和PGC-1α抑制剂组(抑制剂组,100 mg/kg MⅥ+30 mg/kg SR-18292),每组12只。3%戊巴比妥钠腹腔注射麻醉小鼠,除假手术组外,其他各组小鼠均采用盲肠结扎穿孔术(CLP)制备脓毒症小鼠模型[6],假手术组小鼠只进行相同开腹手术操作,不进行盲肠结扎和穿孔。术后6~12 h,小鼠出现寒战、高热(肛温≥40℃)、尿少、呼吸急促、萎靡少动等现象,即造模成功。造模成功后,根据前期预实验结果,低剂量组和高剂量组小鼠分别按照25 mg/kg和100 mg/kg MⅥ的剂量腹腔注射给药,而抑制剂组按照100 mg/kg MⅥ+30 mg/kg SR-18292的剂量腹腔注射给药,假手术组和模型组腹腔注射等量0.9%氯化钠溶液,每天1次,连续3 d。
1.4 ELISA检测血清中ALT和AST浓度取各组小鼠血清,按照ALT及AST试剂盒说明书进行操作,采用酶标仪在450 nm波长处测定OD值,根据标准曲线计算小鼠血清中ALT和AST的含量。
1.5 比色法检测肝组织中SOD、GSH-Px活性及MDA水平取各组小鼠部分肝组织称重,再置于冰上碾磨匀浆,4℃下11 800 r/min离心15 min,取上清液。按照SOD、GSH-Px及MDA试剂盒操作说明书分别加入相应试剂,孵育后测各样品吸光度值,计算SOD和GSH-Px活性及MDA水平。
1.6 HE染色观察肝组织病理学变化取各组小鼠部分肝组织于10%甲醛缓冲液中固定24 h,将组织脱水浸蜡、包埋,制作3~4 μm石蜡切片后行HE染色,于显微镜下观察肝组织病理学损伤并进行评分,评分标准包括[7]:碎片状坏死、血管炎性浸润、汇管区淋巴细胞浸润、肝细胞气球样病变和脂肪变性。损伤程度由轻到重依次标记为0、1、2、3分,累计总分为最终损伤评分。
1.7 RT-PCR检测肝组织中线粒体生物合成相关基因的mRNA水平取各组小鼠部分肝组织,采用TRIzol法提取各样本的总RNA,紫外分光光度计测定总RNA浓度。取2 μg总RNA,采用逆转录试剂盒合成cDNA,以cDNA为模板进行RT-PCR扩增。反应体系为:TB Green Premix 25 μL,上下游引物(10 μmol/L)各1 μL,cDNA 4 μL,灭菌水18 μL。反应条件为:95℃预变性60 s;95℃变性15 s,60℃退火15 s,共40个循环;72℃延伸45 s。以GAPDH为内参,采用2-△△Ct法计算PGC-1α、NRF-1和TFAM mRNA相对表达量。引物由南京金斯瑞生物科技有限公司设计合成,引物序列见表 1。
| 表 1 引物序列 |
|
|
取各组小鼠部分肝组织,剪碎后加入适量RIPA裂解液于冰上充分裂解30 min,4℃条件下11 800 r/min离心20 min,弃上清,采用BCA法测定蛋白浓度。取25 μg蛋白进行SDS-PAGE电泳分离蛋白,并将蛋白转移至PVDF膜上,5%脱脂牛奶室温封闭30 min,分别加入PGC-1α、NRF-1、TFAM和GAPDH一抗,4℃孵育过夜。次日加入辣根过氧化物酶标记的二抗,孵育1 h后用TBST洗涤3次,电化学发光显色、凝胶成像仪显像后,以GAPDH为内参计算总蛋白相对表达量。
1.9 肝组织线粒体提取取各组小鼠部分肝组织,剪碎后置于冰上研磨,并用PBS冲洗3次,随后加入5 mL/g线粒体分离试剂(0.07 mol/L蔗糖、0.22 mol/L甘露醇、0.001 mol/L乙二胺四乙酸、0.005 mol/L乙二醇双四乙酸、0.02 mol/L Tris缓冲液),在预冷的玻璃匀浆器中进行匀浆,6 450 r/min离心10 min后收集上清,12 900 r/min离心10 min后弃上清,沉淀即为粗提线粒体,将得到的线粒体重悬于预冷的线粒体冻存液中置于-80℃储存。
1.10 肝组织线粒体呼吸功能测定清洗呼吸测定仪的反应槽数次,加入测定介质(0.07 mol/L蔗糖、0.22 mol/L甘露醇、0.001 mol/L乙二胺四乙酸),待基线平稳后加入提取出的肝组织线粒体悬液,待内源底物完全消耗,基线走平后,加入外源底物,出现Ⅱ态呼吸,2 min后加入0.05 mol/L ADP,出现Ⅲ态呼吸。线粒体呼吸控制率=Ⅲ态呼吸率/Ⅱ态呼吸率。
1.11 RT-PCR检测肝组织线粒体DNA的拷贝数测定肝组织mtDNA浓度后,mtDNA拷贝数以线粒体编码基因细胞色素b的拷贝数为代表。引物序列:细胞色素b上游5'-AAAGCCACCTTGACCCGATT-3',下游3'-GATTCGTAGGGCCGCGATA-5',以β-actin作为内参,上游5'-AGTGTGACGTTGACATCCGTA-3',下游3'-CCAGAGCAGTAATCT-CCTTCT-5'。反应条件同1.7,采用2-△△Ct法计算mtDNA相对表达量。
1.12 统计学分析采用SPSS 22.0统计软件对数据进行统计分析,计量资料采用均数±标准差(x±s)表示,两组间数据比较采用两独立样本t检验,多组间数据比较采用单因素方差分析,组间两两比较采用SNK-q法。P < 0.05为差异有统计学意义。
2 结果 2.1 MⅥ对脓毒症致急性肝损伤小鼠肝功能的影响与假手术组比较,模型组小鼠血清中ALT和AST水平显著上升(P < 0.05);与模型组比较,高剂量组小鼠血清中ALT和AST水平显著下降(P < 0.05),而低剂量组差异无统计学意义(P > 0.05);与高剂量组比较,抑制剂组小鼠血清中ALT和AST水平显著上升(P < 0.05)。见表 2。
| 表 2 各组小鼠血清中ALT和AST水平比较 |
|
|
假手术组小鼠肝小叶结构完整清晰,肝细胞围绕中央静脉放射状排列,未见炎症细胞浸润;模型组和低剂量组小鼠肝小叶结构被破坏,中央静脉和汇管区周围出现桥接坏死,伴有大量炎症细胞浸润;高剂量组小鼠肝组织结构损伤较模型组明显减轻,肝小叶结构较清晰,少量炎症细胞浸润;抑制剂组汇管区炎症细胞浸润较高剂量组加重,肝细胞也出现肿胀,伴有大量炎症细胞浸润(图 1)。假手术组、模型组、低剂量组、高剂量组和抑制剂组小鼠肝组织病理学损伤评分分别为(1.3±0.5)、(9.4±1.1)、(8.6±1.1)、(4.9±0.6)和(7.8±1.4)分,各组比较差异有统计学意义(F=15.677,P=0.002)。与假手术组比较,模型组小鼠肝组织病理学损伤评分显著增加(P < 0.05);与模型组比较,高剂量组小鼠肝组织病理学损伤评分显著降低(P < 0.05),而低剂量组差异无统计学意义(P > 0.05);与高剂量组比较,抑制剂组小鼠肝组织病理学损伤评分显著增加(P < 0.05)。
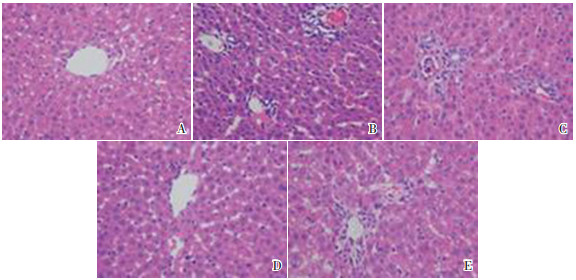
|
图 1 各组小鼠肝组织切片病理观察(HE染色,×200) A:假手术组;B:模型组;C:低剂量组;D:高剂量组;E:抑制剂组。假手术组小鼠肝小叶结构完整清晰,无损伤症状;模型组小鼠肝小叶结构破坏明显,中央静脉和汇管区周围出现桥接坏死,伴有大量炎症细胞浸润;低剂量组小鼠肝小叶结构破坏严重,损伤程度较模型组没有明显区别;高剂量组小鼠肝组织结构损伤较模型组明显减轻,肝小叶结构较清晰,少量炎症细胞浸润;抑制剂组小鼠汇管区炎症细胞浸润较高剂量组加重,肝细胞也出现肿胀,伴有大量炎症细胞浸润。 |
与假手术组比较,模型组小鼠肝组织中MDA含量显著增加,GSH-Px和SOD活性显著降低(P < 0.05);与模型组比较,高剂量组小鼠肝组织中MDA含量显著减少,GSH-Px和SOD活性显著增加(P < 0.05),而低剂量组差异无统计学意义(P > 0.05);与高剂量组比较,抑制剂组小鼠肝组织中MDA含量显著增加,GSH-Px和SOD活性显著降低(P < 0.05)。见表 3。
| 表 3 各组小鼠肝组织中MDA、GSH-Px和SOD含量比较 (x±s,n=12) |
|
|
与假手术组比较,模型组小鼠肝组织中PGC-1α、NRF-1、TFAM的mRNA和蛋白表达水平显著降低(P < 0.05);与模型组比较,高剂量组小鼠肝组织中PGC-1α、NRF-1、TFAM的mRNA和蛋白表达水平显著增加(P < 0.05),而低剂量组差异无统计学意义(P > 0.05);与高剂量组比较,抑制剂组小鼠肝组织中PGC-1α、NRF-1、TFAM的mRNA和蛋白表达水平显著减少(P < 0.05)。见图 2和表 4。
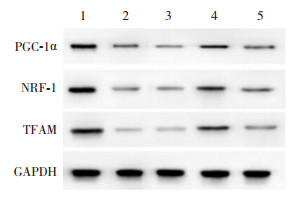
|
图 2 Western blot检测肝组织中PGC-1α、NRF-1和TFAM蛋白表达电泳图 1.假手术组;2.模型组;3.低剂量组;4.高剂量组;5.抑制剂组。 |
| 表 4 各组小鼠肝组织中PGC-1α、NRF-1和TFAM mRNA及其蛋白表达水平比较 (x±s,n=12) |
|
|
假手术组、模型组、低剂量组、高剂量组和抑制剂组小鼠肝组织线粒体呼吸控制率分别为(2.88±0.21)%、(1.36±0.15)%、(1.40±0.13)%、(2.47±0.18)%和(1.67±0.09)%,各组比较差异有统计学意义(F=34.304,P < 0.001)。与假手术组比较,模型组小鼠肝组织线粒体呼吸控制率显著降低(P < 0.05);与模型组比较,高剂量组小鼠肝组织线粒体呼吸控制率显著增加(P < 0.05),而低剂量组差异无统计学意义(P > 0.05);与高剂量组比较,抑制剂组小鼠肝组织线粒体呼吸控制率显著降低(P < 0.05)。
2.6 MⅥ对脓毒症致急性肝损伤小鼠肝脏mtDNA拷贝数的影响假手术组、模型组、低剂量组、高剂量组和抑制剂组小鼠肝脏mtDNA相对拷贝数分别为0.999±0.031、0.378±0.010、0.355±0.013、0.754±0.022和0.506±0.020,各组比较差异有统计学意义(F=27.554,P < 0.001)。与假手术组比较,模型组小鼠mtDNA拷贝数显著减少(P < 0.05);与模型组比较,高剂量组小鼠mtDNA拷贝数显著增加(P < 0.05),而低剂量组差异无统计学意义(P > 0.05);与高剂量组比较,抑制剂组小鼠mtDNA拷贝数显著减少(P < 0.05)。
3 讨论在脓毒症状态下,肝细胞线粒体的损伤可引起肝脏能量代谢和解毒功能障碍,导致肝功能不全甚至发生肝衰竭,而通过线粒体生物合成补充新的线粒体对于组织正常功能及应激条件下细胞的适应性至关重要[8]。近年来“代谢复苏”的概念被越来越多的学者提及,即可通过线粒体靶向治疗达到对脓毒症致急性肝损伤的治疗目的。本研究通过构建脓毒症小鼠模型,探讨MⅥ对脓毒症致肝损伤的保护作用及可能作用机制。
血清ALT和AST是急性肝损伤的早期标志,具有很高的特异度和灵敏度,临床上最常用于反映肝功能损害程度,其含量与肝损伤程度呈正比[9]。本研究结果显示,模型组小鼠血清中ALT和AST含量显著升高,同时肝组织HE染色结果显示肝小叶结构紊乱,肝细胞病变明显,且伴有大量炎症细胞浸润,说明脓毒症造模成功且已导致肝损伤。而高剂量MⅥ干预可降低脓毒症小鼠血清中ALT和AST含量,并改善肝脏病理变化,初步说明MⅥ对脓毒症引发的肝损伤具有保护作用。
脓毒症时体内会产生大量的氧自由基,而自由基的形成及其引发的脂质过氧化反应是肝损伤的主要机制之一。MDA是脂质过氧化物的主要降解产物,而SOD和GSH-Px是两种主要的抗氧化剂,在维持机体的氧化-抗氧化动态平衡中起着重要作用,可将其作为抗氧化能力的检测指标[10]。Bacanlı等[11]研究结果显示,脓毒症大鼠模型肝组织中GSH-Px和SOD活性降低,而MDA含量上升。本研究结果显示,模型组小鼠肝组织中MDA含量明显升高,GSH-Px和SOD活性明显降低;而高剂量MⅥ能显著降低小鼠肝组织中MDA含量,增加GSH-Px和SOD活性,提示MⅥ能有效降低脓毒症致肝损伤小鼠肝组织氧化应激水平。
众多研究发现[12-13],脓毒症可通过诱导mtDNA的损伤,导致mtDNA基因突变和数量发生改变,从而降低线粒体氧化磷酸化效应使ATP合成障碍,进一步造成组织损伤。线粒体损伤后会启动一系列的自我保护机制,包括启动线粒体生物合成来增加线粒体的数量,从而代偿受损线粒体的功能。而肝脏线粒体呼吸控制率可反映线粒体膜的完整性和氧化磷酸化的偶联程度,是反映线粒体功能的重要指标之一[14]。本研究结果显示,模型组小鼠肝组织线粒体呼吸控制率和mtDNA拷贝数均显著降低,而高剂量MⅥ干预可显著增加小鼠肝组织线粒体呼吸控制率和mtDNA拷贝数,提示MⅥ可通过改善肝脏线粒体功能障碍,减轻脓毒症造成的急性肝损伤症状。
线粒体生物合成过程受到细胞内外多个蛋白及信号通路的调控,PGC-1α作为主要的辅助激活因子,在线粒体生物合成的调控中起到中心作用,其通过激活NRF1/2成为TFAM的启动子,从而启动线粒体基因的转录和复制。NRF-1是调控线粒体生物合成最主要的转录因子,可促进线粒体氧化磷酸化,转录调控呼吸酶相关的细胞核基因,影响线粒体基因组的复制、转录、相关蛋白的表达[15]。为进一步明确MⅥ改善脓毒症致肝损伤的具体作用机制,本研究对肝组织中线粒体生物合成相关基因的表达水平进行了检测,结果显示,模型组小鼠肝组织中PGC-1α、NRF-1、TFAM的mRNA和蛋白表达水平显著降低,而高剂量MⅥ干预可显著上调小鼠肝组织中PGC-1α、NRF-1、TFAM的mRNA和蛋白表达水平。为了进一步探讨MⅥ干预是否通过调控PGC-1α表达参与对脓毒症致肝损伤的保护作用,本研究采用PGC-1α抑制剂SR-18292联合高剂量MⅥ进行干预。结果显示,与单纯的高剂量MⅥ干预结果相比,抑制剂组小鼠肝组织损伤程度又加重,肝组织氧化应激水平又显著增加,且肝组织中PGC-1α、NRF-1、TFAM的mRNA和蛋白表达水平显著降低,表明SR-18292可抑制高剂量MⅥ的干预效果。提示,MⅥ可能通过PGC-1α途径促进肝细胞线粒体的生物合成,降低氧化应激水平,改善脓毒症小鼠的肝组织损伤程度。
综上所述,MⅥ可通过降低肝脏氧化应激水平,改善脓毒症小鼠肝组织损伤,其机制可能是通过促进PGC-1α的表达及活化,进而增强肝脏线粒体生物合成途径实现的。
| [1] |
Huang M, Cai S, Su J. The pathogenesis of sepsis and potential therapeutic targets[J]. Int J Mol Sci, 2019, 20(21): 5376. DOI:10.3390/ijms20215376 (  0) 0) |
| [2] |
Woźnica EA, Inglot M, Woźnica RK, et al. Liver dysfunction in sepsis[J]. Adv Clin Exp Med, 2018, 27(4): 547-551. DOI:10.17219/acem/68363 (  0) 0) |
| [3] |
赵广明, 胡占升. 脓毒症肝损伤的发病机制与治疗研究进展[J]. 解放军医学杂志, 2019, 44(6): 515-520. (  0) 0) |
| [4] |
Niu B, Ke CQ, Li BH, et al. Cucurbitane glucosides from the crude extract of Siraitia grosvenorii with moderate effects on PGC-1α promoter activity[J]. J Nat Prod, 2017, 80(5): 1428-1435. DOI:10.1021/acs.jnatprod.6b01086 (  0) 0) |
| [5] |
Cheng CF, Ku HC, Lin H. PGC-1α as a pivotal factor in lipid and metabolic regulation[J]. Int J Mol Sci, 2018, 19(11): 3447. DOI:10.3390/ijms19113447 (  0) 0) |
| [6] |
Takahashi W, Watanabe E, Fujimura L, et al. Kinetics and protective role of autophagy in a mouse cecal ligation and puncture-induced sepsis[J]. Crit Care, 2013, 17(4): R160. DOI:10.1186/cc12839 (  0) 0) |
| [7] |
闫梦莹, 王妍妍, 毛幸, 等. 脓毒症小鼠肝损伤时FUNDC1/LC3Ⅱ信号通路的变化[J]. 中华麻醉学杂志, 2018, 38(6): 736-738. (  0) 0) |
| [8] |
Xing W, Yang L, Peng Y, et al. Ginsenoside Rg3 attenuates sepsis-induced injury and mitochondrial dysfunction in liver via AMPK-mediated autophagy flux[J]. Biosci Rep, 2017, 37(4): BSR20170934. DOI:10.1042/BSR20170934 (  0) 0) |
| [9] |
王洪雨, 宋学敏, 张宗泽, 等. 脓毒症小鼠肝损伤时胆碱能抗炎通路与自噬的关系[J]. 中华麻醉学杂志, 2019, 39(2): 239-242. (  0) 0) |
| [10] |
Kingir ZB, Özdemir Kural ZN, Cam ME, et al. Effects of dapagliflozin in experimental sepsis model in rats[J]. Ulus Travma Acil Cerrahi Derg, 2019, 25(3): 213-221. (  0) 0) |
| [11] |
Bacanlı M, Aydın S, Taner G, et al. Does rosmarinic acid treatment have protective role against sepsis-induced oxidative damage in Wistar Albino rats?[J]. Hum Exp Toxicol, 2016, 35(8): 877-886. DOI:10.1177/0960327115607971 (  0) 0) |
| [12] |
Harrington JS, Choi AMK, Nakahira K. Mitochondrial DNA in sepsis[J]. Curr Opin Crit Care, 2017, 23(4): 284-290. (  0) 0) |
| [13] |
Zuo Y, Dang R, Peng H, et al. LL-37 exacerbates local inflammation in sepsis-induced acute lung injury by preventing mitochondrial DNA (mtDNA) degradation-induced autophagy[J]. Med Sci Monit, 2019, 25: 6193-6203. DOI:10.12659/MSM.915298 (  0) 0) |
| [14] |
张媛媛, 董艾莉, 王妍妍, 等. 氢对脓毒症小鼠心肌线粒体Drp1表达的影响[J]. 中华麻醉学杂志, 2017, 37(9): 1136-1138. (  0) 0) |
| [15] |
Lu P, Hogan-Cann AD, Kamboj A, et al. Poly(ADP-ribose) polymerase-1 inhibits mitochondrial respiration by suppressing PGC-1α activity in neurons[J]. Neuropharmacology, 2019, 160: 107755. DOI:10.1016/j.neuropharm.2019.107755 (  0) 0) |
 2020, Vol. 22
2020, Vol. 22


