急性淋巴细胞白血病(acute lymphoblastic leukemia, ALL)是一种常见的血液系统恶性肿瘤性疾病,以急性B淋巴细胞白血病(B-ALL)为主,是儿童发病率最高的恶性肿瘤疾病。而儿童B-ALL中,ETV6-RUNX1融合基因检出率为25%[1],E2A-PBX1融合基因检出率为3%~5%[2]。在随着ALL检测技术、治疗方法的不断发展,儿童ALL的生存率不断提高,但仍有一部分儿童ALL患者可出现复发与死亡。许多研究表明,微小残留病(minimal residual disease, MRD)可作为白血病预后的独立预测因素,对提示预后、判断疗效、指导治疗有重要意义[3-4]。检测MRD的方法有多种,其中流式细胞术在临床上的应用最为广泛。
然而,融合基因阳性的B-ALL患儿与融合基因阴性的B-ALL患儿相比,通过流式细胞术检测的MRD结果是否具有相同的临床意义,既往尚缺乏相关确切结论。本研究对融合基因阴性、融合基因ETV6-RUNX1阳性、融合基因E2A-PBX1阳性B-ALL患儿的临床资料进行回顾性分析,探讨不同融合基因背景下MRD在B-ALL患儿中的临床意义。
1 资料与方法 1.1 研究对象本研究中,选取曾检测ETV6-RUNX1、E2A-PBX1、BCR-ABL1和MLL基因重排这4种常见的与预后相关的融合基因的患儿[5],对融合基因阴性(即4种融合基因均为阴性)、ETV6-RUNX1阳性、E2A-PBX1阳性的B-ALL患儿进行分析。纳入2008年1月至2015年4月于中国医学科学院血液病医院儿童血液病诊疗中心就诊的B-ALL患儿共856例,选取就诊期间曾检测融合基因并且曾采用流式细胞术检测MRD的B-ALL患儿共441例,其中包括融合基因阴性患儿336例(76.2%)、ETV6-RUNX1阳性患儿79例(17.9%)、E2A-PBX1阳性患儿26例(5.9%)。分析441例患儿在化疗过程中3个时间点的MRD检测结果:诱导缓解治疗的第15天(第1个时间点,time point 1, 以下称“TP1”)、诱导缓解治疗的第33天(第2个时间点,time point 2,以下称“TP2”)、整体治疗的第12周(第3个时间点,time point 3,以下称“TP3”)。并分析441例患儿的分子遗传学结果、治疗方案、治疗效果等临床资料。在441例患儿中,323例有TP1、TP2、TP3共3个时间点的MRD结果,另外118例患儿至少有1个时间点的MRD结果。所有患儿的诊断及治疗均符合CCLG-ALL 2008方案[6]。
1.2 MRD阳性分界值参考既往研究提出的B-ALL中MRD阳性分界值,本研究中TP1时MRD以1×10-2为阳性分界值,TP2和TP3时以1×10-4为阳性分界值[4]。
1.3 随访查阅患儿就诊病历及电话随访等方式了解预后,末次随访日期为2018年12月。本研究中位随访时间为66个月(范围为2~127个月)。总生存(overall survival, OS)期为初诊日期至患儿死亡(包括任何原因)或至末次生存随访日期。无事件生存(event-free survival, EFS)期是指自初诊日期到发生任何事件的时间,事件评估包括复发、任何原因导致的死亡、感染、发生二次肿瘤或失访。ALL的复发标准参照《血液病诊断及疗效标准》[7]。
1.4 流式细胞术检测进行诱导缓解治疗后,分别于TP1、TP2、TP3共3个时间点抽取骨髓标本3~4 mL,分离出有核细胞。对于2014年5月前的初诊患儿,流式细胞术采用四色荧光免疫直接标记法,2014年5月后初诊患儿采用八色荧光免疫直接标记法。其中,B-ALL四色抗体组合为:CD38/CD34/CD19/CD45;CD38/CD13+33/CD19/CD45;CD38/CD10/CD19/CD20;八色抗体组合:CD38-FITC、CD10-PE、CD20-PE-CY7、CD19-APC、CD34-PerCP-cy5.5、CD33-BV421、CD45-BD Horizon V500(七色为骨架抗体,部分患儿加做CD13或CD58)。MRD的具体检测方法见参考文献[8-10]。
1.5 统计学分析采用SPSS 25.0软件对数据进行统计学分析。正态分布的计量资料用均数±标准差(x±s)表示,非正态分布的计量资料用中位数及范围表示。计数资料用例数和百分比(%)表示,组间差异比较采用χ2检验。对非正态分布的计量资料的组间比较采用Kruskal-Wallis检验。生存分析采用Kaplan-Meier法,组间生存率的比较采用log-rank检验。P < 0.05为差异有统计学意义。
2 结果 2.1 不同融合基因背景患儿的临床特征融合基因阴性、ETV6-RUNX1阳性、E2A-PBX1阳性3组患儿年龄、初诊白细胞水平、性别、疾病危险分级、3个时间点MRD阳性率的比较差异均无统计学意义(P > 0.05),见表 1。
| 表 1 不同融合基因背景的B-ALL患儿的临床特征 |
|
|
融合基因阴性组的5年OS率为(79.4±2.3)%,ETV6-RUNX1阳性组为(89.3±3.6)%,E2A-PBX1阳性组为(63.6±9.8)%,3组的5年OS率差异有统计学意义(χ2=9.223,P=0.010)。融合基因阴性组5年EFS率为(69.6±2.6)%,ETV6-RUNX1阳性组为(75.1±5.0)%,E2A-PBX1阳性组为(57.1±9.8)%,3组的5年EFS率差异无统计学意义(χ2=2.896,P=0.235)。
2.2 融合基因阴性患儿MRD与预后的关系在融合基因阴性的336例B-ALL患儿中,TP1、TP2、TP3时,MRD阳性组的5年OS率和5年EFS率均低于MRD阴性组,差异均有统计学意义(P < 0.05),见图 1及表 2。
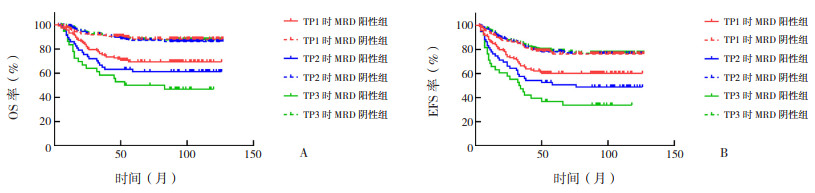
|
图 1 融合基因阴性患儿不同时间点MRD阳性组和阴性组OS率(图A)和EFS率(图B)的比较 TP1、TP2、TP3时,MRD阳性组的OS率和EFS率均低于MRD阴性组。[B-ALL]急性B淋巴细胞白血病;[MRD]微小残留病;[OS]总生存;[EFS]无事件生存;[TP1]诱导缓解治疗的第15天;[TP2]诱导缓解治疗的第33天;[TP3]整体治疗的第12周。 |
| 表 2 不同融合基因背景的B-ALL患儿的5年OS率和5年EFS率 |
|
|
融合基因阴性的B-ALL患儿,TP1、TP2、TP3时,MRD阳性组的复发率和病死率均高于MRD阴性组,差异有统计学意义(P < 0.05),见表 3。
| 表 3 不同融合基因背景的B-ALL患儿的复发和死亡情况 |
|
|
在ETV6-RUNX1阳性的79例B-ALL患儿中,TP1时MRD阳性组的5年OS率和5年EFS率显著低于MRD阴性组(P < 0.05),见表 2及图 2;复发率和病死率均显著高于MRD阴性组(P < 0.05),见表 3。而TP2及TP3时MRD阳性组与阴性组的5年OS率、5年EFS率的比较差异均无统计学意义(P > 0.05),见表 2及图 2;TP2及TP3时MRD阳性组与阴性组相比,复发率、病死率的比较差异均无统计学意义(P > 0.05),见表 3。
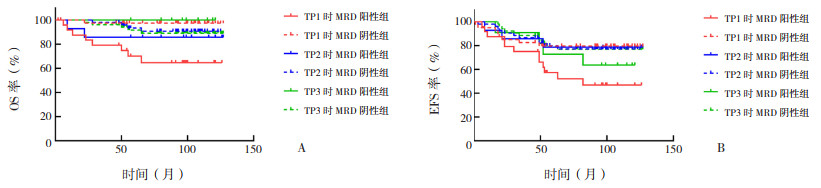
|
图 2 ETV6-RUNX1阳性患儿不同时间点MRD阳性组及阴性组OS率(图A)和EFS率(图B)的比较 仅在TP1时,MRD阳性组的OS率和EFS率低于MRD阴性组,在TP2、TP3时两组的OS率和EFS率比较差异均无统计学意义。[B-ALL]急性B淋巴细胞白血病;[OS]总生存;[EFS]无事件生存;[MRD]微小残留病;[TP1]诱导缓解治疗的第15天;[TP2]诱导缓解治疗的第33天;[TP3]整体治疗的第12周。 |
在E2A-PBX1阳性的26例B-ALL患儿中,TP1、TP2及TP3时MRD阳性组与阴性组相比,5年OS率(表 2及图 3A)、复发率(表 3)、病死率(表 3)的比较差异均无统计学意义(P > 0.05)。
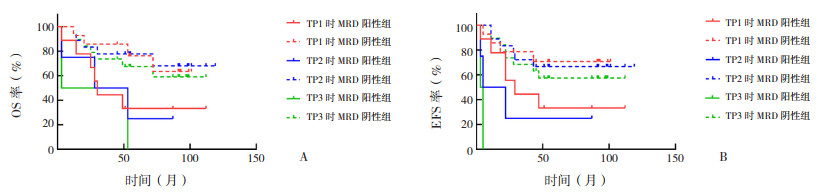
|
图 3 E2A-PBX1阳性患儿不同时间点MRD阳性组和阴性组OS率(图A)和EFS率(图B)的比较 TP1、TP2及TP3时,MRD阳性组与MRD阴性组相比,OS率差异均无统计学意义。TP1时,MRD阳性组与阴性组的5年EFS率的比较差异无统计学意义。TP2及TP3时,MRD阳性组的EFS率均显著低于MRD阴性组。[B-ALL]急性B淋巴细胞白血病;[OS]总生存;[EFS]无事件生存;[MRD]微小残留病;[TP1]诱导缓解治疗的第15天;[TP2]诱导缓解治疗的第33天;[TP3]整体治疗的第12周。 |
TP1时,MRD阳性组与阴性组的5年EFS率的比较差异无统计学意义(P=0.194),见表 2及图 3B。而TP2及TP3时,MRD阳性组的5年EFS率均显著低于MRD阴性组(P < 0.05),见表 2及图 3B。
3 讨论ETV6-RUNX1融合基因是由(t12;21)(p13;q22)易位形成,是儿童B-ALL中最常见的融合基因,既往研究认为ETV6-RUNX1阳性的B-ALL在儿童B-ALL中属于预后较好的亚型[1]。许多研究表明,ETV6-RUNX1阳性的B-ALL预后比融合基因阴性的B-ALL预后好[11-12]。本研究中,ETV6-RUNX1阳性的B-ALL患儿5年OS率和5年EFS率均高于融合基因阴性患儿,也说明ETV6-RUNX1是儿童B-ALL中预后良好的分子遗传学标志。而既往研究认为E2A-PBX1阳性的B-ALL预后较差,易出现早期复发[13]。本研究中,E2A-PBX1阳性的B-ALL患儿5年OS率和5年EFS率均低于融合基因阴性患儿,亦与既往研究[13]结论一致。
目前,临床中将MRD作为ALL预测复发的关键指标,有研究认为诱导治疗12周内的MRD对预后提示意义最大,对危险分层的指导意义最大[4]。本研究中,对于融合基因阴性的B-ALL患儿,MRD对OS率、EFS率、复发率、病死率等预后指标均有明确的提示意义,MRD阳性组预后更差。而对于ETV6-RUNX1阳性的B-ALL患儿中,仅诱导治疗后第15天时的MRD对预后有提示意义,而诱导治疗后第33天和第12周时的MRD对预后并没有提示意义。对于E2A-PBX1阳性的B-ALL患儿,MRD对OS率、复发率、病死率无提示意义,只有诱导治疗后第33天及12周时MRD对EFS率有提示意义。
本研究中,对于ETV6-RUNX1阳性的B-ALL患儿,仅诱导治疗后第15天时的MRD对预后有提示意义,说明MRD对于ETV6-RUNX1阳性患儿预后的提示意义欠佳。既往研究表明,尽管ETV6-RUNX1阳性的B-ALL患儿预后相对更好,但是该类型仍有10%的患儿出现化疗药耐药和复发, 且多是在维持期或停药后3年以上的晚期复发[14]。2006年,一项纳入12例ETV6-RUNX1阳性B-ALL患儿的研究表明,低水平的MRD阳性对患儿的早期预后没有提示意义[15]。在ETV6-RUNX1阳性的B-ALL患儿中,MRD阳性对于其预后是否有影响,仍需要更多随访时间长的研究进一步探讨。
本研究中,对于E2A-PBX1阳性的B-ALL患儿,3个时间点的MRD在OS率、复发率、病死率方面均无预后提示意义。2017年,St. Jude儿童医院一项纳入28例E2A-PBX1阳性的ALL患儿的研究表明,对于E2A-PBX1阳性的ALL,MRD对预后的预测意义欠佳。该研究认为MRD阳性阈值的选择和检测时间点的选择,不应一概而论,而应该根据不同的白血病亚型来定[16]。
既往也有研究提出,对于一些伴其他遗传学异常的ALL亚型,也可存在MRD预测意义与实际预后不一致的现象。例如,21号染色体内部扩增(iAMP21)是儿童B-ALL的一个独特亚型。英国的一项随机对照研究显示,iAMP21患者MRD阳性率与预后没有明确的联系[17]。另外也有研究表明,伴4号和10号染色体三体的ALL患者预后较好,但其MRD阳性的频率高达20.3%,提示MRD阳性的临床意义可能并不适用于所有ALL患者[18]。有研究提出,对于ALL的危险分层,需要结合遗传学亚型,对于不同遗传学亚型,应设置特异性的MRD阈值,有利于更好地识别患者预后[19]。本研究中,对于融合基因阴性、ETV6-RUNX1、E2A-PBX1阳性的B-ALL患儿,统一采用相同的MRD检测时间和MRD阳性阈值,发现融合基因阴性患儿的MRD对预后提示意义最为明确,而ETV6-RUNX1阳性患儿和E2A-PBX1阳性ALL患儿中MRD对预后提示意义均欠佳。因此本研究结果也提示,对于不同遗传学亚型的ALL,可能需要不同的MRD检测时间和MRD阳性阈值,以提高预后识别能力。
关于分子遗传学异常如何影响白血病细胞的清除动力学及复发时的增殖动力学,目前并没有明确的认识。对于如何把分子遗传学异常和MRD整合应用于B-ALL风险分层也没有形成共识。有研究表明,ETV6-RUNX1阳性患者呈现出快速的治疗反应,这与该类型患者预后较好一致。而E2A-PBX1阳性患者,作为一种中危的白血病亚型,却在化疗后表现出比ETV6-RUNX1更快的MRD清除能力[19]。理解不同遗传学亚型的白血病细胞清除及复发的动力学,有助于针对不同遗传学亚型的ALL设置特异性的MRD检测时间及MRD阳性阈值,进一步提高MRD对预后评估的准确性。
本研究中检测MRD采用的是流式细胞术,此外临床上检测MRD常用的方法还有实时荧光定量聚合酶链反应(RQ-PCR)。流式细胞术灵敏度较高,适用于绝大多数B-ALL患者,并且价格相对低,因此在临床上应用非常广泛。然而,具有不同遗传学背景的白血病残留细胞在清除时、复发时的动力学可能不尽相同,导致通过目前的白血病共识所解读出MRD的预后意义,与实际预后可能不完全一致。另外,目前不同实验室在抗体组合、样本处理等环节上并未达到完全标准化,而且化疗药物的使用也可能影响白血病细胞的免疫表型,出现“免疫漂移”,导致基于流式细胞术的MRD存在一定的局限性[8]。
而RQ-PCR具有更高的灵敏度及特异度。RQ-PCR检测MRD主要包括两种方法:检测白血病融合基因,检测B细胞受体或T细胞受体的基因重排区域。前一种方法检测的灵敏度为10-4~10-6,但只有部分患者有可检测的融合基因,并且PCR产物的污染可能会导致假阳性,融合基因的稳定性也可能会随着时间的推移而下降。后一种方法检测的灵敏度为10-4~10-5,适用于绝大多数B-ALL患者,不过此方法需设计患者特异性的引物,实验过程较为繁琐,并且如果白血病细胞出现重排基因可导致MRD假阴性[20]。不同的MRD检测方法各有优势,也各有局限性。在进行ALL的MRD检测时,如果能综合采用流式细胞术和RQ-PCR,可提高检测的可靠性。
综上,本研究发现,在融合基因阴性的ALL患儿中,诱导缓解后第15天、第33天和整体治疗的第12周时的MRD阳性组OS率、EFS率更低,复发率、病死率更高,提示预后不良。然而,对于ETV6-RUNX1阳性ALL患儿,仅诱导缓解后第15天时MRD阳性组OS率、EFS率更低,复发率、病死率更高,提示预后不良;诱导缓解后第33天和12周时MRD对预后无明显意义。在E2A-PBX1阳性ALL患儿中,3个时间点的MRD对预后提示意义均欠佳。对于不同遗传学背景的白血病,可能需要进一步探索其残留白血病细胞在清除时、复发时的动力学,对于不同遗传学亚型的ALL可能需要特异性的MRD检测时间及MRD阳性阈值。另外,条件允许时,联合多种方法检测MRD可减少假阳性及假阴性的情况。这些举措可能会有利于进一步提高MRD对预后评估的可靠性,更精准地识别出高复发风险的患儿,从而及时地进行治疗调整,改善白血病患儿的预后。
| [1] |
Dun KA, Vanhaeften R, Batt TJ, et al. BCR-ABL1 gene rearrangement as a subclonal change in ETV6-RUNX1-positive B-cell acute lymphoblastic leukemia[J]. Blood Adv, 2016, 1(2): 132-138. DOI:10.1182/bloodadvances.2016000463 (  0) 0) |
| [2] |
Hong Y, Zhao X, Qin YZ, et al. The prognostic role of E2A-PBX1 expression detected by real-time quantitative reverse transcriptase polymerase chain reaction (RQ-PCR) in B cell acute lymphoblastic leukemia after allogeneic hematopoietic stem cell transplantation[J]. Ann Hematol, 2018, 97(9): 1547-1554. DOI:10.1007/s00277-018-3338-1 (  0) 0) |
| [3] |
Theunissen P, Mejstrikova E, Sedek L, et al. Standardized flow cytometry for highly sensitive MRD measurements in B-cell acute lymphoblastic leukemia[J]. Blood, 2017, 129(3): 347-357. DOI:10.1182/blood-2016-07-726307 (  0) 0) |
| [4] |
van Dongen JJ, van der Velden VH, Brüggemann M, et al. Minimal residual disease diagnostics in acute lymphoblastic leukemia:need for sensitive, fast, and standardized technologies[J]. Blood, 2015, 125(26): 3996-4009. DOI:10.1182/blood-2015-03-580027 (  0) 0) |
| [5] |
中国医师协会儿科医师分会小儿血液肿瘤专业委员会, 中华医学会儿科学分会血液学组. 儿童急性早幼粒细胞白血病诊疗规范(2018年版)解读[J]. 中华儿科杂志, 2019, 57(10): 757-760. (  0) 0) |
| [6] |
Cui L, Li ZG, Chai YH, et al. Outcome of children with newly diagnosed acute lymphoblastic leukemia treated with CCLG-ALL 2008:the first nation-wide prospective multicenter study in China[J]. Am J Hematol, 2018, 93(7): 913-920. DOI:10.1002/ajh.25124 (  0) 0) |
| [7] |
张之南, 沈悌. 血液病诊断及疗效标准[M]. 第3版. 北京: 科学出版社, 2007: 19-23.
(  0) 0) |
| [8] |
中国免疫学会血液免疫分会临床流式细胞术学组. 多参数流式细胞术检测急性白血病及浆细胞肿瘤微小残留病中国专家共识(2017年版)[J]. 中华血液学杂志, 2017, 38(12): 1001-1011. (  0) 0) |
| [9] |
中国免疫学会血液免疫分会临床流式细胞术学组. 四色流式细胞术用于急性白血病免疫分型的中国专家共识(2015年版)[J]. 中华血液学杂志, 2015, 36(4): 265-271. (  0) 0) |
| [10] |
Wood BL. Principles of minimal residual disease detection for hematopoietic neoplasms by flow cytometry[J]. Cytometry B Clin Cytom, 2016, 90(1): 47-53. DOI:10.1002/cyto.b.21239 (  0) 0) |
| [11] |
Polak R, Bierings MB, van der Leije CS, et al. Autophagy inhibition as a potential future targeted therapy for ETV6-RUNX1-driven B-cell precursor acute lymphoblastic leukemia[J]. Haematologica, 2019, 104(4): 738-748. DOI:10.3324/haematol.2018.193631 (  0) 0) |
| [12] |
Ampatzidou M, Papadhimitriou SI, Paterakis G, et al. ETV6/RUNX1-positive childhood acute lymphoblastic leukemia (ALL):the spectrum of clonal heterogeneity and its impact on prognosis[J]. Cancer Genet, 2018, 224-225: 1-11. DOI:10.1016/j.cancergen.2018.03.001 (  0) 0) |
| [13] |
Jeha S, Pei D, Raimondi SC, et al. Increased risk for CNS relapse in pre-B cell leukemia with the t(1;19)/TCF3-PBX1[J]. Leukemia, 2009, 23(8): 1406-1409. DOI:10.1038/leu.2009.42 (  0) 0) |
| [14] |
王邢玮, 李本尚, 沈树红, 等. ETV6/RUNX1阳性儿童急性B系淋巴细胞白血病临床预后研究[J]. 临床儿科杂志, 2016, 34(5): 321-325. (  0) 0) |
| [15] |
Metzler M, Mann G, Monschein U, et al. Minimal residual disease analysis in children with t(12;21)-positive acute lymphoblastic leukemia:comparison of Ig/TCR rearrangements and the genomic fusion gene[J]. Haematologica, 2006, 91(5): 683-686. (  0) 0) |
| [16] |
Pui CH, Pei D, Raimondi SC, et al. Clinical impact of minimal residual disease in children with different subtypes of acute lymphoblastic leukemia treated with response-adapted therapy[J]. Leukemia, 2017, 31(2): 333-339. DOI:10.1038/leu.2016.234 (  0) 0) |
| [17] |
Huang AJ, Huang CM, Tang GS, et al. Impact of clinical utility of MRD assessment with different techniques on survival in acute B lymphoblastic leukemia[J]. Leuk Lymphoma, 2018, 59(5): 1073-1083. DOI:10.1080/10428194.2017.1369072 (  0) 0) |
| [18] |
Borowitz MJ, Pullen DJ, Shuster JJ, et al. Minimal residual disease detection in childhood precursor-B-cell acute lymphoblastic leukemia:relation to other risk factors. A Children's Oncology Group study[J]. Leukemia, 2003, 17(8): 1566-1572. DOI:10.1038/sj.leu.2403001 (  0) 0) |
| [19] |
O'Connor D, Enshaei A, Bartram J, et al. Genotype-specific minimal residual disease interpretation improves stratification in pediatric acute lymphoblastic leukemia[J]. J Clin Oncol, 2018, 36(1): 34-43. DOI:10.1200/JCO.2017.74.0449 (  0) 0) |
| [20] |
Szczepański T. Why and how to quantify minimal residual disease in acute lymphoblastic leukemia?[J]. Leukemia, 2007, 21(4): 622-626. DOI:10.1038/sj.leu.2404603 (  0) 0) |
 2020, Vol. 22
2020, Vol. 22


