2. 广东省妇幼保健院新生儿科, 广东 广州 511400;
3. 河北省儿童医院新生儿科, 河北 石家庄 050000
2. Department of Neonatology, Affiliated Hospital of Guilin Medical University, Guilin, Guangxi 541001, China
近年来研究发现Wnt/β-catenin信号通路参与了肺癌[1]、高氧肺损伤[2]、肺纤维化[3]的发病。通路中关键因子β-catenin的富集和降解直接影响着Wnt信号通路的活化,而β-catenin蛋白被降解的关键是其泛素化-去泛素化过程。有文献表明,高氧暴露早期大鼠肺组织中泛素-蛋白酶途径被激活,并参与肺损伤过程[4];泛素-特异性蛋白酶7(ubiquitin-specific protease 7, USP7)通过对β-catenin去泛素化参与了Wnt信号通路,在结肠癌中起积极作用[5];有研究表明在博莱霉素诱导的小鼠纤维化肺组织中USP7表达增强[6];本课题组前期研究已表明β-catenin受高氧诱导时表达增加[2],由此猜测USP7可能通过对β-catenin去泛素化在高氧肺损伤中起一定作用。故本文通过观察USP7特异性抑制剂P5091干预前后,高氧暴露下的早产鼠肺组织中USP7、β-catenin、α-SMA的表达水平的变化,了解USP7在高氧致早产鼠肺损伤发生发展中的作用,可能为临床上支气管肺发育不良(bronchopulmonary dysplasia, BPD)的防治提供新思路。
1 材料与方法 1.1 主要试剂及仪器总RNA提取试剂盒(北京天根生化科技有限公司),引物(美国Invitrogen公司),USP7一抗、β-catenin一抗、α-SMA一抗(美国Abcam公司),PCR仪(美国Bio-Rad公司),Tanon4100型全自动数码凝胶成像分析系统(上海天能公司),ChemiDo-cXRS图像采集系统(美国Bio-Rad公司)。
1.2 动物模型的分组及制备清洁级成年健康Wistar大鼠60只均购自桂林医学院实验动物中心,雌鼠45只,体重220~260 g,雄鼠15只,体重260~320 g,按雌雄比例3 : 1夜间合笼,次日晨取雌鼠阴道分泌物镜检,见精子即为受孕第1天,孕21 d大鼠剖宫产后取出的新生大鼠即为早产鼠。将生后24 h存活的早产鼠按随机数字表法随机分为高氧组和空气组,每组90只;各组再随机分为干预组及对照组2个亚组,每组45只。干预组早产鼠每天腹腔注射USP7特异性抑制剂P5091(5 mg/kg),对照组给予同等剂量生理盐水处理。将高氧组早产鼠连同母鼠置于自制氧箱中,氧浓度维持在75%~80%,定期与空气组交换母鼠以防因氧中毒致母鼠喂养能力降低;空气组置于空气中,氧浓度为21%,余处理方法分别同对应的高氧组亚组[7-8]。实验过程中无新生早产大鼠死亡。
1.3 标本的收集与处理各组分别于实验第3、5、9天时用10%水合氯醛(0.6 mL/100 g)腹腔注射麻醉,开胸后迅速取下肺组织,置于1.5 mL无酶冻存管,液氮速冻,-80℃冰箱保存;另一部分早产鼠经气管将4%多聚甲醛注入肺组织中并将其取下置于4%多聚甲醛固定,乙醇脱水,石蜡包埋切片,苏木精-伊红(HE)染色,光镜下观察肺组织的结构形态学变化。每个样本随机取3张切片,于100倍光镜下,计算放射状肺泡计数(radical alveolar counts, RAC),即在呼吸性细支气管中心作一垂直线至最近胸膜或纤维隔上,计数肺泡数,每张切片行5次计数,取平均值。
1.4 RT-PCR法检测肺组织USP7、β-catenin mRNA的表达取肺组织50 mg,迅速放入液氮冷冻的研钵中,研磨呈细粉末状后按总RNA提取试剂盒说明书提取总RNA,NanoDrop 2000超微量分光光度计检测RNA纯度及浓度,取总RNA 2 μg逆转录为cDNA,以cDNA为模板进行PCR扩增。PCR反应体系(25 μL):cDNA 3 μL,上下游引物各1 μL,RNase-Free ddH2O 7.5 μL,2×Taq Master Mix 12.5 μL。USP7上游引物5'-TGGGTTTGTGGTCACCTTATC-3',下游引物5'-CGTCCCTATAACCTTGAGACTTG-3',片段长度为122 bp;β-catenin上游引物5'-CAAGCCACAGGACTACAAGAA-3',下游引物5'-CAATGTCCAGTCCGAGATCAG-3',片段长度为107 bp;内参GAPDH上游引物5'-GATGGTGAAGGTCGGAGTG-3',下游引物5'-TGTAGTGGAGGTCAATGAATGG-3',片段长度为122 bp。PCR反应结束后,取5 μL扩增产物加至含有EB替代物DuRed核酸染料的2%琼脂糖凝胶上电泳,全自动数码凝胶成像分析仪显示并拍照,测定条带光密度值,计算USP7、β-catenin与GAPDH光密度值比值,以此表示目的基因mRNA的相对表达水平。
1.5 Western blot法检测肺组织USP7、β-catenin、α-SMA蛋白的表达取肺组织50 mg置于预冷的1.5 mL EP管中,剪碎,加入500 μL RIPA裂解液及50 μL PMSF,超声3~4次,冰上裂解10 min,4℃ 12 000 r/min离心30 min,取上清液即总蛋白。按BCA蛋白浓度测定试剂盒说明书进行所得蛋白浓度测定,将浓度最低管设为标准,把样品调成统一浓度,将样品溶液置于沸水浴中15 min后置于冰上冷却,每孔加30 μg蛋白进行SDS-PAGE电泳,转膜,封闭,分别加入USP7一抗、β-catenin一抗、α-SMA一抗(均按1 : 5 000稀释),孵育过夜,漂洗,加入对应的二抗(均按1 : 5 000稀释),孵育,漂洗,曝光后用ChemiDo-cXRS图像采集系统采集图像,IMAGE J软件检测光密度比值,以GAPDH蛋白表达作为内参照,计算各目的蛋白与GAPDH蛋白光密度值比值,以此表示目的蛋白的相对表达水平。
1.6 统计学分析采用SPSS 24.0统计软件对数据进行统计学分析。计量资料以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验,P < 0.05为差异有统计学意义。
2 结果 2.1 肺组织病理学改变空气各组肺泡发育良好,结构基本正常,无明显渗出及出血情况,随日龄增加,肺泡体积逐渐变小而数量增多。高氧对照组3 d、5 d可见肺泡明显压缩、结构紊乱,有明显炎症细胞、红细胞渗出及间质水肿改变;高氧对照组9 d可见肺泡结构紊乱、肺泡间隔明显增厚。高氧干预组肺组织结构紊乱、炎症细胞浸润、红细胞渗出情况较高氧对照组有所减轻,但较空气各组仍有肺泡结构紊乱、肺泡间隔增厚情况。见图 1。

|
图 1 各组早产鼠肺组织在不同时间点病理学改变 (苏木精-伊红染色,×100)空气各组肺组织形态结构基本正常;高氧对照组3 d、5 d可见肺泡明显压缩、结构紊乱,有明显炎症细胞、红细胞渗出及间质水肿改变;高氧对照组9 d可见肺泡结构紊乱、肺泡间隔明显增厚。高氧干预组肺组织结构紊乱、炎症细胞浸润、红细胞渗出情况均较相应时间点的高氧对照组有所减轻。 |
各时间点高氧各组RAC均明显低于对应的空气各组(P < 0.05),且高氧干预组RAC较高氧对照组明显升高(P < 0.05),见表 1。
| 表 1 各组不同时间点RAC值比较 |
|
|
实验第3、5、9天,与空气对照组相比,高氧对照组USP7、β-catenin mRNA表达均显著升高(P < 0.01);与空气干预组相比,高氧干预组USP7、β-catenin mRNA表达均显著升高(P < 0.05);与高氧对照组相比,高氧干预组β-catenin mRNA表达显著减少(P < 0.05);高氧干预组USP7 mRNA表达与高氧对照组相比差异无统计学意义(P > 0.05);空气干预组USP7、β-catenin mRNA表达与空气对照组相比差异无统计学意义(P > 0.05)。见图 2,表 2~3。
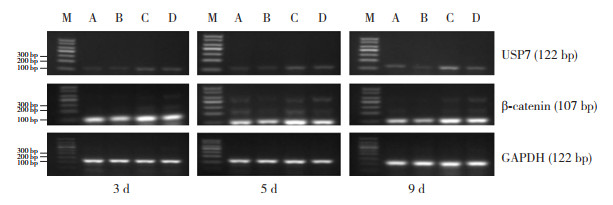
|
图 2 RT-PCR法检测各组早产鼠肺组织中不同时间点USP7、β-catenin mRNA电泳图 M:Marker;A:空气对照组;B:空气干预组;C:高氧对照组;D:高氧干预组。 |
| 表 2 各组早产鼠肺组织中不同时间点USP7 mRNA相对表达比较 |
|
|
| 表 3 各组早产鼠肺组织中不同时间点β-catenin mRNA相对表达比较 |
|
|
实验第3、5、9天,与空气对照组相比,高氧对照组USP7、β-catenin、α-SMA蛋白表达均显著升高(P < 0.01);与空气干预组相比,高氧干预组USP7、β-catenin、α-SMA蛋白表达均显著升高(P < 0.05);与高氧对照组相比,高氧干预组β-catenin、α-SMA蛋白表达均显著减少(P < 0.05);高氧干预组USP7蛋白表达与高氧对照组相比差异无统计学意义(P > 0.05);空气干预组USP7、β-catenin、α-SMA蛋白表达与空气对照组比较差异无统计学意义(P > 0.05)。见图 3,表 4~6。
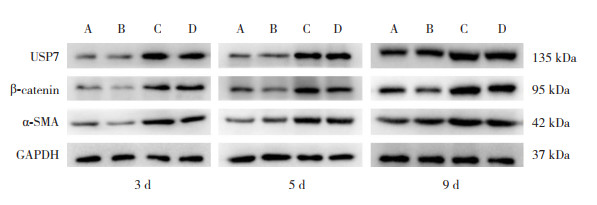
|
图 3 Western blot法检测各组早产鼠肺组织中不同时间点USP7、β-catenin、α-SMA蛋白电泳图 A:空气对照组;B:空气干预组;C:高氧对照组;D:高氧干预组 |
| 表 4 各组早产鼠肺组织中不同时间点USP7蛋白相对表达比较 |
|
|
| 表 5 各组早产鼠肺组织中不同时间点β-catenin蛋白相对表达比较 |
|
|
| 表 6 各组早产鼠肺组织中不同时间点α-SMA蛋白的相对表达 |
|
|
BPD是早产儿呼吸系统常见疾病,其本质是在遗传易患性的基础上,在吸入高浓度氧、气压伤或容量伤、宫内感染或炎症等各种不利因素共同作用下,对未发育成熟的肺造成损伤,并出现损伤后肺组织异常修复及功能异常[9-10]。近年来的研究显示Wnt/β-catenin信号通路在肺发育、肺疾病的发生发展过程中起着极其重要的作用,β-catenin的异常激活可导致肺泡型细胞异位分化,导致气道、杯状细胞增生和肺泡空间增大[11]。β-catenin作为经典Wnt信号通路的关键因子,其在胞质内富集并向胞核内转移,是Wnt信号通路活化的标志,保持细胞胞浆中β-catenin稳定不被降解直接影响着Wnt信号通路的活化,而β-catenin被降解的关键是其泛素化过程。去泛素化酶可通过切割多聚泛素链或者从修饰的底物蛋白中去除泛素,逆转泛素化过程,逆向调节了蛋白降解途径,从而影响蛋白质的功能[12]。
根据催化结构域的不同,去泛素化酶主要分为7个亚家族,包括泛素-特异性蛋白酶家族(ubiquitin-specific proteases, USPs)、泛素羧基末端水解酶家族、卵巢肿瘤蛋白酶家族、MJD结构域蛋白酶家族、MINDY蛋白酶家族、ZUFSP蛋白酶家族和JAMM蛋白酶家族[13];其中,USPs是迄今已知的最大的去泛素化酶家族。Xu等[14]研究证实了小鼠淋巴细胞中去泛素化酶USP9X过表达可致β-catenin表达增加。另有学者发现USP4可通过去泛素化作用积极调节β-catenin稳定性并增强转录活性,对Wnt/β-catenin信号通路起到正向调控的作用;而敲除USP4则减弱了结肠癌细胞的侵袭和迁移活性[15]。也就是说,去泛素化酶可以通过调控Wnt/β-catenin信号通路中β-catenin的表达变化,在疾病的发生、发展过程中起作用。
USP7在结直肠癌[16]、肺癌[17]、急性肺损伤[18]、慢性淋巴细胞白血病[19]等多种疾病中均有大量的研究。USP7表达于血管上皮细胞、细支气管上皮细胞及肺泡上皮细胞中,且其在博莱霉素诱导的小鼠纤维化肺组织中表达增强[6]。P5091属于USP7噻吩类小分子抑制剂,An等[16]研究发现P5091可通过增强β-catenin的泛素化和亚序列降解来减弱Wnt信号途径传导的能力。
本实验取材的时间选择,跨越了大鼠肺发育中的囊泡期与肺泡期,与人类胎龄28周时处于囊泡期的肺组织结构相符。空气各组肺组织形态结构基本正常,高氧对照组3 d、5 d可见肺泡明显压缩、结构紊乱,有明显炎症细胞、红细胞渗出及间质水肿改变;高氧对照组9 d可见肺泡结构紊乱、肺泡间隔明显增厚。高氧干预组肺组织结构紊乱、炎症细胞浸润、红细胞渗出情况均较相应时间点的高氧对照组有所减轻;空气各组肺泡数目较高氧各组明显增加,RAC显著增加,且高氧干预组RAC较高氧对照组明显升高,提示USP7特异性抑制剂P5091可能对高氧肺损伤有一定的保护作用。
本实验中,高氧各组USP7的mRNA及蛋白的表达较对应的空气组均明显增加,提示USP7可能参与了高氧肺损伤。USP7可能作为关键的分子靶点参与了Wnt信号通路[20]、NF-κB信号通路[21]等多条信号转导通路途径。朱晓丹[22]研究中发现,去泛素化酶A20能通过抑制NF-κB活化发挥抗炎作用。本实验高氧肺损伤早期,肺泡腔中可见大量的以中性粒细胞为主的炎症细胞聚集,推测早期肺组织的USP7升高很可能是通过对抗瀑式炎症反应而起保护作用。随着高氧暴露时间的延长,肺损伤进一步加重,USP7的表达也进一步增加,表明其去泛素化作用增强,同时伴随着下游底物分子β-catenin的表达增加;在应用USP7特异性抑制剂P5091后,虽然高氧对照组USP7蛋白及mRNA表达与高氧干预组比较差异无统计学意义(考虑与P5091是通过抑制USP7活性而非影响其表达来发挥作用有关),但β-catenin的表达明显减少,进一步说明P5091通过变构作用使USP7作用于泛素链的去泛素化作用减弱,使β-catenin的降解增强,导致胞浆中β-catenin的浓度降低,从而减少了β-catenin的核内转移,使Wnt/β-catenin信号通路的活化受抑制。
α-SMA是Wnt/β-catenin信号通路下游的1个靶基因,表达于肌成纤维细胞中,是肺中上皮-间质转化的标志物[23],代表了组织纤维化的程度。有研究表明,肌成纤维细胞表达强弱与肺纤维化程度呈正相关[24]。本研究发现,高氧各组中α-SMA蛋白及mRNA表达均明显高于同时间点空气各组,提示高氧暴露肺损伤存在肺上皮-间质的转化增加,从而导致肺组织纤维化。在应用USP7特异性抑制剂P5091的高氧组中α-SMA蛋白及其mRNA表达均比高氧对照组明显降低,提示P5091可能通过拮抗USP7的去泛素化作用,减少肺上皮-间质转化来参与高氧肺损伤起保护作用。
综上所述,本实验研究结果提示了高氧暴露可激活Wnt/β-catenin信号通路;USP7可能通过Wnt/β-catenin信号通路来参与高氧肺损伤;USP7特异性抑制剂P5091可能通过减弱USP7的去泛素化作用,加强β-catenin的泛素化而加速其降解,降低Wnt/β-catenin通路的活化,减少肺上皮-间质转化,从而对高氧肺损伤产生一定的保护作用。而有关USP7与Wnt/β-catenin信号通路在高氧肺损伤中的具体作用机制仍有待进一步研究。
| [1] |
Kim JH. Di(2-ethylhexyl) phthalate promotes lung cancer cell line A549 progression via Wnt/β-catenin signaling[J]. J Toxicol Sci, 2019, 44(4): 237-244. DOI:10.2131/jts.44.237 (  0) 0) |
| [2] |
严隆丽, 全裕凤, 张华, 等. SOX9及WNT信号通路分子在高氧暴露致早产大鼠肺损伤中的表达及意义[J]. 安徽医科大学学报, 2018, 53(4): 552-557. (  0) 0) |
| [3] |
Hosseinzadeh A, Javad-Moosavi SA, Reiter RJ, et al. Idiopathic pulmonary fibrosis (IPF) signaling pathways and protective roles of melatonin[J]. Life Sci, 2018, 201: 17-29. DOI:10.1016/j.lfs.2018.03.032 (  0) 0) |
| [4] |
黄宇戈, 封志纯, 余彦亮, 等. 泛素-蛋白酶体途径在高体积分数氧肺损伤大鼠早期的激活[J]. 实用儿科临床杂志, 2009, 24(6): 422-424. (  0) 0) |
| [5] |
Novellasdemunt L, Foglizzo V, Cuadrado L, et al. USP7 is a tumor-specific WNT activator for APC-mutated colorectal cancer by mediating β-catenin deubiquitination[J]. Cell Rep, 2017, 21(3): 612-627. DOI:10.1016/j.celrep.2017.09.072 (  0) 0) |
| [6] |
彭清, 高习文. 泛素特异性蛋白酶7在博莱霉素诱导的小鼠炎症及肺纤维化过程中的表达及作用[J]. 蚌埠医学院学报, 2018, 43(7): 845-849. (  0) 0) |
| [7] |
王少华, 党红星, 范倩倩, 等. 早产新生大鼠高氧肺损伤Shh信号转导途径Smo和Gli1蛋白表达和意义[J]. 中国新生儿科杂志, 2014, 29(1): 49-53. (  0) 0) |
| [8] |
严隆丽, 全裕凤, 张华, 等. 早产大鼠在高氧暴露下肺组织高迁移率族盒蛋白4和β-连环素的表达及意义[J]. 中华新生儿科杂志, 2018, 33(2): 136-141. (  0) 0) |
| [9] |
陈超, 袁琳. 早产儿支气管肺发育不良的病因及危险因素[J]. 中国实用儿科杂志, 2014, 29(1): 5-7. (  0) 0) |
| [10] |
李燕, 韦秋芬, 潘新年, 等. 早产儿支气管肺发育不良严重程度的影响因素[J]. 中国当代儿科杂志, 2014, 16(10): 1014-1018. (  0) 0) |
| [11] |
Mucenski ML, Nation JM, Thitoff AR, et al. Beta-catenin regulates differentiation of respiratory epithelial cells in vivo[J]. Am J Physiol Lung Cell Mol Physiol, 2005, 289(6): L971-L979. DOI:10.1152/ajplung.00172.2005 (  0) 0) |
| [12] |
梁超超, 程梦华, 刘石娟. 去泛素化酶活性的调控[J]. 中国生物化学与分子生物学报, 2018, 34(1): 38-44. (  0) 0) |
| [13] |
Geurink PP, van der Heden van Noor GJ, Mulder MPC, et al. Profiling DUBs and Ubl-specific proteases with activity-based probes[J]. Methods Enzymol, 2019, 618: 357-387. DOI:10.1016/bs.mie.2018.12.037 (  0) 0) |
| [14] |
Xu J, Taya S, Kaibuchi K, et al. Spatially and temporally specific expression in mouse hippocampus of Usp9x, a ubiquitin-specific protease involved in synaptic development[J]. J Neurosci Res, 2005, 80(1): 47-55. (  0) 0) |
| [15] |
Yun SI, Kim HH, Yoon JH, et al. Ubiquitin specific protease 4 positively regulates the WNT/β-catenin signaling in colorectal cancer[J]. Mol Oncol, 2015, 9(9): 1834-1851. DOI:10.1016/j.molonc.2015.06.006 (  0) 0) |
| [16] |
An T, Gong Y, Li X, et al. USP7 inhibitor P5091 inhibits Wnt signaling and colorectal tumor growth[J]. Biochem Pharmacol, 2017, 131: 29-39. DOI:10.1016/j.bcp.2017.02.011 (  0) 0) |
| [17] |
Li J, Han Y, Zhang H, et al. The m6A demethylase FTO promotes the growth of lung cancer cells by regulating the m6A level of USP7 mRNA[J]. Biochem Biophys Res Commun, 2019, 512(3): 479-485. DOI:10.1016/j.bbrc.2019.03.093 (  0) 0) |
| [18] |
Wang J, Li HY, Su ZB. Stabilization of the histone acetyltransferase Tip60 by deubiquitinating enzyme USP7 stimulates the release of pro-inflammatory mediators in acute lung injury[J]. J Mol Med (Berl), 2020, 98(6): 907-921. DOI:10.1007/s00109-020-01910-1 (  0) 0) |
| [19] |
Carrà G, Panuzzo C, Torti D, et al. Therapeutic inhibition of USP7-PTEN network in chronic lymphocytic leukemia:a strategy to overcome TP53 mutated/deleted clones[J]. Oncotarget, 2017, 8(22): 35508-35522. DOI:10.18632/oncotarget.16348 (  0) 0) |
| [20] |
Li X, Kong L, Yang Q, et al. Parthenolide inhibits ubiquitin-specific peptidase 7(USP7), Wnt signaling, and colorectal cancer cell growth[J]. J Biol Chem, 2020, 295(11): 3576-3589. DOI:10.1074/jbc.RA119.011396 (  0) 0) |
| [21] |
Mitxitorena I, Somma D, Mitchell JP, et al. The deubiquitinase USP7 uses a distinct ubiquitin-like domain to deubiquitinate NF-κB subunits[J]. J Biol Chem, 2020, 295(33): 11754-11763. DOI:10.1074/jbc.RA120.014113 (  0) 0) |
| [22] |
朱晓丹.锌指蛋白A20对急性肺损伤炎症反应的调控及机制研究[D].上海: 复旦大学, 2012.
(  0) 0) |
| [23] |
Tan ZX, Chen YH, Xu S, et al. Calcitriol inhibits bleomycin-induced early pulmonary inflammatory response and epithelial-mesenchymal transition in mice[J]. Toxicol Lett, 2016, 240(1): 161-171. (  0) 0) |
| [24] |
Darby IA, Zakuan N, Billet F, et al. The myofibroblast, a key cell in normal and pathological tissue repair[J]. Cell Mol Life Sci, 2016, 73(6): 1145-1157. DOI:10.1007/s00018-015-2110-0 (  0) 0) |
 2020, Vol. 22
2020, Vol. 22


