流感是由流感病毒引起的一种呼吸道感染性疾病。我国2017年流感患者就诊比例高于过去3年同期水平[1]。儿童感染流感病毒经常引起严重的肺部并发症,如:重症肺炎、呼吸衰竭等,并且成为流感患儿死亡的主要原因,其病死率高达10%~20%[2]。塑型支气管炎(plastic bronchitis, PB)是流感导致的严重可致命的肺部并发症,最常见于儿童[2],其特征是起病急、病情危重,在气管、支气管内出现内生性厚稠坚韧的支气管管型堵塞气道,从而引起急性呼吸衰竭甚至死亡,通常与哮喘、肺炎等疾病相关[3],但其临床表现缺乏特异性,容易误诊漏诊。因此, 掌握儿童流感合并PB的临床特征对于预防流感导致的死亡尤为重要。目前国内外已有关于甲型流感病毒(influenza A viruses, IFV-A)和乙型流感病毒(influenza B viruses, IFV-B)合并PB的病例报道[4-5],但是关于流感合并PB的总体临床特征分析十分有限。现对深圳市儿童医院2018年10月至2019年10月收治的12例确诊为流感病毒感染合并PB患儿的临床特征进行回顾性分析,旨在提高临床医师对该病的早期识别,以期降低儿童流感病死率。
1 资料与方法 1.1 研究对象选取2018年10月至2019年10月深圳市儿童医院收治的70例下呼吸道流感病毒感染患儿为研究对象,按照是否合并PB分为流感合并PB组(n=12)和流感未合并PB组(n=58)。所有患儿临床表现均符合《流行性感冒诊疗方案(2018年版)》中的流感诊断标准[1];采用反转录-聚合酶链反应(RT-PCR)检测支气管肺泡灌洗液中的病毒核酸,确诊为下呼吸道流感病毒感染;经纤维支气管镜确诊合并PB。排除下呼吸道其他病毒感染。
1.2 病原学检测方法所有患儿因病情需要均在入院1周内行纤维支气管镜灌洗术,抽取气管、支气管、肺泡灌洗液。采用湖南圣湘公司试剂盒检测IFV-A核酸;采用中山大学达安基因股份有限公司试剂盒检测IFV-B核酸;采用海尔施公司的呼吸道多重PCR检测试剂盒检测博卡病毒、冠状病毒、呼吸道合胞病毒、腺病毒、鼻病毒、副流感病毒、偏肺病毒、肺炎衣原体、肺炎支原体核酸DNA;采用湖南圣湘生物科技有限公司试剂盒检测灌洗液中EB病毒DNA,同时将灌洗液送至我院微生物实验室进行细菌培养鉴定。
1.3 观察指标采用回顾性研究方法,收集病例资料:(1)一般资料:年龄、性别;(2)临床特征:症状、体征、既往疾病、基础疾病、临床症状(发热、咳嗽、气促)与体征(肺部啰音)、实验室检查(血常规、C反应蛋白、灌洗液培养结果)、肺部高分辨CT、治疗及转归等。
1.4 统计学分析采用SPSS 25.0统计软件对数据进行统计学分析。计数资料以百分率(%)表示,两组间比较采用卡方检验;当1≤理论频数 < 5时,采用连续校正卡方检验;当理论频数 < 1时,采用Fisher确切概率法。P < 0.05为差异有统计学意义。
2 结果 2.1 一般特征流感合并PB组,男10例(83%),女2例(17%);年龄7个月至7岁,平均年龄3.3±2.4岁;流感未合并PB组,男39例(67%),女19例(33%),年龄1个月至10岁,平均年龄4.3±1.6岁。两组性别、年龄比较差异无统计学意义(分别χ2=1.226,P=0.325;t=-1.270,P=0.208)。12例流感合并PB患儿中,< 1岁1例(8%),1岁~ 3例(25%),3岁~ 6例(50%),6~7岁2例(17%),1~5岁患儿共9例(75%);发病分布于两个高峰期,发病于1月和2月共6例(50%),其余6例(50%)发病于7月和9月。
2.2 临床表现12例流感合并PB患儿均出现发热、咳嗽、气促表现;其中8例(67%)出现喘息症状;8例(67%)肺部可闻及湿啰音,8例(67%)可闻及哮鸣音;5例(42%)具有过敏性疾病史,包括哮喘4例(33%),鸡蛋牛奶3级过敏1例(8%);1例(8%)存在肾病综合征基础疾病,口服激素治疗中。流感合并PB患儿的气促及过敏性疾病的发生率明显高于流感未合并PB患儿(P < 0.05),见表 1。
| 表 1 流感未合并PB组与流感合并PB组主要临床表现比较 |
|
|
12例流感合并PB患儿白细胞(参考范围5~12×109/L)升高5例(42%);CRP(参考范围0~10×109 mg/L)升高6例(50%);天门冬氨酸氨基转移酶(参考值0~40 IU/L)升高1例(8%),丙氨酸氨基转移酶(参考值0~40 IU/L)升高1例(8%),肌酐、尿素氮均正常;肌酸激酶(参考值24~229 IU/L)升高5例(42%),乳酸脱氢酶(参考值155~345 IU/L)升高3例(25%),肌酸激酶同工酶、肌钙蛋白均正常。
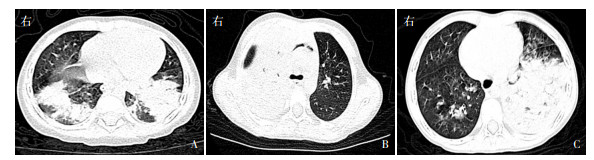
2.4 影像学检查12例患儿中,8例行肺部高分辨CT检查,以肺部高密度影、单侧多叶及双侧多叶肺实变伴不张为主要表现,其中肺实变伴不张6例(50%),模糊高密度影3例(25%),合并胸腔积液4例(33%),纵膈气肿2例(17%)(图 1);1例肺部CT报告提示不除外异物。其余4例院前行胸片检查,2例(17%)影像学表现较重并伴有胸腔积液。
|
图 1 流感合并PB患儿肺部高分辨CT表现 A:肺部多发大片状高密度影伴支气管充气征;B:肺不张伴纵隔积气及大量胸腔积液;C:以左侧为主的肺部实变。 |
12例患儿支气管肺泡灌洗液中均检出流感病毒核酸阳性,其中IFV-A阳性7例(58%),IFV-B阳性5例(42%)。支气管肺泡灌洗液细菌培养结果显示,检出肺炎链球菌3例(25%),卡他莫拉菌1例(8%);IFV-A合并肺炎链球菌1例(8%),IFV-B合并肺炎链球菌2例(17%)、合并卡他莫拉菌1例(8%)。
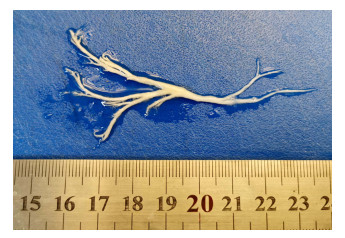
2.6 流感合并PB患儿纤维支气管镜下特点12例患儿在纤维支气管镜下可见气管黏膜充血水肿,肺叶开口可见白色分泌物堵塞,吸出的管型均为白色树枝状物,见图 2。
|
图 2 从流感合并PB患儿支气管灌洗出的树状管型 |
12例流感合并PB患儿中,9例(75%)至PICU治疗,其中5例(42%)因呼吸衰竭行呼吸机辅助通气。12例(100%)均予以广谱抗生素治疗,其中5例(42%)经奥司他韦或帕拉米韦抗病毒治疗5 d,6例(50%)予甲基泼尼松龙每次1~2 mg/kg静脉滴注,2~3次/d。12例(100%)患儿均在入院1周内行纤维支气管镜肺泡灌洗术,通过吸出管型、抗炎抗病毒及对症支持治疗后,所有患儿均好转出院,无死亡病例。流感合并PB患儿入住PICU率高于流感未合并PB患儿(P < 0.05),见表 2。
| 表 2 流感未合并PB组与流感合并PB组治疗情况比较 |
|
|
流感引起的呼吸道感染进展迅速,可导致严重呼吸窘迫综合征和难治性低氧血症,与细菌性肺炎相比,其住院时间更长,病死率更高[6]。最近的国内外研究指出儿童流感的高发年龄仍集中在5岁以下[7-8],本研究对象的年龄特征与上述报道相符。流感合并PB的高发季节与流感流行时间一致[9],分布在1、2月和7、9月。
大多数季节性流感患者症状较轻,具有自限性[6]。但随着流感病毒侵袭至下呼吸道出现并发症,其病死率明显上升,其中PB是重症流感危及生命的并发症。流感合并PB患儿起病急,表现发热、咳嗽、气促、喘息、呼吸困难,经支气管内窥镜证实下呼吸道存在PB[3, 10-11]。本研究中所有患儿出现发热、咳嗽、气促,与上述文献报道的流感合并PB患儿临床表现一致,与下呼吸道流感未合并PB患儿相比,其气促发生率明显升高。因此在流感高峰期,患儿明显出现气促、呼吸困难表现,临床医师应考虑下呼吸道堵塞可能。
值得注意的是,12例存在PB的患儿中有8例(67%)出现喘息,追踪病史发现4例(33%)确诊哮喘,1例(8%)存在严重的牛奶蛋白过敏,即超过1/3的患儿合并过敏性疾病。与流感未合并PB组进行比较发现,存在过敏性疾病的患儿PB发生率明显升高。通过文献分析流感、PB、哮喘或过敏相关性可以发现[12-15],哮喘是流感患者住院的独立危险因素,住院的流感患者中有25%~30%合并哮喘,本研究数据与文献报道一致。同时哮喘患者是感染流感病毒的高危人群,流感病毒能延长存在特应质患儿的气道高反应时间并且诱发这类患儿出现严重哮喘发作,而合并过敏或哮喘的流感患儿发生PB的风险明显升高[16]。分析特应质患者感染流感病毒发生PB的机制为:(1)流感病毒能诱发哮喘患者气道的上皮细胞和免疫细胞反应失调,导致固有免疫反应异常增加,在感染的早期就可释放大量参与炎症因子风暴的细胞因子,如IL-33、TNF-α、CXCL-10、IL12p40等,并伴随黏液过度分泌和气道高反应性[17]。(2)哮喘患者本身气道黏膜纤毛清除功能障碍[18]。故炎症反应增加、黏液异常分泌、纤毛清除障碍共同参与了PB形成,使气道阻力显著增加。所以当流感患儿合并哮喘或过敏病史出现呼吸窘迫症状时,除了考虑哮喘急性发作,还需高度警惕PB存在。
本研究中有1例患儿存在肾病综合征基础疾病,因未行管型的组织病理学检查,其PB的发生机制尚不清楚。但既往研究提示[19],肾病综合征中低蛋白血症和利尿剂治疗引起的血容量减少、淋巴回流异常可能是促进PB形成的原因。长期使用免疫抑制剂的肾病综合征患儿,其感染流感病毒的风险增加,因此当此类患儿遭受流感病毒感染时,要注意呼吸道PB形成的可能。
本研究存在PB的所有患者均在短时间内出现咳嗽、气促、呼吸困难等严重的气道阻塞和通气障碍的表现,并在1周内行支气管肺泡灌洗术解除气道梗阻,故白细胞多数在正常范围,有5例轻度升高,提示与病毒感染相关。因治疗及时,其脏器功能基本正常。12例患儿的灌洗液中,检测出IFV-A 7例(58%),IFV-B 5例(42%)。最近的研究表明[2, 20],不论是否存在影响淋巴回流的心肺疾病,IFV-A中的H1N1型较之普通流感病毒,能更严重的破坏气道黏膜的纤毛清除能力。然而在本研究中,IFV-B同样诱发了塑型支气管炎这类严重的并发症,与既往研究[21]认为IFV-B肺炎的重症病例少的观点不符合。考虑与不同地区流感亚型不同,其引起的肺部并发症和疾病严重程度不同相关[4]。
流感合并PB的肺部影像主要表现为肺不张、炎症渗出、胸腔积液、肺及纵膈气肿、气胸[3]。本病例中除了以上气道梗阻的影像学表现外,还有一半患儿出现肺实变表现,与以往研究中病毒性肺炎的影像学数据一致[22]。影像学表现虽是非特异性的,但能有助于早期诊断和发现肺部并发症,及时做对症处理,改善预后。
纤维支气管镜气道及肺泡灌洗仍是治疗PB最有效的方法。黏液栓容易堵塞远端支气管及分布于小气道,因此,用灌洗方法排出管型和用咳嗽法将较深的管型转移至大气道对缓解气道梗阻十分重要。对于流感病毒引起的肺部感染主要针对病因和合并感染进行治疗,包括(1)呼吸衰竭进行氧疗和建立人工气道行机械通气;(2)奥司他韦抗病毒,抗生素抗细菌,小剂量糖皮质激素减轻气道炎症;(3)物理疗法:拍背、吸痰等;(4)其他早期支持治疗在预防器官损伤中也发挥重要作用[3]。虽然合并PB的患儿入住PICU和使用呼吸机比例较未合并PB的患儿明显升高,但本研究中所有患儿经过早期的气管镜发现PB,并通过支气管肺泡灌洗术取出内生管型,均好转出院。流感诊疗方案已强调抗病毒治疗的重要性[1],并指出发病48 h内进行抗流感治疗能减少并发症。本研究数据显示,下呼吸道流感病毒感染患儿仅半数使用抗病毒药物,考虑与流感诊断延迟有关,导致错过治疗流感的最佳时间,不排除PB并发症的出现与抗病毒治疗延误相关,更加说明早期使用抗流感药物至关重要。本研究对象的抗生素使用比例高达100%,而分析其实验室检查结果,包括灌洗液培养、血常规白细胞、CRP、降钙素原提示细菌感染的PB患儿有11例(92%),未合并PB组有44例(76%)。虽不是所有患儿具备细菌感染依据,但既往研究总结发现[23],流感合并细菌感染比例为28%~75%,由于细菌培养的不确定性,这种共同感染的数量可能更高,而细菌感染常导致流感危重症发生,并能增加死亡风险。因此,对于重症流感是否预防使用抗生素及抗生素治疗时机仍有待大规模循证依据支持。
鉴于PB引起缺氧损伤的可能,早期诊断和治疗至关重要。本研究认为流感季节中出现严重气促、呼吸困难的患儿应高度警惕PB出现。特别提出,存在哮喘、过敏性疾病史患儿出现气促等呼吸窘迫表现,除了考虑哮喘急性发作需进行抗哮喘处理,还要积极完善胸部影像学检查,若存在肺不张等气道梗阻表现,要高度怀疑PB存在的可能。合并肾病综合征基础疾病的流感患儿,需密切监测PB的发生。并要将哮喘等过敏性疾病和肾病综合征作为流感发生PB的高危因素考虑。纤维支气管镜灌洗为流感合并PB患儿的首选治疗方案,应尽快行支气管镜检查,以明确诊断,解除气道阻塞。
由于本研究样本量较小,为单中心研究,仅仅作为下一步深入研究的初探,且未对管型做病理分析,故关于管型的具体发生机制有待更大样本量进行深入研究。
| [1] |
国家卫生和计划生育委员会, 国家中医药管理局. 流行性感冒诊疗方案(2018年版)[J]. 中国感染控制杂志, 2018, 17(2): 181-184. DOI:10.3969/j.issn.1671-9638.2018.02.020 (  0) 0) |
| [2] |
Hasegawa M, Inamo Y, Fuchigami T, et al. Bronchial casts and pandemic (H1N1) 2009 virus infection[J]. Emerg Infect Dis, 2010, 16(2): 344-346. DOI:10.3201/eid1602.091607 (  0) 0) |
| [3] |
Zhang J, Kang X. Plastic bronchitis associated with influenza virus infection in children:a report on 14 cases[J]. Int J Pediatr Otorhinolaryngol, 2015, 79(4): 481-486. DOI:10.1016/j.ijporl.2015.01.002 (  0) 0) |
| [4] |
Kirito Y, Matsubayashi T, Ohsugi K. Plastic bronchitis:three cases caused by influenza B virus Yamagata lineage[J]. Pediatr Int, 2019, 61(4): 421-423. DOI:10.1111/ped.13799 (  0) 0) |
| [5] |
Hermann B, Lehners N, Brodhun M, et al. Influenza virus infections in patients with malignancies-characteristics and outcome of the season 2014/15. A survey conducted by the Infectious Diseases Working Party (AGIHO) of the German Society of Haematology and Medical Oncology (DGHO)[J]. Eur J Clin Microbiol Infect Dis, 2017, 36(3): 565-573. DOI:10.1007/s10096-016-2833-3 (  0) 0) |
| [6] |
Kim S, Cho HJ, Han DK, et al. Recurrent plastic bronchitis in a child with 2009 influenza A (H1N1) and influenza B virus infection[J]. J Korean Med Sci, 2012, 27(9): 1114-1119. DOI:10.3346/jkms.2012.27.9.1114 (  0) 0) |
| [7] |
于佳, 张涛, 王胤, 等. 苏州市2011-2017年5岁以下儿童流感门诊病例临床特征及疾病负担[J]. 中华流行病学杂志, 2018, 39(6): 847-851. DOI:10.3760/cma.j.issn.0254-6450.2018.06.029 (  0) 0) |
| [8] |
Ng Y, Chua LAV, Ma S, et al. Estimates of influenza-associated hospitalisations in tropical Singapore, 2010-2017:higher burden estimated in more recent years[J]. Influenza Other Respir Viruses, 2019, 13(6): 574-581. DOI:10.1111/irv.12676 (  0) 0) |
| [9] |
Caini S, Kusznierz G, Garate VV, et al. The epidemiological signature of influenza B virus and its B/Victoria and B/Yamagata lineages in the 21st century[J]. PLoS One, 2019, 14(9): e0222381. DOI:10.1371/journal.pone.0222381 (  0) 0) |
| [10] |
郑跃杰, 邓继岿, 卢志威, 等. 甲型H1N1流感引致塑型支气管炎八例分析[J]. 中华儿科杂志, 2012, 50(7): 521-524. DOI:10.3760/cma.j.issn.0578-1310.2012.07.009 (  0) 0) |
| [11] |
徐文淼, 纪健, 方伯梁, 等. 小儿重症甲型H1N1流感合并塑型性支气管炎四例分析并文献复习[J]. 中国小儿急救医学, 2017, 24(2): 158-160. DOI:10.3760/cma.j.issn.1673-4912.2017.02.016 (  0) 0) |
| [12] |
Jha A, Dunning J, Tunstall T, et al. Patterns of systemic and local inflammation in patients with asthma hospitalised with influenza[J]. Eur Respir J, 2019, 54(4). pii: 1900949.
(  0) 0) |
| [13] |
Vasileiou E, Sheikh A, Butler C, et al. Effectiveness of influenza vaccines in asthma:a systematic review and meta-analysis[J]. Clin Infect Dis, 2017, 65(8): 1388-1395. DOI:10.1093/cid/cix524 (  0) 0) |
| [14] |
Xepapadaki P, Papadopoulos NG, Bossios A, et al. Duration of postviral airway hyperresponsiveness in children with asthma:effect of atopy[J]. J Allergy Clin Immunol, 2005, 116(2): 299-304. DOI:10.1016/j.jaci.2005.04.007 (  0) 0) |
| [15] |
Hasegawa S, Hirano R, Hashimoto K, et al. Characteristics of atopic children with pandemic H1N1 influenza viral infection:pandemic H1N1 influenza reveals 'occult' asthma of childhood[J]. Pediatr Allergy Immunol, 2011, 22(1 Pt 2): e119-e123. (  0) 0) |
| [16] |
Brogan TV, Finn LS, Pyskaty DJ Jr, et al. Plastic bronchitis in children:a case series and review of the medical literature[J]. Pediatr Pulmonol, 2002, 34(6): 482-487. DOI:10.1002/ppul.10179 (  0) 0) |
| [17] |
Wark PAB. Why are people with asthma more susceptible to influenza?[J]. Eur Respir J, 2019, 54(4). pii: 1901748.
(  0) 0) |
| [18] |
Whitsett JA. Airway epithelial differentiation and mucociliary clearance[J]. Ann Am Thorac Soc, 2018, 15(Suppl 3): S143-S148. (  0) 0) |
| [19] |
Fujinaga S, Hara T. Acute kidney injury following plastic bronchitis associated with influenza B virus in a child with nephrotic syndrome[J]. Indian Pediatr, 2015, 52(6): 523-525. DOI:10.1007/s13312-015-0669-z (  0) 0) |
| [20] |
Terano C, Miura M, Fukuzawa R, et al. Three children with plastic bronchitis associated with 2009 H1N1 influenza virus infection[J]. Pediatr Infect Dis J, 2011, 30(1): 80-82. DOI:10.1097/INF.0b013e3181f10fff (  0) 0) |
| [21] |
华军, 杜晓晨, 谢敏慧, 等. 流感病毒B监测与儿童单纯B型流感病毒肺炎临床特征分析[J]. 中国当代儿科杂志, 2012, 14(11): 830-833. (  0) 0) |
| [22] |
Schoen K, Horvat N, Guerreiro NFC, et al. Spectrum of clinical and radiographic findings in patients with diagnosis of H1N1 and correlation with clinical severity[J]. BMC Infect Dis, 2019, 19(1): 964. DOI:10.1186/s12879-019-4592-0 (  0) 0) |
| [23] |
Metzger DW, Sun K. Immune dysfunction and bacterial coinfections following influenza[J]. J Immunol, 2013, 191(5): 2047-2052. DOI:10.4049/jimmunol.1301152 (  0) 0) |
 2020, Vol. 22
2020, Vol. 22


