坏死性小肠结肠炎(necrotizing enterocolitis, NEC)是新生儿期常见的消化系统危重症,活产儿NEC发病率为1%~3%[1]。NEC的发病机制尚未明了,可能与遗传易感性、肠道发育不成熟、喂养方式、菌群失调、循环障碍和输血等有关[2]。NEC的遗传易感性是近年来研究的热点,特别是免疫炎症因子的基因多态性引起了国内外学者广泛关注[3-5]。既往研究发现,白细胞介素(interleukin, IL)-23/IL-17轴对调节肠道免疫炎症具有重要作用[6]。IL-23受体(IL-23R)在活化的T细胞中高度表达,对激活Th17分泌IL-17有重要作用[7]。IL-17活化后,可招募各种趋化因子和炎症因子而介导免疫炎症反应[8]。另外,IL-17可以通过Toll样受体4(TLR4)而损害肠上皮细胞的紧密连接,增加上皮细胞凋亡并减少增殖,进而促进NEC的发生[9]。NEC新生儿血清IL-17表达水平明显升高,并且可以预测患儿60 d内病死率[10]。IL-23R和IL-17基因变异可影响其蛋白水平表达,进而影响其生物学功能。既往研究发现IL-23R和IL-17基因变异与多种肠道疾病有关,如克罗恩病和溃疡型结肠炎等[7],但是未见关于NEC的报道。为了排除种族对本研究结果的影响,本研究仅选取汉族患儿为研究对象。本研究旨在探讨IL-23R基因rs10889677位点、IL-17A基因rs2275913位点和IL-17F基因rs763780位点单核苷酸多态性(single nucleotide polymorphisms, SNP)与汉族早产儿NEC易感性的关系。
1 资料与方法 1.1 研究对象本研究为前瞻性研究,选取2017年1月至2019年1月于本院新生儿重症监护病房收治的100例符合纳入及排除标准的NEC患儿为研究对象并纳入NEC组。纳入标准:(1)胎龄 < 37周;(2)汉族;(3)根据临床表现、影像学资料和病理资料等确诊为NEC[11]。排除标准:(1)合并感染性疾病或胃肠道炎症;(2)先天性肠道畸形;(3)先天性遗传代谢性疾病;(4)有缺氧窒息等病史。100例NEC患儿中,男59例,女41例,胎龄34.2±2.0周,出生时体重2 356±362 g;根据NEC分期标准[11],Ⅱ期63例,Ⅲ期37例。另选取100例早产儿作为对照。纳入标准:(1)胎龄 < 37周;(2)汉族;(3)无严重基础疾病。排除标准同NEC组。100例对照组早产儿中,男54例,女46例,胎龄34.7±2.4周,出生时体重2 396±511 g。两组性别、胎龄和出生时体重的比较差异均无统计学意义(P > 0.05),具有可比性。本研究已经过我院医学伦理委员会批准,所有新生儿监护人均签署知情同意书。
1.2 样本采集NEC组患儿在确诊后4 h内,对照组患儿在住院期间,分别采集外周静脉血1 mL置于EDTA管中,用1.5 mL EP管分装,置于-70℃冰箱中保存。
1.3 DNA分离与基因分型采用Qiagen试剂盒(北京赛因坦科技有限公司)提取总DNA。用Primer Premier 5.0软件设计引物,由上海桑根生物技术研究所进行合成。所选SNP位点包括IL-23R基因rs10889677位点、IL-17A基因rs2275913位点和IL-17F基因rs763780位点。rs10889677:F:5′-CAATCTTGTTTCCAGAGTAGTGAC-3′,R:5′-AAAAATACATGAGGCGTCCA-3′;rs2275913:F:5′-TATTGACCCATAGCATAGCAGC-3′,R:5′-TTTCTCCTTCTGTGGTCACTTAC-3′;rs763780:F:5′-AGGGAATTGGGGGTCAGA-3′,R:5′-GTTCCCATCCAGCAAGAGA-3′。PCR反应体系:上下游引物(10 μmol/L)各0.8 μL,ROX reference dye(50×)0.4 μL,cDNA模板2.0 μL,ddH2O 6 μL,总扩增体系为10 μL。PCR反应条件:95℃预变性3 min;94℃变性30 s,55℃退火30 s,72℃延伸30 s,35个循环;72℃最后延伸10 min。PCR产物用1.5%琼脂糖凝胶行电泳鉴定。鉴定后的产物用ABI3730XL全自动DNA测序仪进行测序(Sanger测序法)[12]。
1.4 统计学分析采用SPSS 20.0统计软件对数据进行统计学分析。正态分布计量资料采用均数±标准差(x±s)表示,两组计量资料间的比较采用两独立样本t检验;计数资料采用百分率(%)表示,两组计数资料间的比较采用卡方检验;采用非条件logistic回归分析基因多态性与NEC易感性和病情严重程度的关系。P < 0.05为差异有统计学意义。
2 结果 2.1 基因多态性与NEC易感性分析IL-23R基因rs10889677位点、IL-17A基因rs2275913位点和IL-17F基因rs763780位点的基因型分布符合Hardy-Weinberg平衡(分别χ2=1.072、1.416、2.081;分别P=0.342、0.501、0.153)。图 1所示为rs10889677位点、rs2275913位点和rs763780位点SNP。以是否患病为因变量,以基因型或等位基因为自变量进行logistic回归分析,评估基因型及等位基因频率对NEC发病的影响。rs10889677位点、rs2275913位点基因型和等位基因频率对NEC发病无影响(P > 0.05);rs763780位点基因型对NEC发病无影响(P > 0.05),但C等位基因携带者相对于T等位基因携带者的发病风险为1.652倍(95%CI:1.052~2.695,P < 0.05)(表 1)。NEC组rs763780位点TC+CC基因频率为35%、TT基因频率为65%;对照组TC+CC基因频率为22%,TT基因型为78%;TC+CC基因携带者相对于TT基因携带者的发病风险为1.856倍(95%CI:1.045~3.201,P=0.039)。
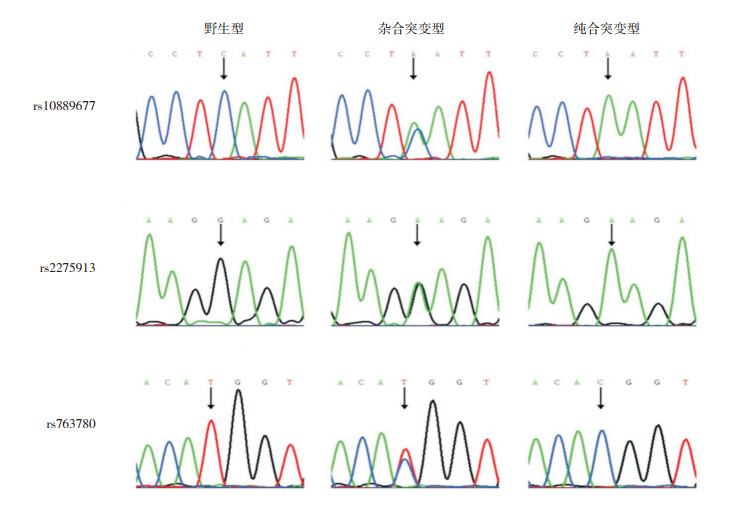
|
图 1 IL-23R基因rs10889677位点、IL-17A基因rs2275913位点和IL-17F基因rs763780位点单核苷酸多态性 Figure 1 1 箭头所示为突变位点。 |
| 表 1 NEC组和对照组IL-23R基因rs10889677、IL-17A基因rs2275913和IL-17F基因rs763780位点基因型和等位基因分布频率比较 |
|
|
以是否出现NEC Ⅲ期为因变量,以rs763780位点基因型或等位基因为自变量进行logistic回归分析,评估rs763780位点基因型及等位基因频率对NEC病情严重程度的影响。TC+CC基因携带者相对于TT基因携带者的NEC Ⅲ期的发生风险为2.965倍(95%CI:1.052~6.330,P < 0.05)。C等位基因携带者相对于T等位基因携带者的NEC Ⅲ期的发生风险为2.363倍(95%CI:1.034~4.093,P < 0.05)。见表 2。
| 表 2 不同NEC病情严重程度患儿IL-17F基因rs763780位点基因型和等位基因分布频率比较 |
|
|
NEC是新生儿期严重的胃肠道疾病,是早产儿死亡的重要原因之一[4]。NEC的发病与多种因素有关,但是均不能完全解释早产儿易感和疾病严重的原因。近年来,遗传易感性引起了国内外学者的重视[4]。由于基因背景不同,本研究仅以汉族新生儿为研究对象。鉴于IL-23/IL-17轴调节肠道免疫炎症的重要作用,本研究分析了IL-23R基因rs10889677位点、IL-17A基因rs2275913位点和IL-17F基因rs763780位点SNP与汉族早产儿NEC易感性的关系。研究结果显示,IL-23R基因rs10889677位点和IL-17A基因rs2275913位点SNP与NEC易感性无关,然而IL-17F基因rs763780位点TC+CC基因型和C等位基因与NEC易感和病情严重程度有关。
IL-23/IL-17轴对调节肠道免疫炎症具有重要作用[6]。IL-23属于新型细胞因子,与IL-23R结合后可以激活并维持Th17反应,以协调炎性因子级联反应,进而促进炎症性肠病的发生及发展[12]。IL-23R在活化的T细胞中高度表达,可以降解紧密连接蛋白,对肠道屏障产生影响,对激活Th17分泌IL-17有重要作用[7]。IL-17家族有6个成员,包括IL-17A、IL-17B、IL-17C、IL-17D、IL-17E和IL-17F。IL-17活化后,可招募各种趋化因子和炎症因子而介导免疫炎症反应[9]。另外,IL-17可以通过TLR4而损害肠上皮细胞的紧密连接,增加上皮细胞凋亡并减少增殖,进而促进NEC的发生[13]。
IL-17F是近年来发现的IL-17家族新成员,与IL-17A的同源性最强[14]。既往研究发现IL-17A基因rs2275913位点和IL-17F基因rs763780位点SNP与免疫炎症密切相关[15-17]。有研究发现IL-23R和IL-17基因变异与多种肠道疾病有关,如克罗恩病和溃疡型结肠炎等[7],然而本研究中仅IL-17F基因rs763780位点变异与NEC易感性有关。多项研究表明,IL-23R基因rs10889677位点与炎症性肠病有关[18]。然而本研究并未发现IL-23R基因rs10889677位点SNP与NEC易感性有关,这可能是因为IL-23/IL-17轴并不是调节Th-17分泌IL-17的唯一途径。有研究发现,TLR4下游通路会影响CD4 + Th17细胞极化,进而增加IL-17分泌,导致NEC的发生[12]。IL-23/IL-17轴可能在NEC发生和发展中失活,这需要未来进一步探讨。
本研究进一步分析了IL-17F基因rs763780位点SNP与疾病严重程度的关系。采用Bell分期,100例NEC患儿中Ⅱ期63例,Ⅲ期37例。基因多态性与NEC病情严重程度的关系既往已得到证实,例如既往研究发现VEGFA基因rs699947、rs833061位点SNP,HB-EGF基因rs4912711位点SNP与NEC严重程度有关[19-20]。本研究logistic回归分析结果显示,NEC Ⅲ期患儿TC+CC基因型分布频率明显高于NEC Ⅱ期患儿,说明携带至少一个C等位基因的NEC患儿病情更为严重。
本研究的局限性为:(1)本研究中对照组rs763780位点CC基因型分布频率为0,可能与样本量较小有关,需要未来扩大样本量并进行多中心研究。(2)本研究未分析基因多态性与NEC预后的关系,需要进一步随访。(3)虽然IL-23/IL-17轴与炎症性肠病密切相关,但是本研究并未发现NEC组和对照组rs10889677位点、rs2275913位点基因型和等位基因分布频率的差异,可能是因为IL-23/IL-17轴可能在NEC发生和发展中失活,而本研究未检测患儿血清中IL-23和IL-17的表达水平,需要未来进一步分析。(4)为了排除种族差异对基因多态性的影响,本研究仅选取了汉族早产儿作为研究对象,在下一步的研究中将选取不同民族早产儿作为研究对象,观察IL-23R和IL-17基因SNP与不同民族早产儿NEC的关系。
综上所述,本研究结果显示IL-23R基因rs10889677位点和IL-17A基因rs2275913位点SNP与汉族早产儿的NEC易感性无关,IL-17F基因rs763780位点TC+CC基因型和C等位基因与NEC易感和NEC病情严重程度有关。
| [1] |
Patel RM, Underwood MA. Probiotics and necrotizing enterocolitis[J]. Semin Pediatr Surg, 2018, 27(1): 39-46. (  0) 0) |
| [2] |
Eaton S, Rees CM, Hall NJ. Current research on the epidemiology, pathogenesis, and management of necrotizing enterocolitis[J]. Neonatology, 2017, 111(4): 423-430. DOI:10.1159/000458462 (  0) 0) |
| [3] |
Treszl A, Heninger E, Kalman A, et al. Lower prevalence of IL-4 receptor alpha-chain gene G variant in very-low-birth-weight infants with necrotizing enterocolitis[J]. J Pediatr Surg, 2003, 38(9): 1374-1378. DOI:10.1016/S0022-3468(03)00399-3 (  0) 0) |
| [4] |
Cuna A, Sampath V. Genetic alterations in necrotizing enterocolitis[J]. Semin Perinatol, 2017, 41(1): 61-69. DOI:10.1053/j.semperi.2016.09.019 (  0) 0) |
| [5] |
袁媛, 周伟, 袁伟明, 等. MD-2和GM2A基因多态性与新生儿坏死性小肠结肠炎的关系[J]. 中国新生儿科杂志, 2015, 30(1): 3-8. DOI:10.3969/j.issn.1673-6710.2015.01.002 (  0) 0) |
| [6] |
Babaie F, Hasankhani M, Mohammadi H, et al. The role of gut microbiota and IL-23/IL-17 pathway in ankylosing spondylitis immunopathogenesis:new insights and updates[J]. Immunol Lett, 2018, 196: 52-62. DOI:10.1016/j.imlet.2018.01.014 (  0) 0) |
| [7] |
Kim SW, Kim ES, Moon CM, et al. Genetic polymorphisms of IL-23R and IL-17A and novel insights into their associations with inflammatory bowel disease[J]. Gut, 2011, 60(11): 1527-1536. DOI:10.1136/gut.2011.238477 (  0) 0) |
| [8] |
Bell MJ, Ternberg JL, Feigin RD, et al. Neonatal necrotizing enterocolitis. Therapeutic decisions based upon clinical staging[J]. Ann Surg, 1978, 187(1): 1-7. DOI:10.1097/00000658-197801000-00001 (  0) 0) |
| [9] |
Ma F, Li S, Gao X, et al. Interleukin-6-mediated CCR9+ interleukin-17-producing regulatory T cells polarization increases the severity of necrotizing enterocolitis[J]. EBioMedicine, 2019, 44: 71-85. DOI:10.1016/j.ebiom.2019.05.042 (  0) 0) |
| [10] |
Lawrence SM, Ruoss JL, Wynn JL. IL-17 in neonatal health and disease[J]. Am J Reprod Immunol, 2018, 79(5): e12800. DOI:10.1111/aji.12800 (  0) 0) |
| [11] |
金汉珍.新生儿坏死性小肠结肠炎[M]//胡亚美, 江载芳.诸福棠实用儿科学(上册).第7版.北京: 人民卫生出版社, 2005: 475.
(  0) 0) |
| [12] |
McGovern D, Powrie F. The IL23 axis plays a key role in the pathogenesis of IBD[J]. Gut, 2007, 56(10): 1333-1336. DOI:10.1136/gut.2006.115402 (  0) 0) |
| [13] |
Walsh MC, Kliegman RM. Necrotizing enterocolitis:treatment based on staging criteria[J]. Pediatr Clin North Am, 1986, 33(1): 179-201. DOI:10.1016/S0031-3955(16)34975-6 (  0) 0) |
| [14] |
Luo Y, Luo J, Peng H. Associations between genetic polymorphisms in the VEGFA, ACE, and SOD2 genes and susceptibility to diabetic nephropathy in the Han Chinese[J]. Genet Test Mol Biomarkers, 2019, 23(9): 644-651. DOI:10.1089/gtmb.2018.0320 (  0) 0) |
| [15] |
刘杰, 周晓慧, 史乾, 等. IL-17家族细胞因子的功能及其在相关疾病中的作用[J]. 现代免疫学, 2014, 34(3): 262-265. (  0) 0) |
| [16] |
Hammad A, Mosaad YM, Hammad EM, et al. Interleukin-17A rs2275913, Interleukin-17F rs763780 and rs2397084 gene polymorphisms as possible risk factors in Juvenile lupus and lupus related nephritis[J]. Autoimmunity, 2016, 49(1): 31-40. DOI:10.3109/08916934.2015.1101071 (  0) 0) |
| [17] |
Jiang L, Zhou X, Xiong Y, et al. Association between interleukin-17A/F single nucleotide polymorphisms and susceptibility to osteoarthritis in a Chinese population[J]. Medicine (Baltimore), 2019, 98(12): e14944. DOI:10.1097/MD.0000000000014944 (  0) 0) |
| [18] |
Eskandari-Nasab E, Moghadampour M, Tahmasebi A. Meta-analysis of risk association between interleukin-17A and F gene polymorphisms and inflammatory diseases[J]. J Interferon Cytokine Res, 2017, 37(4): 165-174. DOI:10.1089/jir.2016.0088 (  0) 0) |
| [19] |
Egan CE, Sodhi CP, Good M, et al. Toll-like receptor 4-mediated lymphocyte influx induces neonatal necrotizing enterocolitis[J]. J Clin Invest, 2016, 126(2): 495-508. (  0) 0) |
| [20] |
Gao X, Ma F, Hao H, et al. Association of VEGFA polymorphisms with necrotizing enterocolitis in Chinese Han population[J]. Pediatr Neonatol, 2019, 60(2): 129-134. DOI:10.1016/j.pedneo.2018.07.002 (  0) 0) |
 2020, Vol. 22
2020, Vol. 22

