2. 浙江省人民医院儿科, 浙江 杭州 310053
注意缺陷多动障碍(attention deficit hyperac-tivity disorder, ADHD)是儿童时期最普遍存在的精神行为障碍,其病因尚不明确[1]。ADHD儿童的核心症状主要有活动过度、注意力无法集中、行为冲动,这些症状极大地影响ADHD儿童的学业成绩、情绪行为及社会交往,严重影响其健康成长及成年后的家庭生活[2-4]。目前国际上通用的ADHD诊断标准是美国精神障碍与统计手册(第5版)(DSM-5)[5]。临床上主要依据DSM-5量表以问卷调查的形式对ADHD进行诊断和疗效评估,但这种方式较为繁琐,缺乏较为直观的分子生物学指标。
microRNA是调节基因转录的单链RNA分子,其作用主要是结合在靶分子mRNA的3′非翻译区(3′UTR),促进mRNA降解,抑制靶基因的转录[6-7]。microRNA在神经系统新陈代谢、神经发育、轴突形成、凋亡等病理生理过程中都有潜在的重要作用[8]。多项神经精神疾病领域研究表明,血液microRNA可以作为疾病诊断的新指标[9-10]。
本课题组先前的研究发现microRNA let-7d在ADHD儿童外周循环中表达升高[11];ADHD模型自发性高血压大鼠(SHR)脑前额皮质中microRNA let-7d表达量升高[12],miR-138-1、34c、296和494表达降低[13],且人为改变microRNA let-7d的表达水平对SHR多动症状影响明显。因此我们猜测,ADHD儿童外周循环中可能存在一些microRNA表达异常,这些差异表达的microRNA有可能成为ADHD诊断及疗效评估的分子指标。随后本课题组收集了ADHD儿童与健康儿童血清样本进行高通量测序,结果显示,ADHD儿童外周血中miR-4655-3p和miR-7641表达显著降低[14],猜想这两种microRNA有可能作为临床诊断ADHD的生物学指标之一。目前尚无关于miR-4655-3p和miR-7641在ADHD发病机制中作用的有关报道,本研究将比较药物治疗前后循环microRNA表达水平与临床症状的关系,以期为ADHD的诊断及疗效评估寻找新的分子生物学指标。
1 资料与方法 1.1 研究对象选取2017年5月至2018年10月就诊于浙江省人民医院儿科门诊,首次诊断为ADHD的儿童80例为研究对象。纳入及排除标准:(1)依据DSM-5诊断标准[5],首次被诊断为ADHD的儿童;(2)经过系统的体格检查、神经系统检查、精神状况检查及相关实验室辅助检查;(3)6周岁及以上的儿童;(4)智商(intelligence quotient, IQ)大于70;(5)近2周内未使用精神药物及其他影响神经精神行为的药物治疗;(6)排除各种精神疾病,如精神发育迟缓、情绪品行障碍等;(7)排除躯体及神经系统等其他器质性疾病。依据治疗情况将80例ADHD儿童分为盐酸哌甲酯治疗组(n=31),其中男23例,女8例,年龄6~11岁,平均年龄8.3±1.8岁,平均体重29.8±4.6 kg,平均身高127±12 cm;盐酸托莫西汀治疗组(n=33),其中男24例,女9例,年龄7~12岁,平均年龄8.7±1.8岁,平均体重29.8±5.2 kg,平均身高129±8 cm;不愿接受治疗的儿童纳入未治疗组(n=16),其中男7例,女9例,年龄7~11岁,平均年龄8.1±1.2岁,平均体重28.3±6.2 kg,平均身高125±10 cm。另选取行健康体检儿童60例为健康对照组,年龄6~12岁,平均年龄8.4±1.7岁,平均体重27.0±4.3 kg,平均身高126±10 cm。4组儿童性别、年龄、身高及体重比较差异均无统计学意义(P > 0.05),具有可比性。本研究获得了浙江省人民医院医学伦理委员会批准,及通过监护人同意并签署书面知情同意书。
1.2 评分量表(1)韦氏智力评分表[15]:测试内容包括语言和操作两大类,测试时间1~2 h。(2)Conners父母评定量表[16]:总分大于10分即需要进一步进行SNAP-V量表评分。(3)SNAP-V量表父母版[17],使用4级评分法评估注意力不集中和多动/冲动两个方面症状。最后把每个问题的得分相加,再除以所有问题总数给予得分。0~1.0分为正常;1.1~1.5为边缘;1.6~2.0分为中度;2.0分以上为严重。
1.3 总RNA抽提及荧光定量PCR检测将ADHD儿童首诊及随访3个月、6个月时,以及健康对照组儿童门诊当天采集的空腹静脉血血清标本用TRIzol试剂(北京天根生化科技有限公司)在室温下处理5 min,然后根据试剂盒说明书提取总RNA。使用特异性逆转录引物从血清总RNA中通过逆转录酶(日本TaKaRa公司)获得cDNA。采用荧光定量PCR对miR-4655-3p和miR-7641进行扩增。根据本课题组前期研究结果显示[14],miR-1273g-3p在所有样本内均有检出、标准差较小且平均信号值较高,因此选择miR-1273g-3p作为内参进行校正。采用Primer Premier 5.0软件设计引物,引物由苏州泓迅生物科技股份有限公司合成,序列见表 1。反应体系(10 μL):SYBR Green qPCR Master Mix(2×)(上海星汉生物科技有限公司)5 μL、上下游引物(40 μmol/L)各0.2 μL、cDNA 1 μL、双蒸馏水3.6 μL。反应条件:94℃ 30 s,60℃ 30 s,72℃ 30 s,30个循环;72℃ 10 min。通过iQ5TM定量PCR检测系统(美国Bio-Rad公司)进行PCR反应,并用iQ5软件分析结果。最后采用2-ΔΔCt法计算基因表达相对定量结果。
| 表 1 引物信息 |
|
|
对ADHD儿童进行为期12周的药物治疗:(1)盐酸哌甲酯片(苏州第壹制药有限公司,批号:H32023102),初始剂量为每日0.3 mg/kg,每周增加0.3 mg/kg,目标剂量为每日1.2 mg/kg,可根据实际临床反应增减目标剂量,如是否有明显的副作用或是否有进一步改善的空间,最大剂量可增加至每日1.8 mg/kg。在第7~10周维持最佳剂量。(2)盐酸托莫西汀胶囊(江苏正大丰海制药有限公司,批号:H20133346),初始剂量为每日0.5 mg/kg,维持3 d后增加给药量至目标剂量为每日1.2 mg/kg,在第7~10周维持最佳剂量。药物依从性:64例愿意接受ADHD药物治疗的儿童中共脱落23例,其中盐酸哌甲酯组10例,盐酸托莫西汀组13例。失访原因主要有:由于副作用大而停止治疗10例,家长认为药物疗效欠佳停止治疗6例,家长认为孩子已经痊愈而不必继续治疗4例,家长担心药物副作用不愿意继续服用2例,因家庭经济原因停止治疗1例。
1.5 统计学分析采用SPSS 21.0统计软件对数据进行统计学分析。正态分布计量资料以均数±标准差(x±s)表示,两组间比较采用两独立样本t检验;多时间点重复测量数据比较采用重复测量方差分析。采用GraphPad Prism 8软件进行两数值变量间Pearson相关分析。P < 0.05为差异有统计学意义。
2 结果 2.1 各组ADHD儿童间首诊和随访时SNAP-V评分变化ADHD儿童首诊、随访3个月及6个月测量的注意力不足及多动冲动症状SNAP-V评分比较差异有统计学意义(P < 0.05)。注意力不足症状SNAP-V评分在各组间比较差异有统计学意义(P < 0.05),多动冲动症状SNAP-V评分在各组间比较差异无统计学意义(P > 0.05)。注意力不足症状SNAP-V评分时间因素与分组因素有交互作用(P < 0.05),多动冲动症状SNAP-V评分时间因素与分组因素无交互作用(P > 0.05)。见表 2。
| 表 2 各组ADHD儿童间首诊和随访SNAP-V评分比较(x±s) |
|
|
治疗前,ADHD儿童miR-4566-5p的相对表达量(0.46±0.31)明显低于健康对照组(2.18±0.85)(t=14.352,P < 0.01);ADHD儿童miR-7641的相对表达量(0.29±0.22)亦明显低于健康对照组(1.80±0.42)(t=23.789,P < 0.01)。
2.3 药物治疗后两种microRNA相对表达量在各组的变化ADHD儿童首诊、随访3个月及6个月测量的miR-4655-3p和miR-7641相对表达量差异均有统计学意义(P < 0.05)。miR-4655-3p和miR-7641相对表达量在各组间比较差异均有统计学意义(P < 0.05)。分组与时间两因素在miR-4655-3p和miR-7641相对表达量中均存在交互作用(P < 0.05)。见表 3。
| 表 3 各组儿童miR-4655-3p和miR-7641的相对表达量比较 |
|
|
两治疗组ADHD儿童(n=41)注意力不足症状SNAP-V评分与miRNA-4655-3p和miRNA-7641的相对表达量均呈显著负相关(分别r=-0.314、-0.495,P < 0.05)。见图 1。
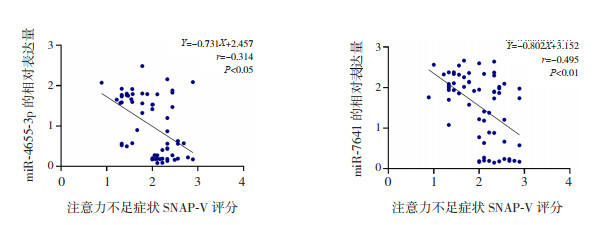
|
图 1 注意力不足症状SNAP-V评分与miR-4655-3p(左)和miR-7641(右)相对表达量的相关性分析图 |
ADHD为研究最多的儿童期疾病之一,在临床治疗上常用的药物主要有盐酸哌甲酯、盐酸托莫西汀等,主要通过调节中枢儿茶酚胺类神经递质多巴胺(DA)和去甲肾上腺素(NA)代谢发挥作用。其中哌甲酯及其控释剂为临床一线治疗药物,大量文献报道其疗效显著。非兴奋剂盐酸托莫西汀为选择性去甲肾上腺素再摄取抑制剂,无药物成瘾性,耐受性好,适合长程使用[18-19]。本研究最终完成为期6个月治疗的41例ADHD儿童治疗结果显示,药物治疗可显著改善ADHD儿童的多动冲动症状。
ADHD其病因目前尚不明确,有研究支持环境因素在ADHD发病中起到重要作用,即表观遗传调控过程。其中一类短链非编码RNA,即microRNA,是这些表观遗传的调节剂之一,被称为转录后调节剂,microRNAs影响大约30%的人类蛋白质编码基因的表达[20-21]。本课题组前期收集的ADHD儿童血清样本二代测序结果显示,miR-4655-3p和miR-7641在ADHD儿童血清中表达显著降低[14],然而并没有对这两种microRNA与药物治疗及临床症状之间的关系进行深入研究。本研究对此次纳入的ADHD儿童采集药物治疗前、治疗3个月及6个月时的血清样本,以及同年龄的健康体检儿童的血清样本,结果显示与健康对照组进行比较,两种microRNA在ADHD儿童中均降低。在接受治疗后,miR-4655-3p和miR-7641的相对表达量均逐渐恢复到正常水平。由此我们可以初步确定,miR-4655-3p和miR-7641在ADHD儿童外周血清中较健康儿童显著降低,随着病情的好转逐渐升高。
ADHD的主要发病机制是中枢儿茶酚胺类神经递质DA和NA代谢障碍造成的轻度脑功能缺陷。本课题组在2010年首次报道了microRNA let-7d在ADHD大鼠模型中的作用,结果显示microRNA let-7d的异常表达可以影响大鼠的多动症状[12]。随后有研究证明血清microRNA let-7d的水平在ADHD组明显高于正常对照组;microRNA let-7d直接作用于LGALS3的3′UTR,从而负性调控LGALS3的表达,而LGALS3的降低能抑制TH的表达,TH是多巴胺合成过程中的限速酶[22],在ADHD发病中起着重要作用。此外,Jiang等[23]发现血清分泌的含miR-137的外泌体通过调节帕金森病中的OXR1来影响神经元的氧化应激。另有研究者发现血浆microRNA可作为早期诊断锰中毒性帕金森综合征生物标志物[24]。这些研究结果均显示,在疾病的发生发展过程中,循环microRNA的表达水平与疾病的临床表现有着紧密的联系。对ADHD儿童临床症状SNAP-V评分与miR-4655-3p及miR-7641的相对表达量进行相关性分析,我们发现注意力不足症状SNAP-V评分与两种microRNA的相对表达量均呈显著负相关。说明miR-4655-3p和miR-7641的表达水平可能通过直接或间接的方式影响ADHD儿童的临床症状,结合microRNA的经典作用途径及药物治疗ADHD的主要作用机制,确定miR-4655-3p和miR-7641的靶向基因及该靶基因在ADHD发病过程中的作用机制还有待后续实验深入研究。
综上所述,miR-4655-3p和miR-7641参与了ADHD的发生发展过程,且经药物治疗后ADHD血清中两种microRNA与临床症状有着相似的转归过程,miR-4655-3p和miR-7641可能作为ADHD诊断及疗效评估的分子标记物。
| [1] |
Polanczyk GV, Willcutt EG, Salum GA, et al. ADHD prevalence estimates across three decades:an updated systematic review and meta-regression analysis[J]. Int J Epidemiol, 2014, 43(2): 434-442. (  0) 0) |
| [2] |
Zhou F, Wu F, Zou S, et al. Dietary, nutrient patterns and blood essential elements in chinese children with ADHD[J]. Nutrients, 2016, 8(6). pii: E352. https://www.researchgate.net/publication/303871513_Dietary_Nutrient_Patterns_and_Blood_Essential_Elements_in_Chinese_Children_with_ADHD
(  0) 0) |
| [3] |
Tandon PS, Sasser T, Gonzalez ES, et al. Physical activity, screen time, and sleep in children with ADHD[J]. J Phys Act Health, 2019, 16(6): 416-422. (  0) 0) |
| [4] |
Song M, Lauseng D, Lee S, et al. Enhanced physical activity improves selected outcomes in children with ADHD:systematic review[J]. West J Nurs Res, 2016, 38(9): 1155-1184. (  0) 0) |
| [5] |
陈美英, 张斌. 《精神障碍诊断与统计手册第五版》双相障碍分类和诊断标准的循证依据[J]. 中华脑科疾病与康复杂志(电子版), 2014, 4(4): 207-211. (  0) 0) |
| [6] |
Krol J, Loedige I, Filipowicz W. The widespread regulation of microRNA biogenesis, function and decay[J]. Nat Rev Genet, 2010, 11(9): 597-610. (  0) 0) |
| [7] |
Lewis BP, Shih IH, Jones-Rhoades MW, et al. Prediction of mammalian microRNA targets[J]. Cell, 2003, 115(7): 787-798. (  0) 0) |
| [8] |
Omran A, Elimam D, Shalaby S, et al. MicroRNAs:a light into the "black box" of neuropediatric diseases?[J]. Neuromolecular Med, 2012, 14(4): 244-261. (  0) 0) |
| [9] |
Wright C, Gupta CN, Chen J, et al. Polymorphisms in MIR137HG and microRNA-137-regulated genes influence gray matter structure in schizophrenia[J]. Transl Psychiatry, 2016, 6: e724. (  0) 0) |
| [10] |
Perkins DO, Jeffries CD, Jarskog LF, et al. MicroRNA expression in the prefrontal cortex of individuals with schizophrenia and schizoaffective disorder[J]. Genome Biol, 2007, 8(2): R27. (  0) 0) |
| [11] |
Wu LH, Peng M, Yu M, et al. Circulating microRNA let-7d in attention-deficit/hyperactivity disorder[J]. Neuromolecular Med, 2015, 17(2): 137-146. (  0) 0) |
| [12] |
Wu L, Zhao Q, Zhu X, et al. A novel function of microRNA let-7d in regulation of galectin-3 expression in attention deficit hyperactivity disorder rat brain[J]. Brain Pathol, 2010, 20(6): 1042-1054. (  0) 0) |
| [13] |
Wu LH, Cheng W, Yu M, et al. Nr3C1-Bhlhb2 axis dysregulation is involved in the development of attention deficit hyperactivity[J]. Mol Neurobiol, 2017, 54(2): 1196-1212. (  0) 0) |
| [14] |
朱萍, 潘景, 张帆, 等. 与ADHD相关的外周循环microRNA芯片筛选及分析[J]. 医学研究杂志, 2019, 48(5): 59-63. (  0) 0) |
| [15] |
Piovesana AM, Harrison JL, Ducat JJ. The development of a motor-free short-form of the Wechsler Intelligence Scale for Children-Fifth Edition[J]. Assessment, 2019, 26(8): 1564-1572. (  0) 0) |
| [16] |
Munkvold LH, Manger T, Lundervold AJ. Conners' continuous performance test (CCPT-Ⅱ) in children with ADHD, ODD, or a combined ADHD/ODD diagnosis[J]. Child Neuropsychol, 2014, 20(1): 106-126. (  0) 0) |
| [17] |
Austerman J. ADHD and behavioral disorders:assessment, management, and an update from DSM-5[J]. Cleve Clin J Med, 2015, 82(11 Suppl 1): S2-S7. (  0) 0) |
| [18] |
Sugrue D, Bogner R, Ehret MJ, et al. Methylphenidate and dexmethylphenidate formulations for children with attention-deficit/hyperactivity disorder[J]. Am J Health Syst Pharm, 2014, 71(14): 1163-1170. (  0) 0) |
| [19] |
Türkoğlu S, Çetin FH. Atomoxetine in the treatment of adolescent with trichotillomania and attention-deficit/hyperactivity disorder[J]. Clin Neuropharmacol, 2018, 41(2): 84-85. (  0) 0) |
| [20] |
Hechtman L. ADHD medication treatment and risk of psychosis[J]. Lancet Psychiatry, 2019, 6(8): 632-633. (  0) 0) |
| [21] |
Fineberg SK, Kosik KS, Davidson BL. MicroRNAs potentiate neural development[J]. Neuron, 2009, 64(3): 303-309. (  0) 0) |
| [22] |
Tabrez S, Jabir NR, Shakil S, et al. A synopsis on the role of tyrosine hydroxylase in Parkinson's disease[J]. CNS Neurol Disord Drug Targets, 2012, 11(4): 395-409. (  0) 0) |
| [23] |
Jiang Y, Liu J, Chen L, et al. Serum secreted miR-137-containing exosomes affects oxidative stress of neurons by regulating OXR1 in Parkinson's disease[J]. Brain Res, 2019, 1722: 146331. (  0) 0) |
| [24] |
吴静静.血浆microRNA作为早期诊断锰中毒性帕金森综合征生物标志物的研究[D].南宁: 广西医科大学, 2019. http://cdmd.cnki.com.cn/Article/CDMD-10598-1019108619.htm
(  0) 0) |
 2020, Vol. 22
2020, Vol. 22


