支气管哮喘是儿童时期最常见的呼吸道慢性炎症性疾病[1]。近年来,儿童哮喘发病率呈上升趋势,严重影响了儿童的身心健康[1-2]。槐杞黄作为一种免疫调节剂,可激发机体免疫系统,提高患儿抵抗非特异性感染的能力[3-4],在临床中用于哮喘的辅助治疗和预防,但其对哮喘的作用及机制尚未明确。有研究表明,Th1/Th2功能失衡,Th2细胞优势分化是哮喘的发病机制之一[5],而转录因子T-bet和GATA3是决定Th1、Th2细胞亚群分化方向的重要因素[6]。本研究通过对哮喘大鼠模型应用槐杞黄后,观察其肺组织炎症改变,嗜酸性粒细胞水平及细胞因子变化,Th1、Th2细胞比例变化,以及T-bet和GATA3表达变化,以进一步探究槐杞黄对哮喘的作用及其机制。
1 材料与方法 1.1 实验动物及试剂SPF级6~8周龄雄性Sprague-Dawley大鼠40只,购于北京华阜康生物科技股份有限公司,饲养于华中科技大学同济医学院动物实验中心SPF动物房内,饲养环境为22~25℃,12 h/12 h昼夜交替,自由饮水及摄食。槐杞黄颗粒(国药准字B20020074,10 g/袋,启东盖天力药业有限公司),吸入用布地奈德混悬液(药品批号324102,阿斯利康有限公司),卵白蛋白(OVA,美国Sigma公司),IL-3、IL-4、IL-5、IgE、IFN-γ ELISA试剂盒购于武汉伊莱瑞特生物科技有限公司。
1.2 溶液配制致敏液:将OVA溶于新鲜配制的10% Al(OH)3溶液中,充分搅拌混匀,使OVA的终浓度为0.2%。注意混悬液制备后,为保证致敏效果,应于1 h内使用。雾化液配制:将OVA与0.9% NaCl溶液搅拌使其混合均匀,使OVA的终浓度为1%。
1.3 实验分组及哮喘模型的建立将大鼠随机分为4组,分别为对照组、哮喘模型组、布地奈德组、槐杞黄组,每组10只。通过OVA致敏并激发建立哮喘大鼠模型[7]。哮喘模型组致敏:第1天采用传统的10点致敏法,包括两前后足趾4点,两侧腹股沟2点,颈部1点,背部左、中、右3点,每点皮下注射0.05 mL OVA致敏液,另腹腔注射0.5 mL OVA致敏液,OVA致敏总体积为每只大鼠1 mL。激发:第14~21天,将小鼠置于密闭容器中并以1%OVA溶液雾化30 min/d。布地奈德组:致敏和激发同哮喘组,从第14天开始,激发前30 min以布地奈德2 mg雾化,每天1次;槐杞黄组:致敏和激发同哮喘组,从第14天开始,激发前1~2 h,以槐杞黄4 g/kg剂量溶于2~3 mL水中,每天灌胃1次。对照组皮下及腹腔注射、雾化、灌胃,哮喘模型组、槐杞黄组激发前雾化,以及哮喘模型组、布地奈德组灌胃均用等量生理盐水替代。
1.4 标本的采集造模成功后24 h,以10%水合氯醛麻醉大鼠,取外周血。开胸游离出气管和肺,结扎右侧支气管,用0.5 mL生理盐水灌洗大鼠左侧支气管肺泡3次,取支气管肺泡灌洗液(BALF)备用。取左肺及脾脏,-80℃冰箱保存。取小鼠近肺门处的左肺组织,在4%多聚甲醛中固定约4~6 h,进行常规的石蜡包埋及切片,随机选取每个样本3张切片,以行染色检测。
1.5 苏木精-伊红染色将制备好的切片常规固定、脱水,以进行苏木精-伊红(HE)染色,用来观察气道的病理学改变。
1.6 BALF中嗜酸性粒细胞检测取各组大鼠BALF,4℃、1 200 r/min离心5 min后,用1 mL Hank′s液重悬细胞,取0.2 mL涂片,瑞吉液染色,至少计数200个细胞作细胞分类计数,依据形态学特点计算嗜酸性粒细胞比例。
1.7 ELISA法检测细胞因子使用IL-3、IL-4、IL-5、IgE、IFN-γ ELISA试剂盒(武汉伊莱瑞特生物科技有限公司)来测定每组大鼠BALF中细胞因子的浓度。实验步骤按照试剂盒说明书进行操作。根据标准曲线计算各组细胞因子的浓度。
1.8 流式细胞仪检测Th1及Th2细胞比例分离外周血及脾脏淋巴细胞,加1 mL RPMI1640完全培养基悬浮,每管加入终浓度为20 ng/mL的佛波醇,终浓度为1 μg/mL的钙离子霉素,终浓度为2 μmol/L的莫能菌素,37℃、5%CO2培养箱孵育4 h;然后加PBS 1 mL,2 000 r/min离心5 min,洗涤2次,PBS 100 μL重悬;加入CD4抗体,4℃避光孵育30 min;2 000 r/min离心3 min,PBS清洗2遍;加入2%多聚甲醛0.5 mL,室温固定20 min;离心,弃上清,加含0.1%皂素的PBS 1 mL,室温孵育10 min;离心,弃上清,加入300 μL PBS重悬,平均分成3管;每管分别加入IFN-γ、IL-4,4℃避光孵育30 min;离心,弃上清,2 000 r/min离心3 min,PBS清洗2遍;每管加入1%多聚甲醛0.1 mL,固定10 min;上机检测。
1.9 RT-PCR检测T-bet mRNA及GATA-3 mRNA水平取-80℃冰箱中保存的各组大鼠新鲜冰冻肺组织100 mg,匀浆后采用TRIzol试剂裂解10 min,提取总RNA,用紫外分光光度计测定RNA的纯度和浓度。提取出的总RNA经逆转录反应体系逆转录成cDNA。10倍稀释cDNA,采用实时荧光定量PCR检测,引物由武汉巴菲尔生物技术服务有限公司设计并合成,序列见表 1。反应体系:cDNA(10×)4 μL,上下游引物(10 μmol/L)各0.4 μL,SYBR Green/Flourescein qPCR Master Mix(2×)10 μL,dH2O 5.2 μL。反应条件:50℃ 2 min,95℃10 min;95℃ 30 s,60℃ 30 s,40个循环。绘制溶解曲线,最终数据以2-△△Ct法进行分析。
| 表 1 引物序列 |
|
|
取不同组大鼠肺组织匀浆,细胞裂解液裂解,4℃下12 000 r/min离心5 min,取上清,BSA法测定蛋白浓度。每组取40 μg蛋白上样,聚丙烯酰胺凝胶电泳进行分离、转膜,以5%脱脂牛奶室温封闭1 h,电泳。加一抗过夜,漂洗后加脱脂牛奶稀释的辣根过氧化物酶标记的二抗,室温反应1 h,化学发光底物显色,胶片曝光,扫描。采用的一抗包括兔多克隆抗体T-bet(55 KD)(美国Invitrogen公司,PA5-40573)、兔多克隆抗体GATA-3(50 KD)(武汉三鹰生物技术有限公司,10417-1-AP)、兔多克隆抗体GAPDH(内参)(杭州贤至生物有限公司,AB-P-R 001),所有一抗稀释比例为1 : 1 000;采用的二抗是辣根过氧化物酶标记的羊抗兔二抗(武汉博士德生物工程有限公司,BA1054),稀释比例为1 : 50 000。所得图像在图像分析系统上分析,结果分别以T-bet、GATA-3与GAPDH的比值进行半定量分析。
1.11 统计学分析采用SPSS 17.0统计软件对数据进行统计学分析。符合正态分布计量资料采用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验。不符合正态分布计量资料采用中位数(四分位间距)[M(P25,P75)]表示,多组间比较采用Kruskal-Wallis H非参数检验,组间两两比较采用Nemenyi法。P < 0.05为差异有统计学意义。
2 结果 2.1 各组大鼠肺组织切片病理学表现对照组大鼠肺泡结构正常;哮喘组大鼠肺泡壁结构受损,肺泡壁增厚,支气管腔狭窄,大量黏膜上皮细胞脱落,支气管与血管周围重度炎性细胞浸润;槐杞黄组大鼠肺泡腔较模型组变大,支气管壁水肿程度减轻,炎性细胞浸润程度明显降低,其病理变化程度与布地奈德组相近。见图 1。
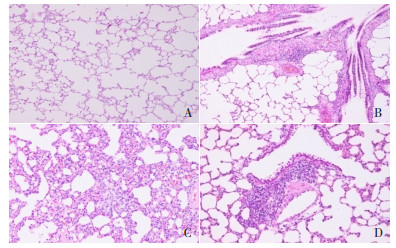
|
图 1 各组大鼠肺组织病理变化(苏木精-伊红染色,×400) A为对照组,肺泡结构正常,肺泡腔内无渗出液,间隔无增宽,肺泡上皮细胞排列有序,肺泡壁厚度正常,无炎性细胞浸润;B为哮喘组,肺泡壁结构受损,肺泡壁增厚,支气管腔狭窄,大量黏膜上皮细胞脱落,支气管与血管周边疏松水肿及纤维化形成,支气管上皮杯状细胞化生,支气管与血管周围重度炎性细胞浸润,可见增生的淋巴滤泡;C为布地奈德组,肺泡腔较哮喘组变大,支气管腔有少量脱落的上皮细胞,支气管壁水肿程度减轻,炎性细胞浸润程度明显降低,可见部分增生的淋巴滤泡;D为槐杞黄组,病理变化程度与布地奈德组相近。 |
各组大鼠BALF中嗜酸性粒细胞比例比较差异有统计学意义(n=10,F=28.537,P < 0.001)。哮喘组嗜酸性粒细胞比例(0.140±0.023)较对照组(0.016±0.005)显著增高(P < 0.01),槐杞黄组嗜酸性粒细胞比例(0.099±0.022)较哮喘组显著下降(P < 0.01),槐杞黄组与布地奈德组(0.080±0.030)相比差异无统计学意义(P > 0.05)。
2.3 各组大鼠BALF中细胞因子水平变化哮喘组BALF中IL-3、IL-4、IL-5、IgE浓度较对照组显著增加,IL-10、INF-γ浓度较对照组显著下降(P < 0.01);槐杞黄组IL-3、IL-4、IL-5、IgE浓度较哮喘组显著降低,IL-10、INF-γ浓度较哮喘组显著升高(P < 0.01),但与对照组相比,差异仍有统计学意义(P < 0.05);槐杞黄组与布地奈德组相比差异无统计学意义(P > 0.05)。见表 2。
| 表 2 各组大鼠BALF中细胞因子水平比较 |
|
|
哮喘组外周血及脾脏Th1细胞比例较对照组显著降低(P < 0.05),Th2细胞比例较对照组显著增高(P < 0.05);槐杞黄组外周血及脾脏Th1细胞比例较哮喘组显著增加(P < 0.05),Th2细胞比例较哮喘组显著下降(P < 0.05);槐杞黄组外周血及脾脏Th1细胞比例与布地奈德组相比差异均无统计学意义(P > 0.05),槐杞黄组外周血Th2细胞比例与布地奈德组比较差异无统计学意义(P > 0.05),但脾脏Th2细胞比例高于布地奈德组(P < 0.05)。见表 3。
| 表 3 各组外周血及脾脏Th1、Th2细胞比例比较 |
|
|
哮喘组T-bet mRNA及其蛋白表达较对照组显著降低(P < 0.05),GATA-3 mRNA及其蛋白表达较对照组显著增加(P < 0.05);槐杞黄组及布地奈德组T-bet mRNA及其蛋白表达较哮喘组显著增加(P < 0.05),GATA-3 mRNA及其蛋白表达较哮喘组显著下降(P < 0.05),但与对照组比较差异仍有统计学意义(P < 0.05);槐杞黄组与布地奈德组比较上述指标差异均无统计学意义(P > 0.05)。见图 2,表 4。
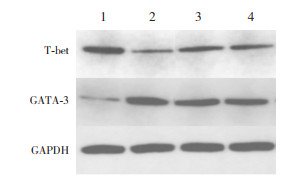
|
图 2 Western blot检测各组T-bet及GATA-3蛋白表达电泳图 1.对照组;2.哮喘组;3.布地奈德组;4.槐杞黄组。 |
| 表 4 各组T-bet、GATA-3 mRNA及其蛋白相对表达量 |
|
|
经典免疫学说认为,Th1/Th2免疫失衡及Th2细胞优势分化是导致哮喘发病的重要机制[5]。Th1/Th2细胞失衡的同时,Th2细胞相关的细胞因子如IL-3、IL-4、IL-5、IgE等分泌增加,而Th1细胞相关的细胞因子IL-10、INF-γ等分泌减少,启动气道炎症及过敏反应,导致哮喘发作[8]。槐杞黄是一种真菌类药物,由槐耳菌、枸杞子、黄精等组成,槐耳的主要活性成分是槐耳多糖蛋白,其中由6个单糖结合18种氨基酸组成的结合蛋白,具有免疫调节作用[9]。临床研究表明,槐杞黄有助于儿童哮喘的治疗[10-11],但作用机制未明。
本研究结果显示,哮喘模型大鼠肺组织肺泡壁结构受损,肺泡壁增厚,支气管腔狭窄,黏膜上皮细胞脱落,支气管与血管周围重度炎性细胞浸润;槐杞黄干预后,支气管壁水肿程度减轻,管腔狭窄缓解,炎性细胞浸润程度明显降低,与布地奈德干预后效果相当,表明槐杞黄可显著降低哮喘所致肺泡壁损伤及气道炎症反应。哮喘模型组大鼠BALF中嗜酸性粒细胞比例较对照组显著升高,槐杞黄干预后BALF中嗜酸性粒细胞比例较哮喘组明显下降,与布地奈德组比较差异无统计学意义,表明槐杞黄能显著降低气道中嗜酸性粒细胞比例。
细胞因子IL-3、IL-4、IL-5均为Th2细胞产生。IL-4能诱导IgE的产生,抑制Th1细胞活化并分泌细胞因子,与IL-3协同刺激肥大细胞增殖,促进炎症及过敏反应性疾病;IL-5主要功能是刺激嗜酸性粒细胞增殖、分化及活化,同时还促进嗜碱性粒细胞释放组胺和白三烯等炎症介质;IL-10和INF-γ均为Th1细胞因子,可起到下调炎症反应的作用[5]。本研究结果显示,哮喘组大鼠BALF中IL-3、IL-4、IL-5、IgE浓度显著升高,IL-10、INF-γ浓度明显降低;槐杞黄干预后,IL-3、IL-4、IL-5、IgE浓度下降显著,IL-10、INF-γ浓度明显增高,与布地奈德干预的效果相当,表明槐杞黄能减轻哮喘发作时的炎症反应,减轻哮喘症状。张琴珍等[12]对槐杞黄在哮喘大鼠中的作用进行研究发现,槐杞黄可以抑制哮喘大鼠血清IgE和IL-5合成,促进INF-γ合成,调节Th1/Th2平衡,发挥其抗嗜酸性粒细胞性气道炎症的作用。
流式细胞仪检测结果更为直观的显示Th1和Th2细胞比例,哮喘组大鼠外周血及脾脏Th1细胞比例下降,Th2细胞比例增加,槐杞黄干预后Th1细胞比例增加,Th2细胞比例下降,与布地奈德干预的效果相当。这一结果与Liang等[13]进行的小鼠哮喘模型的研究结果相似,表明槐杞黄能纠正哮喘发作时的Th1/Th2免疫失衡,阻断哮喘病理进程。
特异性转录因子T-bet和GATA3是决定Th1、Th2细胞亚群分化方向的关键因素[6]。T-bet是人类免疫细胞中首次发现的T-box转录因子家族成员,是Th1淋巴细胞特异性转录因子。GATA3是GATA转录因子家族成员,是Th2细胞功能亚群分化的关键调控因子,通过诱导Th2细胞因子的产生,上调Th2细胞分化,还能通过抑制T-bet的表达,抑制Th1细胞信号通路[13]。本研究结果显示,哮喘组大鼠T-bet表达显著降低,GATA3表达显著上升,使Th1/Th2淋巴细胞比例失衡;而槐杞黄干预后,T-bet表达明显升高,GATA-3表达明显降低,逆转了Th1/Th2失衡,这一作用与布地奈德干预的效果相当,表明槐杞黄通过调节转录因子T-bet和GATA-3的表达,起到纠正哮喘发作时Th1/Th2细胞比例失衡的作用,从而缓解哮喘发作。
综上所述,槐杞黄能明显减轻哮喘大鼠肺泡壁损伤和气道炎症反应,降低嗜酸性粒细胞比例,同时使IL-3、IL-4、IL-5、IgE浓度显著下降,IL-10、INF-γ浓度显著增高,从而纠正Th1/Th2失衡,达到缓解哮喘发作的目的,这一作用是可能通过调节转录因子T-bet、GATA-3来实现的。槐杞黄口服可缓解哮喘病情,效果与吸入糖皮质激素相当,可作为儿童哮喘治疗的推荐方案。
| [1] |
中华医学会儿科学分会呼吸学组, 《中华儿科杂志》编辑委员会. 儿童支气管哮喘诊断与防治指南(2016年版)[J]. 中华儿科杂志, 2016, 54(3): 167-181. DOI:10.3760/cma.j.issn.0578-1310.2016.03.003 (  0) 0) |
| [2] |
李昌崇, 朱丽丽. 儿童支气管哮喘急性发作期治疗进展-各国支气管哮喘防治指南比较[J]. 中华实用儿科临床杂志, 2017, 32(16): 1209-1214. DOI:10.3760/cma.j.issn.2095-428X.2017.16.003 (  0) 0) |
| [3] |
张红艳, 赵淑景, 田菲. 槐杞黄颗粒佐治小儿咳嗽变异性哮喘对免疫球蛋白、T淋巴细胞亚群及细胞因子的影响[J]. 海南医学院学报, 2017, 23(3): 404-407. (  0) 0) |
| [4] |
刘金, 闫虹, 陈小庚, 等. 槐杞黄颗粒对重型肺炎支原体肺炎患儿免疫功能的影响[J]. 中国当代儿科杂志, 2017, 19(7): 759-762. (  0) 0) |
| [5] |
Strickland DH, Holt PG. T regulatory cells in childhood asthma[J]. Trends Immunol, 2011, 32(9): 420-427. DOI:10.1016/j.it.2011.06.010 (  0) 0) |
| [6] |
Kardan M, Rafiei A, Ghaffari J, et al. Effect of ginger extract on expression of GATA3, T-bet and ROR-γt in peripheral blood mononuclear cells of patients with allergic asthma[J]. Allergol Immunopathol (Madr), 2019, 47(4): 378-385. DOI:10.1016/j.aller.2018.12.003 (  0) 0) |
| [7] |
王雅娟, 赵一婷, 戴斌, 等. 两种大鼠哮喘模型的比较[J]. 中国药理学通报, 2014, 30(8): 1175-1178. DOI:10.3969/j.issn.1001-1978.2014.08.028 (  0) 0) |
| [8] |
Hu C, Li Z, Feng J, et al. Glucocorticoids modulate Th1 and Th2 responses in asthmatic mouse models by inhibition of Notch1 signaling[J]. Int Arch Allergy Immunol, 2018, 175(1-2): 44-52. DOI:10.1159/000485890 (  0) 0) |
| [9] |
张书琳, 崔岚巍. 槐耳及其复方制剂槐杞黄颗粒的研究进展[J]. 医学综述, 2015, 21(1): 114-116. DOI:10.3969/j.issn.1006-2084.2015.01.045 (  0) 0) |
| [10] |
金世杰, 饶花平, 丁妞, 等. 槐杞黄颗粒辅助GINA方案治疗支气管哮喘患儿疗效观察[J]. 中医儿科杂志, 2012, 8(3): 20-22. DOI:10.3969/j.issn.1673-4297.2012.03.010 (  0) 0) |
| [11] |
景晓平, 陈文霞. 槐杞黄颗粒预防支气管哮喘儿童呼吸道反复感染的临床观察[J]. 上海中医药大学学报, 2014, 28(3): 39-42. (  0) 0) |
| [12] |
张琴珍, 尚云晓. 槐杞黄对哮喘大鼠BALF中IL-5及INF-γ的影响[J]. 实用药物与临床, 2011, 14(1): 4-6. DOI:10.3969/j.issn.1673-0070.2011.01.002 (  0) 0) |
| [13] |
Liang P, Peng S, Zhang M, et al. Huai Qi Huang corrects the balance of Th1/Th2 and Treg/Th17 in an ovalbumin-induced asthma mouse model[J]. Biosci Rep, 2017, 37(6): BSR20171071. DOI:10.1042/BSR20171071 (  0) 0) |
 2020, Vol. 22
2020, Vol. 22


